核酸适体-捕获探针预杂交修饰制备免标记腺苷电化学传感器
2014-04-27徐欢郭小玉文颖杨海峰
徐欢,郭小玉,文颖,杨海峰*
(1.上海师范大学生命与环境科学学院化学系,上海 200234)
(2.上海市位育初级中学,上海 200031)
核酸适体-捕获探针预杂交修饰制备免标记腺苷电化学传感器
徐欢1,2,郭小玉1,文颖1,杨海峰1*
(1.上海师范大学生命与环境科学学院化学系,上海 200234)
(2.上海市位育初级中学,上海 200031)
核酸适体(Aptamer)是单链寡核苷酸片段,对靶分子具有高亲和力和高特异性,具有常规识别分子(如抗体和酶)所不具备的一些优点,该文基于核酸适体制备了一种用于检测腺苷的免标记电化学传感器。将腺苷的核酸适体与带巯基的捕获探针通过硫-巯键组装到金电极表面,用6-巯基己醇(MCH)作为缺陷探针封闭电极表面,得到的MCH/Aptamer-Capture/Au界面,构筑的电化学传感器对腺苷具有特异性识别功能,检测腺苷的线性范围为1×10-6mol/L~2.5×10-4mol/L,检测限为0.1 μmol/L,相对标准偏差(R.S.D)为2.0%。该传感器对腺苷的检测具有灵敏度高、检测范围宽、制作简便、成本低,并且具有良好的选择性和重现性。
免标记;适体;金电极;电化学传感器;腺苷
0 引言
核酸适体(也称核酸适配体或核酸适配子),是一类由RNA或DNA碱基组成的单链寡核苷酸片段,对靶分子具有较高亲和力和特异性。它是由一种名为指数富集配体系统进化的体外筛选技术(简称SELEX技术)[1~4],在试管中得到不同分析物的核苷酸片段,方法类似于单克隆抗体。核酸适体与常规识别分子(如抗体和酶)相比具备一些优点:如可商业化的体外化学合成、良好的化学稳定性以及热变性的可回复性、结构的可修饰性、易保存等;稳定性上比抗体稳定、另外核酸适体具有明显优势和互补性[5]。适体都小于100个核苷酸,组成比抗体小,因此经过组装可以具有较高的表面密度,所以基于核酸适体的生物传感器性能更优,其研究和应用具有很广阔的前景,目前大量的研究者投入到核酸适体的研究[6~12]。
核酸适体电化学传感器是用核酸适体作为分子识别原件,通过不同方法固定到信号转换器上,通过电子导线连接成装置,再结合电化学的方法,用于待测物质的定性和定量检测。Rodriguez等[13]运用电化学交流阻抗技术制备了用于识别溶菌酶的免标记核酸适体传感器,在没有加入溶菌酶时,由于核酸适体链带负电,对[Fe(CN)6]4-/3-形成了天然的电子屏障,阻抗变大;当适体与带正电荷的溶菌酶特异性结合后,就吸引了[Fe(CN)6]4-/3-,发生了电子传递导致阻抗变小,通过阻抗的变化来达到对蛋白质的检测;Du等[14]利用两段核酸适体通过结合凝血酶增大系统阻抗来放大信号,再结合三磷酸腺苷使阻抗减小,通过阻抗的变化实现一支传感器同时可检测两种物质。
腺苷(Adenosine)是能量化合物三磷酸腺苷(ATP)的中心,是核苷的一种,由β-N9-配糖键连结呋喃核糖和腺嘌呤的其中一部分。腺苷在生物化学上是非常重要的,是以三磷酸腺苷(ATP)或者双磷酸腺苷(ADP)的形式转移能量的,又或是以环状单磷酸腺苷(cAMP)进行信号传递等。在人类的中枢神经系统中,腺苷在种种生理及病理过程中也扮演着性能良好的调节器作用[15]。因此,检测腺苷的方法引起了越来越多的关注[16~18]。
在该工作中,设计了一种免标记的核酸适体电化学传感器用于检测腺苷,采用电化学交流阻抗方法,对核酸适体传感器检测目标物腺苷前后的电化学阻抗变化实现对腺苷的定量检测。首先在处理洁净的金电极上组装核酸适体和捕获探针的混合液,而后用6-巯基己醇(MCH)作为缺陷探针封闭电极表面,制备得MCH/Aptamer-Capture/Au结构的核酸适体传感器,用于腺苷的检测。
1 实验部分
1.1 实验试剂
核酸适体序列:3'-ATG TCT GGA AGG AGG CGT TAT GAG GGG GTC CA-5'(0.2 μmol/L,由PBS溶液配制成)(上海生工);捕获探针序列:5'-SH-(CH2)6-TAC AGA CCT TCC-3'(0.2 μmol/L,由PBS溶液配制成)(上海生工);6-巯基己醇(MCH, 1 mmol/L)(sigma公司);腺苷(Adenosine)、鸟苷(Guanosine)、尿苷(Uridine)、胞啶(Cytidine)(国药集团);10 mmol/L的PBS缓冲溶液(pH=7.4):由KH2PO4和Na2HPO4调配而成;实验试剂等级均为分析纯;实验用水为二次超纯水(>18MΩ·cm),且需经过灭菌器高压灭菌。
1.2 实验仪器
Veeco Nano III a Multimode原子力显微镜(AFM),表征使用平板印刷金膜电极为基底(禅谱科技股份有限公司);电化学工作站(CHI 660d型;上海辰华有限公司);立式压力蒸汽灭菌器(YXQ-LS-30SII;上海博迅实业有限公司)。
1.3 实验方法
1.3.1 适体与探针杂交溶液的配制
将浓度为0.2 μmol/L的核酸适体和探针序列以体积比1.5∶1相互混合16 h,使其完全杂交成双螺旋结构,简称:适体-探针(Aptamer-Capture)混合液,通过巯基将核酸适体组装到金电极表面。
1.3.2 核酸适体传感器的制备
金电极(d=2 mm)首先用金相砂纸(6号)打磨平滑以除去界面上残留的实验杂质,接着依次用0.3 μm和0.05 μm的α-三氧化二铝粉轻轻画圈打磨,抛光成镜面,并分别用二次超纯水、乙醇、二次超纯水对金电极进行超声洗净,紧接着将金电极用氮气吹干于0.5 mol/L的硫酸溶液中进行循环伏安扫描至出现金电极的特征峰,扫描范围为-0.2~1.5 V。最后用二次超纯水快速冲洗电极吹干备用。
取3 μL适体-探针混合液滴涂于处理干净的金电极界面上,自组装2 h,然后用二次超纯水快速浸洗1 min以除去未组装的混合液,并用氮气吹干;接着再取3 μL,1 mol/L的MCH滴涂于电极表面,自组装2 h,用于封闭电极,即制得用于检测腺苷的核酸适体电化学传感器,记作MCH/Aptamer-Capture/Au electrode。
用灭菌水配制不同浓度的腺苷溶液、鸟苷溶液、尿苷溶液和胞啶溶液,分别取5 μL滴涂于制备好的核酸适体电化学传感器上,在室温下杂交90 min,即目标物的检测过程。
图1为电极的制备过程和腺苷的检测过程示意图。
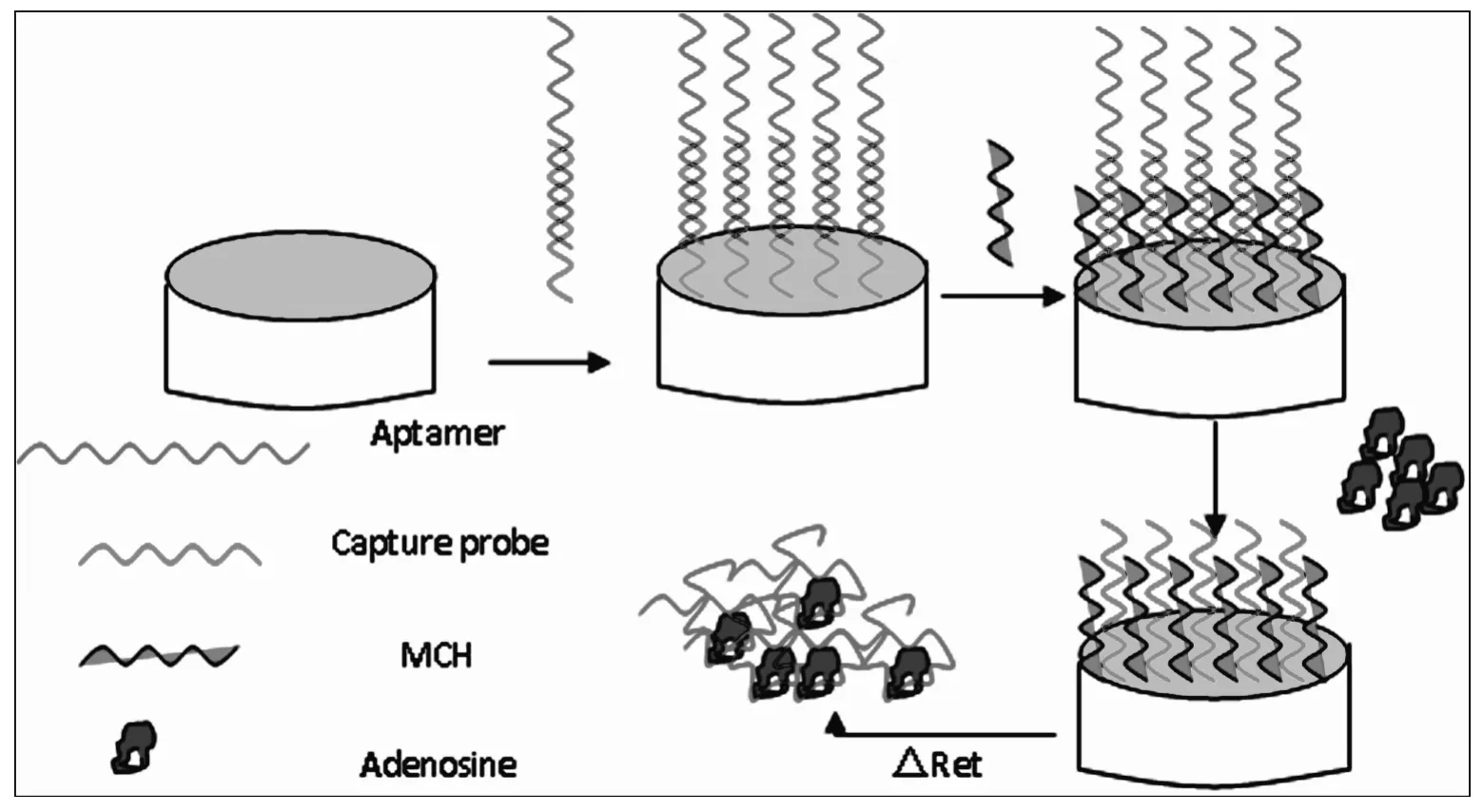
图1 传感器组装过程及检测示意图Fig.1Schematic diagram for preparation of the sensing system and the detection of adenosine
1.3.3 测试方法
采用电化学交流阻抗技术来检测腺苷,并结合循环伏安法测试核酸适体传感器。实验在室温条件下,于含10 mmol/L[Fe(CN)6]4-/3-和1 mol/L KCl的PBS缓冲溶液(pH=7.4)中进行;电化学交流阻抗的测定的频率范围设置为0.01~105Hz,所加的交流电位幅值为5 mV,循环伏安曲线设置在0.5~-0.2 V范围内扫描。电化学实验采用传统的三电极系统:修饰电极为工作电极,铂电极和Ag/AgCl电极分别作为对电极和参比电极。
2 结果与讨论
2.1 循环伏安法表征
图2是不同修饰电极的循环伏安曲线。从图中可见:裸金电极(a)在溶液中呈现出一对峰形良好的准可逆氧化还原峰,在修饰了适体-探针混合液之后,电极上的峰电流稍有降低,即曲线b;再当组装了6-巯基己醇后(曲线c),峰电流下降较大,说明MCH起到了电极表面的封闭作用;曲线d是核酸适体传感器与0.1 mmol/L腺苷溶液杂交之后的循环伏安曲线,曲线中可见峰电流较曲线c又稍有增大,说明电极表面的腺苷适体可能被拽离电极表面使表面有孔洞出现而促进了体系内的电子传递过程。
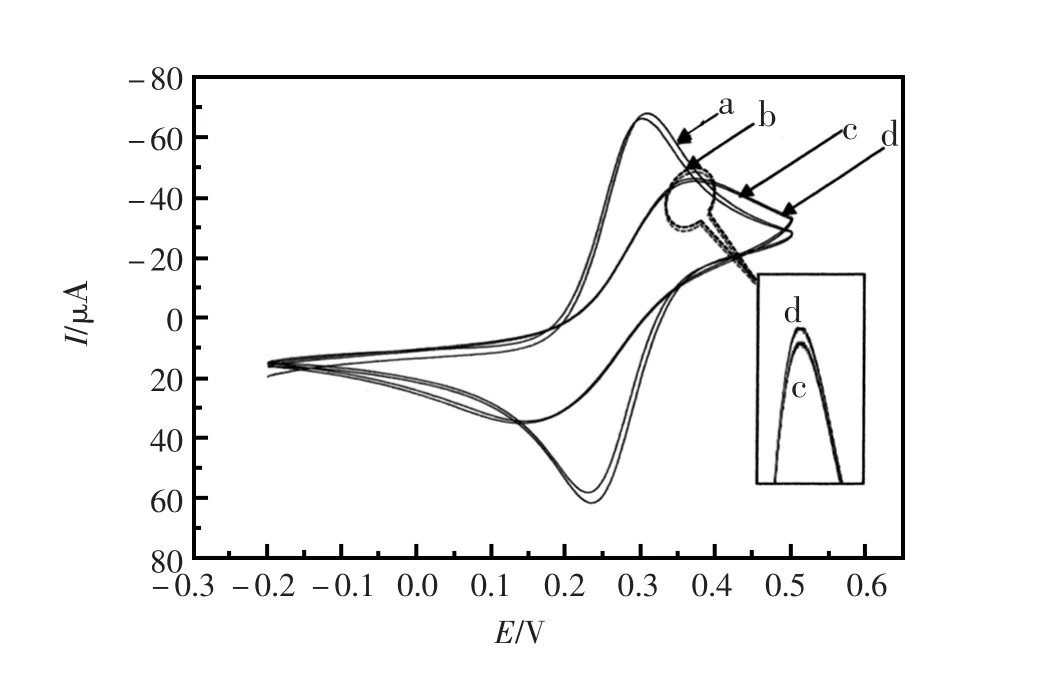
图2 (a)裸金电极;(b)Aptamer-Capture Probe/Au electrode;(c)MCH/Aptamer-Capture Probe/Au electrode;(d)MCH/Aptamer-Capture Probe/Au electrode与0.1 mmol/L腺苷杂交后在5 mmol/L[Fe(CN)6]4-/3-(含有0.1 mol/L KCl)的PBS(100 mmol/L,pH=7.4)溶液中的循环伏安曲线Fig.2(a)bare Au electrode;(b)Aptamer-Capture Probe/Au electrode;(c)MCH/Aptamer-Capture Probe/Au electrode;(d) MCH/Aptamer-Capture Probe/Au electrode treated with 0.1 mmol/L adenosine in PBS(100 mmol/L,pH=7.4)containing 5 mmol/L[Fe(CN)6]4-/3-and 0.1 mol/L KCl
2.2 电化学交流阻抗表征
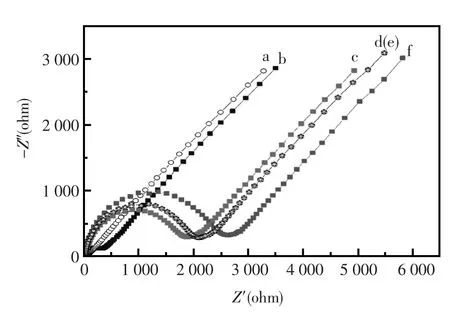
图3 不同修饰电极的Nyquist曲线;(a)裸金电极;(b) Aptamer-Capture Probe/Au修饰电极;(c)MCH/ Aptamer-Capture Probe/Au修饰电极与0.1 mmol/L腺苷作用后;(d)MCH/Aptamer-Capture Probe/Au修饰电极;(e)MCH/Aptamer-Capture Probe/Au修饰电极在PBS溶液中浸泡90 min后;(f)MCH/Aptamer-Capture Probe/Au修饰电极与1 μmol/L腺苷作用后Fig.3Nyquist plots of impedance spectra obtained at(a) bare Au electrode;(b)Aptamer-Capture Probe/Au electrode;(c)MCH/Aptamer-Capture Probe/Au electrode; treated with 0.1 mmol/L adenosine(d)MCH/Aptamer-Capture Probe/Au electrode;(e)MCH/Aptamer-Capture Probe/Au electrode treated in PBS for 90 min;(f)MCH/ Aptamer-Capture Probe/Au electrode treated with 1 μmol/L adenosine
交流阻抗图进一步表征了组装和检测过程。从图3中,曲线a是裸金电极在10 mmol/L [Fe(CN)6]4-/3-,含1mol/LKCl的PBS缓冲溶液(pH= 7.4)中的电化学交流阻抗曲线,从中可见其为线状,说明在体系中电子传递情况良好。当组装上适体-探针混合液后,即曲线b,交流阻抗曲线出现一个小的半圆,说明在体系中电子传递过程受到了阻碍,进而也说明适体-探针序列成功的组装到了电极表面;当电极再组装上MCH后,曲线d,图中可见交流阻抗曲线的半圆急剧变大,说明体系中电子传递被进一步阻碍,也说明MCH成功的封闭了电极界面上的吸附位点;曲线c和曲线f是制备的核酸适体传感器分别检测了0.1 mmol/L和1 μmol/L的腺苷溶液后的交流阻抗曲线,从图中可得交流阻抗随着目标分子浓度增大,阻抗呈先变大后变小的趋势,当目标分子浓度再大时,阻抗又呈现变大的趋势;并且为了说明交流阻抗的变化是由于核酸适体传感器对腺苷的特异性结合能力,在相同情况下在不含腺苷的PBS溶液放置90 min后用电化学交流阻抗技术检测阻抗变化即曲线e,发现阻抗不变,从而证明了核酸适体是由于和腺苷的特异性结合使得检测前后发生了阻抗变化。鉴于这样的实验现象,对核酸适体传感器检测腺苷的过程的机理进行了推测:
①目标物低浓度时,腺苷仅与适体中的一段发生了杂交,未能使适体完全离开电极表面,并且由于适体比较长,在杂交过程中可能会出现交缠现象,EIS呈现变大;
②目标物浓度稍大时,电极表面的适体与腺苷几乎完全杂交而使适体离开电极表面,EIS表现为变小;
③当目标物浓度过大时,由于电极表面适体已被完全杂交拽离电极表面,但由于杂交过程中电极表面过分拥挤,使电极上遗留的物质发生了交缠或倒塌,EIS又呈现变大[19~20]。
2.3 原子力显微镜(AFM)表征
图4是核酸适体传感器层层构筑在平板印刷金膜电极上的原子力显微镜表征图。图4a为裸金膜电极,可见表面非常的光滑,说明了平板印刷金膜电极表面非常均匀;图4b为组装了适体-探针混合液和MCH后的核酸适体传感器,其表面可见略带有孔洞状的膜,组装的物质在表面较均匀;图4c是核酸适体传感器与1 μmol/L腺苷溶液杂交90 min后,图中可见有似小颗粒状的腺苷分子黏在电子表面;图4d是核酸适体传感器与0.1 mmol/L腺苷溶液杂交90 min后,可得修饰电极表面又显得稍光滑了一些,图4e是核酸适体传感器与1 mmol/L的腺苷溶液杂交90 min后,图中表面可见好似粘了厚厚的一层膜。
为了进一步探讨核酸适体传感器检测腺苷的过程的机理,分别从原子力显微镜的三维图中测量了上述核酸适体传感器的层层组装后的表面粗糙度,如图5,得出结果为:5a裸金膜电极的表面粗糙度为3.914 nm,5b当组装了适体-探针混合液和MCH后的核酸适体传感器的表面粗糙度为37.136 nm,5c核酸适体传感器与1 μmol/L腺苷溶液杂交后的表面粗糙度为38.007 nm,5 d核酸适体传感器与0.1 mmol/L腺苷溶液杂交后的表面粗糙度为13.437 nm,5e核酸适体传感器与1 mmol/L的腺苷溶液杂交后,表面粗糙度为16.640 nm。从而也从另一角度证实了上面提出的核酸适体传感器检测腺苷的过程的机理。

图4 (a)裸金片,(b)核酸适体传感器,(c)与1 μmol/L腺苷反应后,(d)与0.1 mmol/L腺苷反应后,(e)与1 mmol/L腺苷反应后的金片的原子力显微镜平面表征图Fig.4AFM images of(a)bare Au;(b)Modified electrode;(c)After reacting with 1 μmol/L adenosine;(d)After reacting with 0.1 mmol/L adenosine;(e)After reacting with 1 mmol/L adenosine

图5 (a)裸金片;(b)核酸适体传感器;(c)核酸适体传感器与1 μmol/L腺苷反应后;(d)核酸适体传感器与0.1 mmol/L腺苷反应后;(e)与1 mmol/L腺苷反应后的金片的原子力显微镜三维表征图Fig.5AFM 3D images of(b)Modified electrode;(c)After reacting with 1 μmol/L adenosine;(d)After reacting with 0.1 mmol/L adenosine;(e)After reacting with 1 mmol/L adenosine
2.4 核酸适体传感器对腺苷的检测
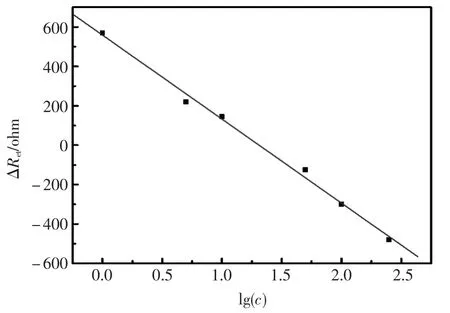
图6 核酸适体传感器与腺苷杂交前后的交流阻抗变化值ΔRet与腺苷浓度对数的线性关系Fig.6The plot of ΔRetvs logarithm of the concentration of adenosine
将制备好的核酸适体传感器对不同浓度的腺苷溶液进行杂交90 min,对传感器在杂交前后的阻抗变化ΔRet作为检测信号,来对腺苷做定量测定。并且每个数据为三次平行测定的ΔRet的平均值,利用ΔRet与腺苷溶度的对数作图,即图6,在腺苷浓度范围为1×10-6mol/L~2.5×10-4mol/L内,ΔRet与腺苷浓度的对数成很好的线性关系,线性相关系数R为0.997,最低检测限为0.1 μmol/L。
2.5 核酸适体传感器的选择性
为了证明核酸适体传感器与腺苷是特异性的结合,用了其他三个物质分别为尿苷、胞啶和鸟苷,浓度均为1 mmol/L,在相同条件下与制备的核酸适体传感器进行了杂交检测,如图7。得到的实验结果表明,尿苷和胞啶与核酸适体杂交前后的ΔRet几乎没有变化;当与1 mmol/L鸟苷杂交前后ΔRet有些许增大,可能是鸟苷与腺苷的结构较为相似造成了一定的干扰[21];但当核酸适体传感器与1 μmol/L腺苷杂交时ΔRet的变化远大于1 mmol/L鸟苷杂交后的ΔRet值,说明制备的核酸适体传感器对腺苷的检测具有较好的选择性。
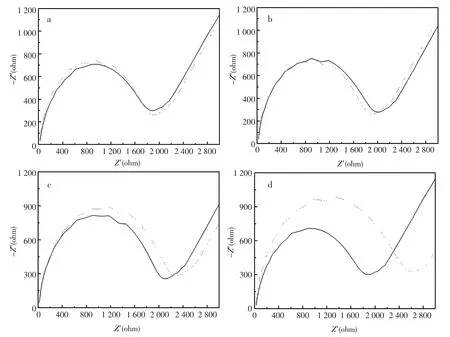
图7 核酸适体传感器分别与1 mmol/L的(a)尿苷(b)胞啶(c)鸟苷和(d)1 μmol/L的腺苷进行作用前(实线)后(虚线)检测得到的EIS图Fig.7EIS recorded before(solid line)after(dotted line)adding 1 mmol/L(a)Uridine(b)Cytidine(c)Guanosine and(d)1 μmol/L adenosine
2.6 核酸适体传感器的重现性
用5支相同条件下制备的核酸适体传感器对0.1 mmol/L的腺苷溶液杂交前后变化的交流阻抗值ΔRet进行了比较,得其相对标准偏差(R. S.D.)为2.0%,说明了制备的核酸适体传感器具有良好的重现性。
3 结论
该文中制备了一种新型的免标记核酸适体传感器,采用电化学交流阻抗技术定量检测腺苷,通过实验现象对杂交过程中的作用机理做了推测。实验数据结果表明该传感器对腺苷的检测具有灵敏度高、检测范围宽、制作简便、成本低,并且具有良好的选择性和重现性。
[1]Breaker R R.DNA aptamers and DNA enzymes[J]. Chem.Biol.,1997,1:26~31.
[2]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990, 346:818~822.
[3]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249:505~510.
[4]Hamaguchi N,Ellington A,Stanton M.Aptamer beacons for the direct detection of proteins[J].Anal.Biochem., 2001,294:126~131.
[5]Song S P,Wang L H,Li J,et al.Aptamer-based biosensors[J].Anal.Chem.,2008,27(2):108~117.
[6]Levy M,Cater S F,Ellington A D.Quantum-dot aptamer beacons for the detection of proteins[J].Chem.Bio. Chem.,2005,6:2 163~2 166.
[7]Heyduk E,Heyduk T.Nucleic acid-based fluorescence sensors for detecting proteins[J].Anal.Chem.,2005,77: 1 147~1 156.
[8]Pavlov V,Shlyahovsky B,Willner I.Fluorescence detection of DNA by the catalytic activation of an aptamer/ thrombin complex[J].J.Am.Chem.Soc.,2005,127: 6 522~6 523.
[9]Jhaveri S D,Kirby R,Conrad R,et al.Designed signaling aptamers that transduce molecular recognition to changes in fluorescence intensity[J].J.Am.Chem.Soc.,2000, 122:2 469~2 473.
[10]Stojanovic M N,Prada P,Landry D W.Fluorescent sensors based on aptamer self-assembly[J].J.Am.Chem. Soc.,2000,122:11 547~11 548.
[11]Stojanovic M N,Prada P,Landry D W.Aptamer-based folding fluorescent sensor for cocaine[J].J.Am.Chem. Soc.,2001,123:4 928~4 931.
[12]Stojanovic M N,Landry D W.Aptamer-based colorimetric probe for cocaine[J].J.Am.Chem.Soc.,2002,124: 9 678~9 679.
[13]Rodriguez M C,Kawde A N,Wang J.Aptamer biosensor for label-free impedance spectroscopy detection of proteins based on recognition-induced switching of the surface charge[J].Chem.Commun.,2005,4 267~4 269.
[14]Du Y,Li B L,Wei H,et al.Multifunctional Label-Free Electrochemical Biosensor Based on an Integrated Aptamer[J].Anal.Chem.,2008,80:5 110~5 117.
[15]Dale N,Pearson T,Frenguelli B G.Direct measurement of adenosine releaseduring hypoxia in the CA1 region of the rat hippocampal slice[J].Journal of Physiology, 2000,526(1):143~155.
[16]Zimmermann H,Braun N.Ecto-nucleotidases-molecular structures,catalytic properties,and functional roles in the nervous system[J].Progress in Brain Research,1999, 120:371~385.
[17]Pedata F,Latini S,Pugliese A M.Investigations into the adenosine outflow from hippocampal slices evoked by ischemia-like conditions[J].J.Neurochemistry,1993,61 (1):284~289.
[18]Dunwiddie T V,Masino S A.The role and regulation of adenosine in the central nervous system[J].Annual Review of Neuroscience,2001,24(4):31~55.
[19]李哲建,刘志敏.基于纳米MnO2的免标记型的电化学适体传感器用于腺苷的测定[J].化学传感器,2009, 29(3):47~51.
[20]Tanja H M K,Peng H,Christian S,et al.Effect of probe density and hybridization temperature on the response of an electrochemical hairpin-DNA sensor[J].Anal. Chem.,2008,80:9 460~9 466.
[21]Zheng F,Wu Z S,Zhang S B.Aptamer-based electrochemical biosensors for highly selective and quantitative detection of adenosine[J].Chem.Res.,2008,24(2): 138~142.
Aptamer-capture-prehybridization-modification for label-free adenosine electrochemical sensor
Xu Huan1,2,Guo Xiao-yu1,Wen Ying1,Yang Hai-feng1*
(1.Department of Chemistry,College of life and Environment Sciences,Shanghai Normal University, Shanghai 200234,China)
(2.Shanghai Wei Yu Middle School,Shanghai 200031,China)
Compared with conventional recognition molecules(such as antibodies and enzyme),aptamer as an oligonucleotide clip has hiwgh affinity and high specificity of target molecules..Herein,we prepared a label-free aptamer electrochemical biosensor for the detection of adenosine.Firstly,the cleaned gold electrode covalently bonded the aptamer-capture system and then the Aptamer-Capture/Au electrode was immersed into 2-Mercaptoethanol(MCH)solution to prepare the MCH/Aptamer-Capture/Au-based electrochemical sensor.It can specifically identify the adenosine for the detection linear range from 1×10-6to 2.5×10-4mol/L with the detection limit of 0.1 μmol/L. On the same condition,the detection of the same concentration of adenosine,the relative standard deviation(R.S.D) was about 2.0%.The resultant adenosine sensor has high sensitivity,wide detection range,easy-made process,low cost as well as good selectivity and reproducibility.
label-free;aptamer;Au electrode;electrochemical sensor;adenosine
国家自然科学面上基金项目(21475088)
*通讯联系人,E-mail:haifengyang@yahoo.com;Tel.:Fax:021 64322511(杨海峰).
