基于杂交链式反应放大信号的适体传感器的研究
2014-04-27彭德敏袁若
彭德敏,袁若
(西南大学化学化工学院,重庆 400715)
基于杂交链式反应放大信号的适体传感器的研究
彭德敏,袁若*
(西南大学化学化工学院,重庆 400715)
该文基于多孔纳米钯复合物(pPdNPs)和杂交链式反应(HCR)对信号的放大,成功制备出一个高灵敏、无标记的夹心式新型电化学适体传感器用于凝血酶(TB)的检测。首先,沉积的纳米金有很好的生物相容性和大的比表面积,用于固载更多的凝血酶适体链(TBAI);同时,利用多孔纳米钯大的表面积来固载更多的TBAII和单链DNA(S1);电极上的TBAI捕获溶液中的TB后,与多孔纳米钯复合物(pPdNs-TBAⅡ-S1)组装;再与S1、单链DNA(S2)和电活性物质亚甲基蓝(MB)的混合物通过杂交链式反应,形成内嵌有大量MB的双链DNA(dsDNA),以达到信号放大的效果。经实验研究表明,该传感器构建方法简单,切实可行,大大提高了电化学适体传感器的灵敏度。
电化学适体传感器;凝血酶;纳米粒子;杂交链式反应;多孔纳米钯
0 引言
适体也称为核酸适体、适配体、适配子等。可以是RNA,单链DNA或者双链DNA[1~3],长度一般为25~80个核苷酸[4~6]。适体与靶分子的结合和抗原—抗体作用相似,适体具有明显优于抗体的许多特性。具有靶分子范围广、与配体作用亲和高度稳定性、高特异性强、制备方法简单、安全经济等优点。目前,适体技术开始广泛应用于分子识别、实验诊断、疾病治疗、药物研究及生物传感器等方面。
由于可以实现对材料的修饰和优化以满足各种应用需求,近日纳米复合材料已经成为一个新的研究热点,并被广泛应用于生物传感器的构建。纳米材料不仅被广泛用于增加电极的比表面积和促进电极界面间的电子转移[7~8],还用来固载大量的生物分子或其他物质,从而放大电化学信号和增强生物传感器的性能。多孔纳米钯作为一种新型的纳米材料,具有大的比表面积、优异的导电性和良好的生物相容性[9],可以链接更多的TBA和单链DNA1(S1),以至于和S1、S2形成双链螺旋DNA结构可固载更多的电活性物质亚甲基蓝(MB)。因此,用多空纳米钯来构建生物传感器,不仅可以通过一个简单的固定过程增加电极表面电活性物质的固载量,同时还可以充当一个电子转移通道,有效地加速电极和检测分子之间的电子转移,从而导致更快速和灵敏的电流响应。
杂交链式反应(hybridization chain reaction,HCR)是一个无酶参与的反应过程,通过设计合理的不同寡核苷酸,由一小段核苷酸链作为引发剂诱导寡核苷酸相互杂交形成一条具有二维或三维空间结构的dsDNA[10]。由于它是引发剂引起的反应,可以有效减少假阳信号,降低背景电流。并且,每一引发剂可以触发一个HCR反应形成长链dsDNA,使许多寡核苷酸连接在一起,可使传感器的信号放大。Chen等[11]利用杂交链式反应信号放大技术构建了超灵敏电致化学发光传感器。通过杂交链式反应得到的长链dsDNA能将大量的发光物质嵌入其中,大大提高了传感器灵敏度。Chen等[12]同样也利用杂交链式反应形成dsDNA结合电活性物质氨基钌构建了简单、灵敏的免标记型电化学传感器。由于杂交链式反应不需要酶的加入,以核苷酸链作为引发剂诱导链聚合,反应条件温和,操作简单,可适用于其他传感器的信号放大。
因此,该文基于多孔纳米钯复合物(pPdNPs)和杂交链式反应双重放大构建了非标记型电化学适体传感器。金纳米粒子首先固定在玻碳电极表面,用于固载凝血酶适体链(TBAI)和结合目标物凝血酶(TB);同时,利用多孔钯纳米粒子大的表面积来固载更多的TBAII和单链DNA(S1),用于放大响应电流;当电极上的TBAI捕获溶液中的TB后,与多孔纳米钯复合物(pPdNs-TBAⅡ-S1)组装;再与S1、单链DNA(S2)和电活性物质亚甲基蓝(MB)的混合物通过杂交链式反应,形成内嵌有大量MB的双链DNA(dsDNA),使所得的响应信号进一步增加,从而有效地提高了电极灵敏度。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器公司),pHS-4C型酸度计(成都方舟科技开发公司),BRANSONIC 200超声清洗仪(德国BRANSON ULTRASCHALL公司),AB204-S电子天平(瑞士Metter Toledo公司)。实验采用三电极体系,修饰过的金电极(GCE,φ=4mm)为工作电极,铂电极为辅助电极,饱和甘汞电极(SCE)为参比电极。
凝血酶(TB),氯金酸(HAuCl4),L-半胱氨酸、血红蛋白(BHB)、赭曲霉毒素A(OTA)、牛血清白蛋白(BSA)、亚甲基蓝(MB)和巯基己烷(96%,HT)购于Sigma公司(美国),含有0.1 mol/L KCl和5.0 mmol/L Fe(CN)64-/3-的0.1 mol/L PBS缓冲溶液(pH=7.0)为循环伏安测试底液。
巯基标记的凝血酶适体链(TBA):5'-SH-(CH2)6-GGTTGGTGTGGTTGG-3'
单链DNA(S1):5'-NH2-ATAGCAATTAAGCCAGCCAGGTTCGGTGCAT-NH2-3'
单链DNA(S2):5'-NH2-GCTGGCTTAATTGCTATATGCACCGAACCTG-NH2-3'
均购于上海生工生物。实验室用水均为二次去离子水。
1.2 多孔纳米钯粒子的制备
多孔纳米钯粒子依据如下步骤制备:首先,取0.4 mL浓度为10 mmol/L的氯钯酸钾溶液,18 mg的氯代十六烷基吡啶和5 mL蒸馏水于烧杯中并将上述混合溶液搅拌均匀。其次,在搅拌的条件下将0.3 mL的新制备的抗坏血酸(0.1 mol/L)溶液快速滴加到上述溶液中。然后将所得溶液转移至20 mL反应釜中在35℃条件下加热3 h。最后将所得到的溶液离心,洗涤两次。
1.3 电化学传感器的制备
将玻碳电极[11](GCE,Φ=4 mm)在麂皮上分别用0.3和0.05 μm的Al2O3粉打磨抛光成镜面,用乙醇和蒸馏水超声清洗,清洗后的电极置于常温下晾干,然后,将电极在-0.2 V恒电位下置于2 mL HAuCl4(1%)溶液中沉积30 s,形成一层致密纳米金层,用于固载巯基标记的凝血酶适体链TBA。用去离子水清洗电极后滴加20 μL TBA溶液(2.5 μmol/L)在电极表面并孵育14~16 h。孵育完成后,为了封闭电极表面的非特异性结合位点,用10 μL HT(1.0 mmol/L)溶液滴至电极表面孵育40 min,电极洗净,将适体传感器置于4℃的冰箱中保存待用。图1为电化学适体传感器逐步修饰过程的示意图。
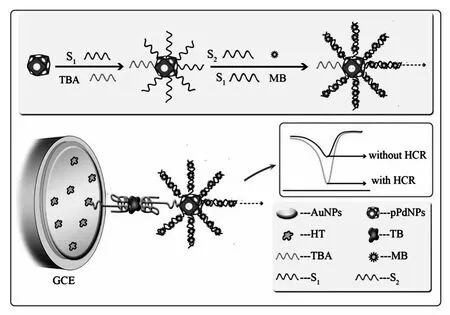
图1 电化学适体传感器逐步修饰过程示意图Fig.1The schematic illustration of the aptasensor fabrication process
1.4 测试方法及检测原理
该实验采用的是三电极体系:裸玻碳电极及修饰电极为工作电极,铂丝电极为对电极,饱和甘汞电极(SCE)为参比电极。在含有0.1 mol/L KCl和5.0 mmol/L Fe(CN)64-/3-的0.1 mol/L PBS(pH=7.0)缓冲溶液中进行,采用循环伏安法[12](CV)和差分脉冲伏安法[13](DPV)对电极的响应性能进行测试,循环伏安法一般扫描电位为-0.45~0.05 V(vs.SCE),电位扫描速度为50 mV/s。差分脉冲伏安法扫描电位为-0.7~0.1 V(vs.SCE),脉冲宽度为0.06,振幅为0.05 V,采样宽度为0.02。
适体传感器电流响应信号通过夹心反应模式得到,在对目标物凝血酶定量分析时,传感器表面凝血酶适体链与样品溶液中的凝血酶分子特异性结合后,凝血酶分子再与pPdNPs-TBAⅡ-S1复合物结合,在S1和S2的存在下发生杂交链式反应形成。通过静电吸附的作用电活性物质亚甲基蓝固载在双链dsDNA上,使修饰电极在发生特异识别前后的差分脉冲电流值发生变化。随着特异识别反应程度的加深,测得的响应电流值随凝血酶浓度的增加而增强,并与凝血酶样品的浓度对数成正比例关系。
2 结果与讨论
2.1 电极组装过程的循环伏安表征
循环伏安法已被证实是一种非常有力的界面研究工具,该实验利用它来研究所制备的适体传感器的电化学特性。图2是电极层层组装过程在含有0.1 mol/L KCl和5.0 mmol/L Fe(CN)64-/3-的0.1 mol/L PBS(pH=7.0)缓冲溶液中的循环伏安表征图谱。曲线a是玻碳电极的循环伏安图谱,有一对良好的Fe(CN)33-/4-氧化还原峰。b是当将纳米金修饰在电极表面后测得的曲线,循环伏安氧化还原峰电流明显增强,这是因为nano-Au具有优良的导电性。当电极表面修饰上TBAⅠ后,由于TBAⅠ具有一定的电惰性,循环伏安氧化还原峰电流明显降低(曲线c)。接着,在用HT封闭修饰电极表面的非特异性吸附位点之后,由于HT具有封闭性能,所以循环伏安氧化还原峰电流进一步降低(曲线d)。e是制备好的电极与20 nmol/L目标物TB溶液孵育40 min后测得的曲线,由于电惰性的TB结合在了电极表面,循环伏安氧化还原峰电流持续降低。
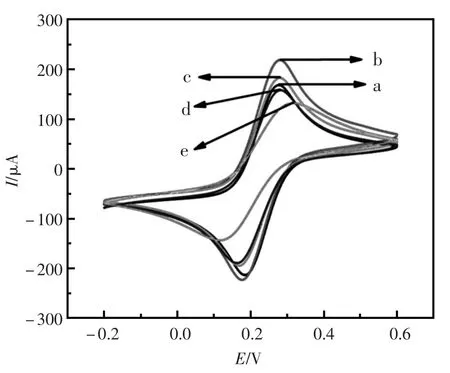
图2 电极在自组装过程中的循环伏安图谱Fig.2Cyclic voltammograms of different modified electrodes in 0.1mol/L PBS with 0.1 mol/L KCl and 5.0 mmol/L Fe(CN)64-/3-(pH7.0):(a)glassy carbon electrode;(b) nano-Au films modified electrode;(c)combined with TBA; (d)blocked with HT;(e)combined with thrombin (20 nmol/L).All potentials are given vs.SCE and the scan rate was 50 mV/s
2.2 时间的优化
TBA-TB特异识别的时间对适体传感器响应性能有着重大的影响。图3是传感器在不同时间测试得到的电流响应值。当适体传感器与20 nmol/L的TB标准血清样品依次孵育10,20,30, 40,50 min,然后再将传感器置于含Fe(CN)33-/4-的缓冲溶液中进行CV检测。该文课题组发现,在40 min以前TBA-TB特异识别的电流响应值不断减小,然而40 min之后基本保持不变,说明TBA-TB特异识别已经达到饱和。所以,在该实验过程中40 min作为适体传感器的孵育时间。
2.3 不同修饰电极的电化学对比
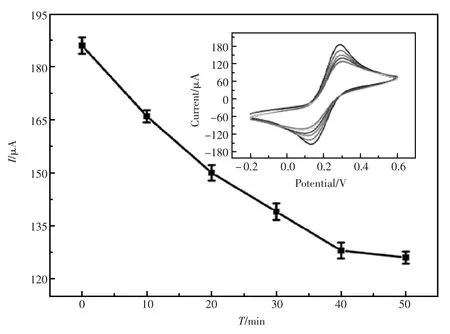
图3 适体传感器孵育时间的影响Fig.3Influence of the incubation time on current response of the aptasensor
为了考察多孔钯纳米粒子和杂交链式反应对传感器电流响应的增强作用。分别用差分脉冲伏安法考察了不同传感器的电流值:(a)只孵育TB(10 nmol/L)的传感器,(b)修饰有的pPdNPs-TBAⅡ-S1复合物传感器,(c)修饰有的pPdNPs-TBAⅡ-S1复合物进行HCR放大的传感器。由图4可以看出,修饰有pPdNPs-TBAⅡ-S1复合物并进行的HCR放大的传感器在0.1 mol/L PBS(pH= 7.0)缓冲溶液为测试底液得到的电流变化值最大,且灵敏度明显增强。由此可以看出,HCR放大技术对传感器的响应电流有重大影响,可使传感器的灵敏性增强,各浓度之间的差别更加明显。
2.4 响应曲线
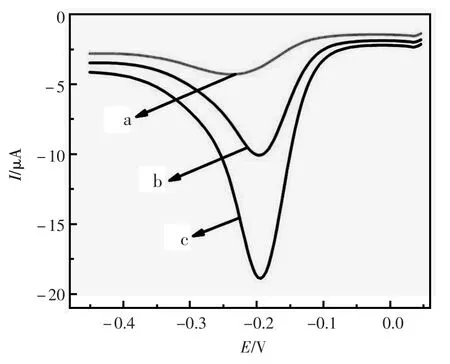
图4 不同传感器的差分脉冲图谱Fig.4The DPVs of various electrodes.(a)in the absence of TB;(b)in the present of TB(10 nmol/L)with pPdNPs-TBAⅡ-S1and(c)with pPdNPs-TBAⅡ-S1HCR amplification
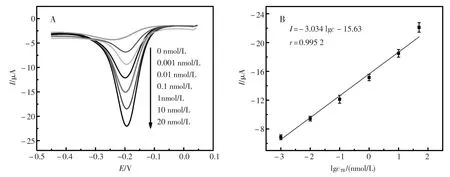
图5 (A)孵育不同浓度凝血酶后的还原峰,(B)传感器在PBS缓冲溶液中测试所得的还原峰电流与凝血酶浓度的标准曲线Fig.5(A)Incubated with different concentrations of TB after reduction peaks,(B)Aptaensors in PBS buffer solution (pH=7.0)to test the reduction peak current and the concentration of TB standard curve
在对目标物进行定量分析时,在适体传感器上孵育不同浓度的TB并进行后续步骤后在0.1 mol/L PBS(pH=7)中用差分脉冲伏安法进行检测。传感器上的凝血酶适体链捕获溶液中的凝血酶后与pPdNPs-TBAⅡ-S1复合物反应,并通过杂交链式反应形成含有大量电活性物质MB的双链dsDNA,从而得到电化学信号(图5 A)。从实验可得,该电化学传感器在所测凝血酶浓度范围内(0.001~20 nmol/L)呈现良好线性关系(图5 B)。线性方程是I=-15.63-3.034 lgc,相关系数r= 0.995 2,检测下限为0.000 3 nmol/L。
2.5 电化学适体传感器选择性分析
电化学适体传感器的选择性通过对传感器孵育不同干扰物质来做对照试验。在电化学传感器孵育如BSA(100 nmol/L)、Hb(100 nmol/L)、L-半胱氨酸(100 nmol/L)、OTA(100 nmol/L)等不同干扰物质,传感器测得的还原峰电流没有明显的变化。然而,将含有凝血酶的五种混合液(mix)孵育在电化学适体传感器上时,其测得的还原峰电流与只孵育凝血酶所得的还原峰电流没有明显的变化。综上所述,该电化学适体传感器选择性较好,只对凝血酶特异性吸附。实验对比结果如图6所示。
3 结论
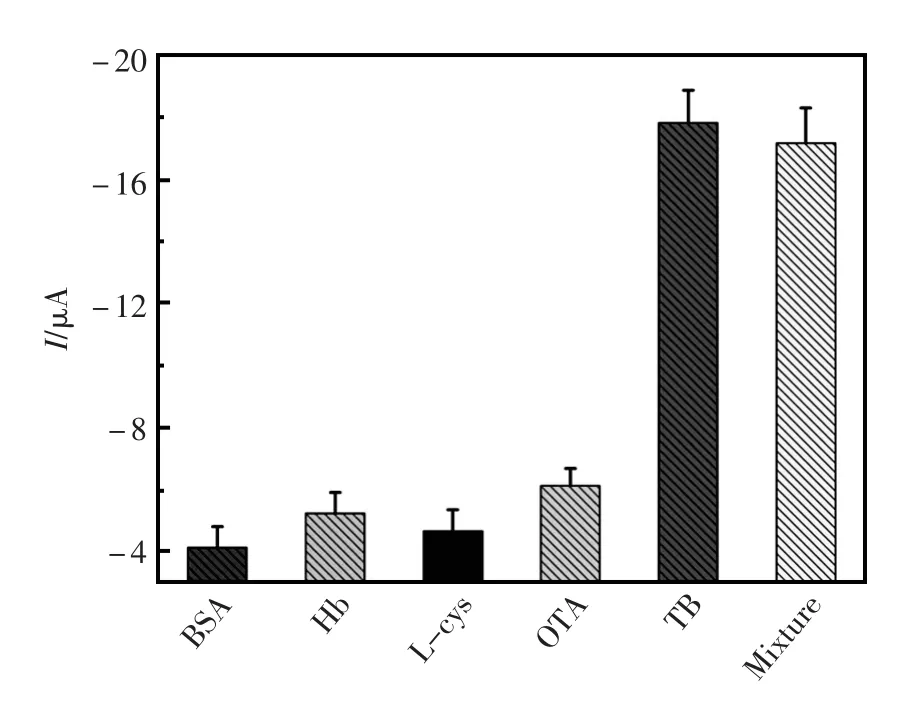
图6 电化学适体传感器的选择性Fig.6The specificity of the proposed electrochemical aptasensor
该实验基于pPdNPs和HCR的放大成功制备出一个高灵敏、无标记的夹心式新型电化学适体传感器用于TB的检测。在实验过程中,沉积的纳米金有很大的比表面积和优异的导电性,可固载更多TBAI并能加快电子的传递;同时,利用多孔钯纳米粒子大的表面积来固载更多的TBAII和S1;电极上的TBA捕获溶液中的TB后,与pPdNs-TBAⅡ-S1组装;再与S1、S2和电活性物质MB的混合物通过杂交链式反应,形成内嵌有大量MB的双链dsDNA,从而达到信号放大的效果。该适体传感器具有检测限低,灵敏度高,稳定性强,制作简单等优点,在临床诊断方面有一定的潜在应用价值。
[1]Tang D P,Yuan R,Chal Y Q.Ultrasensitive electrochemical immunosensor for clinical immunoassay using thionine-doped magnetic gold nanospheres as labels and horseradish peroxidase as enhancer[J].Analytical Chemistry,2008,80(5):1 582~1 588.
[2]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990, 346(6287):818~822.
[3]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505~ 510.
[4]Jayasena S D.Aptamers:An emerging class of molecules that rival antibodies in diagnostics[J].Clinical Chemistry,1999,45(9):1 628~1 650.
[5]Song S,Wang L,Li J,et al.Aptamer-based biosensors [J].Trac-Trends in Analytical Chemistry,2008,27(2): 108~117.
[6]Wu Z S,Guo M M,Zhang S B,et al.Reusable electrochemical sensing platform for highly sensitive detection of smallmoleculesbasedonstructure-switching signaling aptamers[J].Analytical Chemistry,2007,79 (7):2 933~2 939.
[7]Wang S P,Wu Z S,Qu F L,et al,A novel electrochemical immunosensor based on ordered Au nano-prickle clusters[J].BiosensorsandBioelectronics,2008,24(4): 1 020~1 026.
[8]Lu X B,Zhang H J,Ni Y W,et al.Porous nanosheetbased ZnO microspheres for the construction of direct electrochemical biosensors[J].Biosensors and Bioelectronics,2008,24(1):93~98.
[9]Huang X Q,Li Y J,Chen Y,et al.Palladium-Based Nanostructures with Highly Porous Features and Perpendicular Pore Channels as Enhanced Organic Catalysts [J].Angewandet Chemie Internation Edition,2013,52 (9):2 520~2 524.
[10]Dirks R M,Pierce N A.Triggered amplification by hybridization chain reaction[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(43):15 275~15 278.
[11]Chen Y,Xu J,Su J,et al.In situ hybridization chain reaction amplification for universal and highly sensitive electrochemiluminescent detection of DNA[J].Analytical Chemistry,2012,84(18):7 750~7 755.
[12]Chen X,Hong C Y,Lin Y H,et al.Enzyme-free and label-Free ultrasensitive electrochemical detection of human immunodeficiency virus DNA in biological samples based on long-range self-assembled DNA nanostructures [J].Analytical Chemistry,2012,84(19):8 277~8 283.
[13]Wang Y P,Xiao Y H,Ma X L,et al.Label-free and sensitive thrombin sensing on a molecularly grafted aptamer on graphene[J].Chemical Communication, 2012,48:738~740.
A novel electrochemical aptasensor for thrombin detection based on hybridization chain reaction as enhanced signals
Peng De-min,Yuan Ruo*
(School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
Herein,we was prepared successfully a high-sensitivity and unlabeled sandwich-type electrochemical aptasensor for thrombin(TB)detection based on porous Nano-Palladium complexes(pPdNPs)and hybridization chain reaction(HCR).In the course of the experiment,Au nanoparticles electrodeposited(DpAu)had outstanding electrical conductivity to promote the electron transfer at the electrode interface and had good biocompatibility to load large amounts of thrombin binding aptamer(TBAI).Moreover,pPdNPs was employed to load large number of TBAIIand S1.In the present of TB,the TBAII-pPdNPs-S1was designed as the signal probe for the sandwiched aptasnesor.Then S1could trigger the HCR to lead to the formation of extended double-stranded DNA(dsDNA) polymers at the aid of S1and S2.To achieve detection of thrombin,a mass of redox probe,methylene blue(MB),was intercalated into the dsDNA polymers through specific interaction.According to the linearity between TB concentration and current response,we could quantitatively detect target TB.This work provided a promising strategy for the thrombin detection with high sensitivity and simple characteristics.
electrochemical aptasensor;thrombin;nanoparticle;hybridization chain reaction;porous Nano-Palladium complex(pPdNPs)
国家自然科学基金资助项目(21275119,21105081)
*通讯联系人,Tel.:023-68252277,E-mail:yuanruo@swu.edu.cn
