盐酸氟桂利嗪对大鼠皮层扩布性抑制模型血浆CGRP及SP浓度的影响☆
2014-04-27邱恩超于生元李凤鹏刘若卓董钊姜磊石宏景向红
邱恩超 于生元 李凤鹏 刘若卓 董钊 姜磊 石宏 景向红
盐酸氟桂利嗪对大鼠皮层扩布性抑制模型血浆CGRP及SP浓度的影响☆
邱恩超*于生元△李凤鹏※刘若卓△董钊△姜磊△石宏◎景向红◎
目的 建立偏头痛大鼠皮层扩布性抑制(cortical spreading depression,CSD)模型,研究盐酸氟桂利嗪干预后对CSD及血浆降钙素基因相关肽(calcitonin-gene related peptide,CGRP)、P物质(substance P,SP)浓度的影响。方法大鼠随机分为对照组、CSD组、氟桂利嗪干预组,利用氯化钾溶液刺激法建立CSD模型,采用放射免疫技术测定大鼠血浆中的CGRP、SP浓度。结果对照组未记录到CSD波;氟桂利嗪干预组与CSD组比较,CSD波的潜伏期延长[氟桂利嗪干预组(167.90±25.18s)vs.CSD组(130.90±13.30s)](P<0.01),个数减少[氟桂利嗪干预组(4.50±1.84)vs.CSD组(8.50±2.07)](P<0.01),波幅降低[氟桂利嗪干预组(11.40±4.12mv)vs.CSD组(24.40±3.57 mv)](P<0.01);关于血浆CGRP浓度和SP浓度,CSD组(CGRP,32.95±11.61 pg/mL;SP,27.80±7.51 pg/mL)及氟桂利嗪干预组(CGRP,25.13±5.67 pg/mL;SP,19.45±6.10 pg/mL)均高于对照组(CGRP,14.44±6.39 pg/mL;SP,12.36± 4.22 pg/mL)(P<0.01),氟桂利嗪干预组(CGRP,25.13±5.67 pg/mL;SP,19.45±6.10 pg/mL)低于CSD组(CGRP,32.95± 11.61 pg/mL;SP,27.80±7.51 pg/mL)(P<0.05)。结论盐酸氟桂利嗪能够抑制CSD的发生,使大鼠CSD模型的血浆CGRP、SP浓度降低。
偏头痛 皮层扩布性抑制 降钙素基因相关肽 P物质 盐酸氟桂利嗪
近来,皮层扩布性抑制学说(cortical spreading depression,CSD)及神经源性炎症学说成为偏头痛发生机制研究的热点[1]。多项研究说明CSD可能是偏头痛,至少是有先兆偏头痛的病理生理基础[2-3]。许多研究表明降钙素基因相关肽(calcitonin-gene related peptide,CGRP)、P物质(substance P,SP)作为三叉神经血管反射系统的标志性神经肽,参与了神经源性炎症的发生,进而导致偏头痛发生[4-5]。然而CSD与神经源性炎症之间关系尚不明确,相关研究较少。临床试验显示盐酸氟桂利嗪能够有效预防偏头痛发作[6-7],李凤鹏等[8]发现盐酸氟桂利嗪能够有效抑制CSD,但是,其机制尚不完全清楚。因此,本研究建立大鼠偏头痛CSD模型,给予盐酸氟桂利嗪干预,通过放射免疫技术对血浆CGRP和SP进行检测,了解CSD对血浆CGRP和SP的影响及盐酸氟桂利嗪抑制CSD后对血浆CGRP、SP的影响,进而了解CSD与神经源性炎症之间的关系及盐酸氟桂利嗪抑制CSD后可能通过何种机制来有效预防偏头痛的发生。
1 材料与方法
1.1 研究对象健康雄性Sprague-Dawley(SD)大鼠30只,体重200~300 g,由中国医学科学院提供,随机分为对照组、CSD组、氟桂利嗪干预组各10只。试剂:2%滂胺天蓝醋酸钠溶液、3mol/L氯化钾溶液(北京化学试剂公司);1mg/mL盐酸氟桂利嗪生理盐水悬浊液(西安杨森制药有限公司);7.5%EDTA、抑肽酶、CGRP放免试剂盒、SP放免试剂盒(解放军总医院东亚放免研究所)。设备:脑立体定位仪、微电极放大器(日本光电工业株式会社);PowerLab计算机数据采集系统(澳大利亚爱德公司);放免检测仪器(上海核所日环光电仪器有限公司)。
1.2 大鼠CSD模型制备大鼠经20%乌拉坦(1.2~1.5 g/kg)腹腔注射麻醉后固定于手术台上,暴露颅骨,于颅骨前囟前3mm、右侧旁开2mm处(A)及前囟后6mm,右侧旁开5mm处(B),进行钻孔(不损伤硬脑膜),分别为记录CSD和给予氯化钾溶液(或生理盐水)刺激的位置[8]。氟桂利嗪干预组在氯化钾溶液刺激前5min尾静脉注射氟桂利嗪生理盐水混悬液(1mg/Kg)[9]。将大鼠移至立体定位仪并固定,玻璃微电极(尖端直径1μm)冲灌2%滂胺天蓝醋酸钠溶液,插入A孔皮层表面下1mm。开启CSD记录系统,稳定后将浸有3 mol/L氯化钾溶液或生理盐水(<5μL/次)、直径为2mm的滤纸片置于B孔,每10min更换1次,共6次,记录CSD波[8]。
1.3 CSD的分析利用Chart软件(www.ADInstruments.com)测定CSD波潜伏期、个数及波幅。
1.4 标本的采集及血浆CGRP、SP浓度测定于大鼠右侧颈外静脉抽取2.5mL血放入离心管中,迅速加入EDTA 37.5μL,抑肽酶50μL,混匀后放置4℃离心机离心(3000转/min,15 min),按CGRP、SP放免试剂盒说明书进行操作。
1.5 统计学方法CSD波潜伏期、个数及波幅用均数±标准差()表示,采用t检验;血浆CGRP(pg/mL)、SP的浓度(pg/mL)用均数±标准差(x± s)表示,采用方差分析。SPSS 13.0软件进行统计学处理。检验水准ɑ=0.05。
2 结果
2.1 电生理结果对照组未记录到CSD波(图1-A)。对于CSD组,每次氯化钾溶液刺激枕叶皮层后3min左右可以引出0~3个CSD波,CSD波形主要为负向波,波幅10~30mv,持续1min左右(图1-B)。氟桂利嗪干预组CSD波形与CSD组相似(图1-C)。氟桂利嗪干预组与CSD组比较,第一个CSD波潜伏期延长,CSD波个数减少,CSD波的波幅降低(P<0.01,差异有统计学意义,见表1)。
2.2 血浆CGRP浓度(pg/m L)比较对照组、CSD组、氟桂利嗪干预组的血浆CGRP平均浓度分别为14.44±6.39(pg/mL)、32.95±11.61(pg/mL)、25.13±5.67(pg/mL),3组之间有统计学差异(P<0.01),两两比较结果皆有统计学差异(P<0.05;P<0.01)(见图2)。
2.3 血浆SP浓度(pg/m L)比较对照组、CSD组、氟桂利嗪干预组的血浆SP平均浓度分别为12.36±4.22(pg/mL)、27.80±7.51(pg/mL)、19.45± 6.10(pg/mL),3组之间有统计学差异(P<0.01),两两比较结果皆有统计学差异(P<0.05,P<0.01)(见图3)。
3 讨论
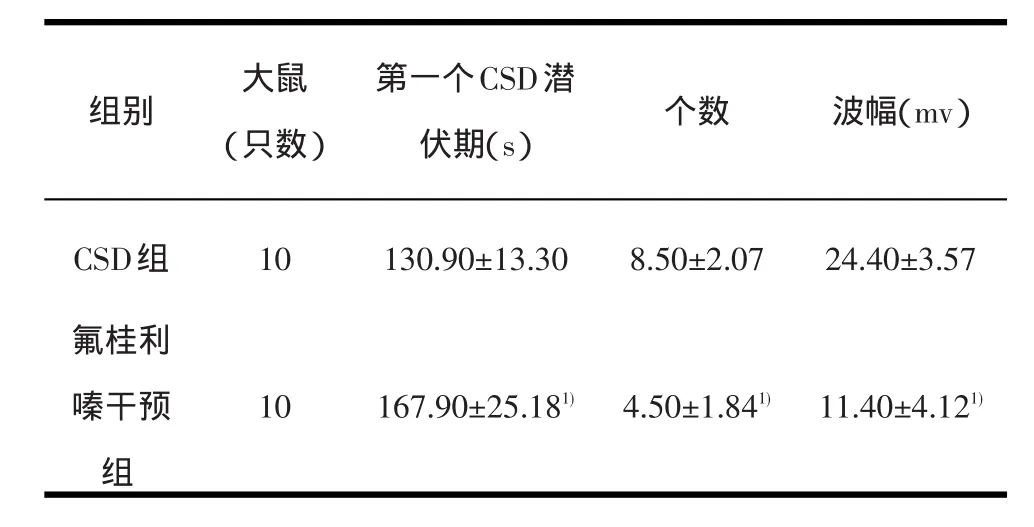
表1 CSD组和氟桂利嗪干预组CSD波潜伏期、个数及波幅比较

图1 各组大鼠的电生理图A,对照组;B,CSD组;C,氟桂利嗪干预组(注:CSD,皮层扩布性抑制)

图2 各组血浆CGRP浓度比较(P<0.01;*氟桂利嗪干预组与CSD组比较P<0.05;**CSD组与对照组比较,氟桂利嗪干预组与对照组比较P<0.01)(注:CGRP,降钙素基因相关肽;CSD,皮层扩布性抑制)
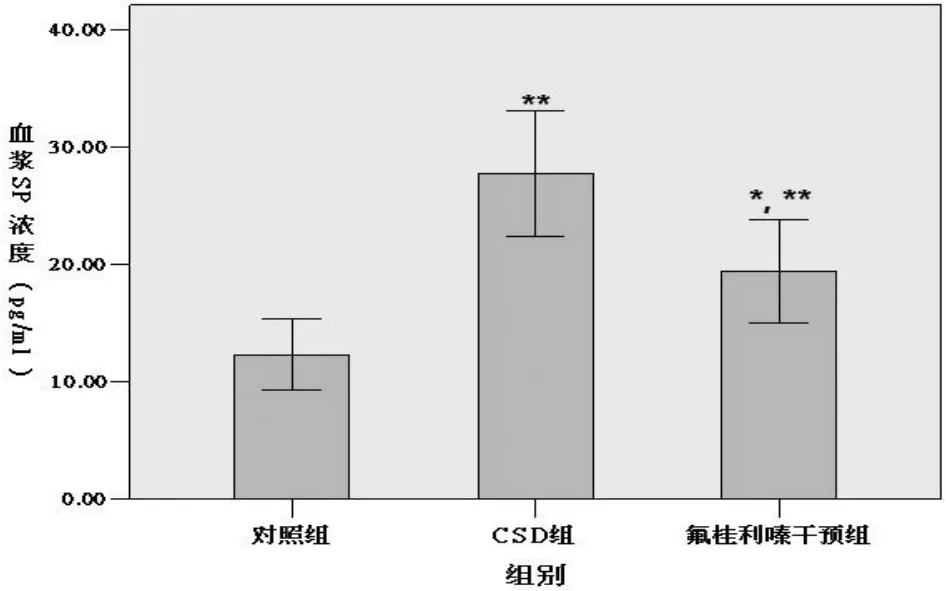
图3 各组血浆SP浓度比较(P<0.01;*氟桂利嗪干预组与CSD组比较P<0.05;**CSD组与对照组比较,氟桂利嗪干预组与对照组比较P<0.01)(注:SP,P物质;CSD,皮层扩布性抑制)
偏头痛是一种常见的原发性头痛,中国偏头痛患病率9.3%,38%的患者因中到重度头痛需要治疗[10],64.2%的患者因发作频率≥1次/月需要预防性治疗[11],罗国刚等研究发现头痛程度重是偏头痛并发焦虑/抑郁的主要危险因素之一,疼痛程度较重、发作频率较高、伴发焦虑/抑郁对患者造成很大的致残性[12]。因此,偏头痛发生机制的研究备受国内外学者关注。CSD学说近来成为研究的热点,即大脑皮层受刺激后出现由刺激部位向周围组织波浪式扩布的皮层电活动的抑制,兴奋与抑制的扩布过程可以解释偏头痛先兆先是刺激性继之抑制性神经系统症状的特征及其扩散的性质,说明CSD可能是偏头痛,至少是有先兆偏头痛的病理生理基础[2]。偏头痛患者视觉先兆及猫CSD模型的功能磁共振成像(fMRI)研究均提示枕叶皮层fMRI信号强度起初增加,继之下降,并缓慢持续向前部皮层扩布,速率与CSD波一致,说明CSD与偏头痛先兆的发生有关[3,13]。本研究采用滤纸片浸润氯化钾溶液刺激枕叶皮层法,在额叶记录到CSD波,与李凤鹏等[8]利用微量注射器注射氯化钾刺激大鼠枕叶皮层记录到CSD波一致,而生理盐水刺激组未记录到CSD波,说明本实验成功建立了偏头痛的大鼠CSD模型。
盐酸氟桂利嗪多年来用于临床中偏头痛的预防性治疗[6,7],且与普萘洛尔联用能有效并安全治疗药物过量性头痛[14]。李凤鹏等[8]建立偏头痛大鼠CSD模型,在氯化钾刺激枕叶皮层前30min给予腹腔注射盐酸氟桂利嗪,发现CSD波受到抑制。Shimazawa等[9]研究发现盐酸氟桂利嗪能够抑制CSD引起的血流量下降。本研究采用氯化钾刺激大鼠枕叶皮层前5min尾静脉给予注射盐酸氟桂利嗪,结果发现CSD波潜伏期延长,个数减少,波幅下降,说明盐酸氟桂利嗪预防偏头痛发作的机制可能是抑制了CSD的发生。另外,CSD的发生是基于K+和H+从细胞中释放出来,而Na+、Ca2+和Cl-与水分子一起进入细胞内,引起细胞肿胀,细胞外间隙相对减小[15-16],而盐酸氟桂利嗪是一种钙离子阻滞剂,分析盐酸氟桂利嗪可能通过作用于离子通道而抑制CSD的产生。
偏头痛动物模型研究发现三叉神经节激活后释放CGRP、SP等神经肽,进而介导脑膜内的神经源性炎症,导致血管扩张、血浆蛋白渗出、肥大细胞脱颗粒,且CGRP、SP的浓度与上述表现的程度一致[5],此为偏头痛发生机制的神经源性炎症学说。关于偏头痛CSD与神经源性炎症之间关系的研究较少,二者关系尚不清楚。本研究发现CSD组大鼠血浆CGRP、SP浓度较对照组增高,说明CSD可能通过一定机制激活了三叉神经血管反射系统导致三叉神经节释放CGRP、SP,参与并维持头痛的发生;氟桂利嗪干预组大鼠的CSD发生受抑制后,相应的血浆CGRP、SP浓度下降,说明三叉神经血管反射的激活减弱,反向推测进一步说明CSD可能通过激活三叉神经血管反射来导致偏头痛的发作。另外,盐酸氟桂利嗪通过抑制CSD的发生降低了大鼠血浆CGRP、SP的浓度,也进一步说明盐酸氟桂利嗪可能通过抑制CSD的发生来有效预防偏头痛的发作。
[1] De Simone R,Ranieri A,Montella S,et al.Cortical spreading depression and central pain networks in trigeminal nucleimodulation:time for an integrated migraine pathogenesis perspective [J].Neurol Sci,2013,34(S1):S51-55.
[2] Leão AAP,Morrison RS.Propagation of spreading cortical depression[J].JNeurophysiol,1945,8(1):33-45.
[3] Hadjikhani N,Sanchez del Rio M,Wu O,et al.Mechanisms of migraine aura revealed by fMRI in human visual cortex[J].Proc Natl Acad SciUSA,2001,98(8):4687-4692.
[4] 朱晓凤,韩月臣,熊文萍,等.热凝脑膜中动脉对硝酸甘油致偏头痛大鼠血CGRP和SP含量的影响[J].临床耳鼻咽喉头颈外科杂志,2011,25(10):460-462,468.
[5] Theoharides TC,Donelan J,Kandere-Grzybowska K,et al.The role of mast cells in migraine pathophysiology[J].Brain Res Rev,2005,49(1):65-76.
[6] Reveiz-Herault L,Cardona AF,Ospina EG,et al.Effectiveness of flunarizine in the prophylaxis ofmigraine:a meta-analytical review of the literature[J].Rev Neurol,2003,36(10):907-912.
[7] 于生元,董钊,李焰生,等.盐酸氟桂利嗪预防性治疗偏头痛疗效性和安全性[J].中国疼痛医学杂志,2007,13(4): 199-201.
[8] Li F,Qiu E,Dong Z,et al.Protection of flunarizine on cerebral mitochondria injury inducedby cortical spreading depression under hypoxic conditions[J].JHeadache Pain,2011,12(1):47-53.
[9] Shimazawa M,Hara H,Watano T,et al.Effects of Ca2+channelblockers on cortical hypoperfusion and expression of c-Fos-like immunoreactivity after cortical spreading depression in rats[J]. Br JPharmacol,1995,115(8):1359-1368.
[10] Yu S,Liu R,Zhao G,etal.The prevalence and burden of primary headaches in China:a population-based door-to-door survey [J].Headache,2012,52(4):582-591.
[11] Liu R,Yu S,He M,et al.Health-care utilization for primary headache disorders in China:a population-based door-to-door survey[J].JHeadache Pain,2013,14(1):47-54.
[12] 罗国刚,马玉青,苟静,等.偏头痛患者伴发焦虑/抑郁及功能残疾的临床研究[J].中国神经精神疾病杂志,2012,38 (8):477-481.
[13] James MF,Smith MI,Bockhorst KHJ,et al.Cortical spreading depression in the gyrencephalic feline brain studied bymagnetic resonance imaging[J].JPhysiol,1999,519(2):415-425.
[14] 赵红如,张群英,蔡秀英,等.不同药物联合治疗药物过度使用性头痛的疗效及安全性[J].中国神经精神疾病杂志,2012,38(4):229-233.
[15] Kraig RP,Nicholson C.Extracellular ionic variations during spreading depression[J].Neuroscience,1978,3(11):1045-1059.
[16] Dreier J.The role of spreading depression,spreading depolarization and spreading ischemia in neurological disease[J].Nat Med,2011,17(4):439-447.
The effects of flunarizine hydrochloride on plasma calcitonin gene-related peptide and substance Plevels after cortical spreading depression in rats.
QIU Enchao,YU Shengyuan,LI Fengpeng,LIU Ruozhuo,DONG Zhao,JIANG Lei,SHI Hong,JING Xianghong.
Department of Neurology,The First Affiliated Hospital,Chinese PLA General Hospital,51 Fucheng Road,Haidian District,Beijing 100048,China.Tel:010-66848043.
ObjectiveTo explore the effects of flunarizine hydrochloride on plasma calcitonin gene-related peptide and substance Plevels after CSD in a ratmigrainemodel of cortical spreading depression(CSD).MethodsThirty adult ratswere randomly and evenly divided into three groups:controlGroup,CSD group and flunarizine group.The CSD waveswere evoked by application of potassium chloride on brain surface with filter paper.Funarizine hydrochloride was intravenously administered to rats fiveminutes prior to application of potassium chloride.The plasma levels of CGRP and SP weremeasured by using radioimmunity assay.Statistical analyseswere performed using two-sample t test and analysis of variance.ResultsCSD waveswere absent in control group whereas CSD waveswere induced in CSD and flunarizine groups.The latency of the first CSD wave was longer in flunarizine group(167.90±25.18 s)than in CSD group(130.90±13.30 s)(P<0.01).The number of CSD waves was smaller in flunarizine group(4.50±1.84)than in CSD group (8.50±2.07)(P<0.01).The amplitude of CSD waves was lower in flunarizine group(11.40±4.12 mv)than in CSD group (24.40±3.57mv)(P<0.01).The levels of CGRP and SP in both CSD group(CGRP,32.95±11.61 pg/mL;SP,27.80±7.51 pg/mL)and flunarizine group(CGRP,25.13±5.67 pg/mL;SP,19.45±6.10 pg/mL)were higher than in control group (CGRP,14.44±6.39 pg/mL;SP,12.36±4.22 pg/mL)(P<0.01).The levels of CGRP and SP in flunarizine group(CGRP, 25.13±5.67 pg/m L;SP,19.45±6.10 pg/mL)were lower than those in CSD group(CGRP,32.95±11.61 pg/mL;SP,27.80± 7.51 pg/mL)(P<0.05).ConclusionsFlunarizine hydrochloride can inhibit CSD and reduce the plama levelsof CGRPand SP in the rat modelofCSD.
Migraine Cortical spreading depression Calcitonin gene-related peptide Substance P Flunarizine hydrochloride
R747.2
A
2013-10-06)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.04.005
☆国家自然科学基金项目(编号:81171058)
*解放军总医院第一附属医院神经内科(北京 100048)
△解放军总医院神经内科
※沈阳军区总医院神经内科
◎中国中医科学院针灸研究所
