青藤碱对偏头痛模型大鼠蛛网膜下腔炎性细胞的影响☆
2014-04-27罗国标刘晓丽杨丽
罗国标 刘晓丽 杨丽
青藤碱对偏头痛模型大鼠蛛网膜下腔炎性细胞的影响☆
罗国标*※刘晓丽△杨丽*
目的 观察青藤碱(sinomenine,Sin)对偏头痛模型大鼠蛛网膜下腔小血管周围炎性细胞数的影响,探讨Sin治疗偏头痛的抗炎作用。方法健康wistar大鼠随机分为空白对照组、模型组、Sin低、中、高剂量干预组,每组10只。皮下注射硝酸甘油复制实验性偏头痛动物模型,药物干预4 h后断头取脑干及其脑膜。HE染色,显微镜下观察蛛网膜下腔小血管周围炎性细胞数的变化,计数蛛网膜下腔小血管周围单位面积(以视野为单位)炎性细胞数。结果模型组大鼠蛛网膜下腔小血管周围炎性细胞(以淋巴细胞、单核细胞为主)明显增多,与空白组相比较,差异有显著性统计学意义[(28.10±2.28)vs.(1.60±1.07),P<0.01];Sin高、中、低剂量组蛛网膜下腔小血管周围炎性细胞明显减少,与模型组相比较,差异有显著性统计学意义[Sin高剂量组(2.60±1.43)、Sin中剂量组(5.10±1.37)、Sin低剂量组(9.10±0.88)vs.(28.10±2.28),P<0.01]。结论Sin可显著减少硝酸甘油诱导的偏头痛模型大鼠蛛网膜下腔小血管周围炎性细胞数,抑制偏头痛的无菌性神经源性炎症反应,提示Sin有治疗偏头痛的作用。
偏头痛 青藤碱 蛛网膜下腔 炎性细胞
偏头痛的病理生理机制尚未完全明了,目前有多种发病机制,其中神经血管学说认为三叉神经血管系统激活后可诱发无菌性神经源性炎症(aseptic neurogenic inflammation,ANI),而诱发偏头痛[1]。研究发现偏头痛患者脑脊液细胞因子的变化,为偏头痛的神经血管学说提供了依据[2]。Sin是从中药青风藤Sinomenium acutum Rehd.etWils中提取的单体生物碱,具有明显抗炎、抗免疫、镇痛、镇静、镇咳等药理作用,目前已广泛用于治疗类风湿性关节炎等。Sin能否抑制偏头痛的ANI反应,尚未见报道。本实验皮下注射硝酸甘油(Nitroglycerin,NTG)复制实验性偏头痛模型,予以Sin干预,观察Sin对偏头痛模型大鼠蛛网膜下腔小血管周围炎性细胞数的影响,了解Sin是否可以减轻偏头痛的ANI反应,为Sin治疗偏头痛提供依据。
1 材料与方法
1.1 实验动物清洁级wistar大鼠60只(由重庆第三军医大学大坪医院医学实验动物中心提供,许可证号:SCXK(渝)2007-0005),雌雄各半,体重(320±60)g,适应性喂养后,随机分为空白对照组、偏头痛模型组、Sin高、中、低剂量组,共6组,每组10只。
1.2 偏头痛模型制作采用皮下注射硝酸甘油制作大鼠偏头痛模型。健康wistar大鼠,皮下注射硝酸甘油(北京益民药业有限公司,5mg/mL,批号:20100531)10 mg/kg,制作实验性偏头痛模型。以注药造模30min后大鼠出现双耳发红,前肢频繁搔头,摆头,爬笼次数增多等烦躁不安的症状为模型复制成功的标准。本实验注药6~10min后大鼠均出现上述症状。若不给予药物治疗,上述现象持续约1~3 h不等。空白对照组不任何处理。
1.3 给药方法正清风痛宁缓释片(湖南正清制药集团股份有限公司,每片含盐酸青藤碱60mg,批号:0903127)用生理盐水配成药液置于4℃冰箱备用,Sin治疗组按Sin高、中、低剂量灌胃,药量分别为200 mg/kg、150 mg/kg和100 mg/kg。上述药物都用生理盐水稀释到同等的量灌胃,模型组给以等量生理盐水灌胃。模型组、Sin治疗组于注射硝酸甘油30min后按组灌胃给药。
1.4 取材及标本处理造模灌胃4 h后将大鼠用10%水合氯醛(0.35mL/100 g)腹腔注射法进行全身麻醉后,仰卧固定,开胸从左心室至主动脉插管,剪开右心耳,首先迅速灌注无菌生理盐水200mL,然后灌注4℃4%多聚甲醛磷酸盐缓冲液200mL,灌注后断头,取出整个完整脑组织,4℃4%多聚甲醛磷酸盐缓冲液浸泡后,去除硬脑膜保留蛛网膜及软脑膜,并分离脑干,在4%PFA磷酸盐缓冲液中固定24 h,然后放入20%蔗糖-PBS液中,至组织块下沉。标本均经10%甲醛固定,石蜡包埋,制成4μm切片,常规HE染色。
1.5 图像分析奥林巴斯显微镜下:观察每张切片蛛网膜下腔小血管周围炎性细胞的变化,计数蛛网膜下腔小血管周围40倍视野单位面积(以视野为单位)炎性细胞总数。全部标本的HE染色切片均由两名有经验的病理科老师观察复核。
1.6 统计学方法检测结果以均数±标准差()表示,使用SPSS13.0统计软件进行数据分析,两样本均数的比较用t检验,组间比较如满足方差齐性用one-wayANOVA分析的LSD法,不满足方差齐性用DunnettT3法分析。检验水准ɑ=0.05。
2 结果
2.1 一般状态观察除空白对照组外,其余动物造模后6~10min左右,均出现双耳发红,前肢频繁搔头、摆头,爬笼次数增多,烦躁不安现象。治疗组大鼠在给药后,上述现象逐渐消失,趋于正常。模型组动物上述现象持续约1~3 h,继而出现蜷卧,活动减少状态。判定标准:模型制作后通过耳红、挠头、爬笼、烦躁不安等行为症状评价判定模型制作是否成功。成功的标准为模型动物精神不振,眼睛眯成线状,体温明显下降,蜷缩少动,肛门处有粪便堆积,体重逐日下降。此造模操作简单、稳定可靠、表面效度高且短时间内可大量复制,是目前抗偏头痛药物新药研究的首选动物模型[3]。
2.2 青藤碱对偏头痛模型大鼠蛛网膜下腔小血管周炎性细胞数的影响以观察蛛网膜下腔小血管周围单位面积(以视野为单位)炎性细胞(以淋巴细胞、单核细胞为主)数的变化(见表1,图1、图2)。
从表1可得出,模型组大鼠蛛网膜下腔小血管周围炎性细胞数(以淋巴细胞、单核细胞为主)明显增多,与空白组相比较,差异有显著性统计学意义(P<0.01);Sin各剂量组蛛网膜下腔小血管周围炎性细胞数明显减少,与模型组相比较,差异有显著统计学意义(P<0.01);Sin高剂量组蛛网膜下腔小血管周围炎性细胞数与空白组无差异(P>0.05),提示其剂量抑制偏头痛的ANI反应效果最佳。
3 讨论
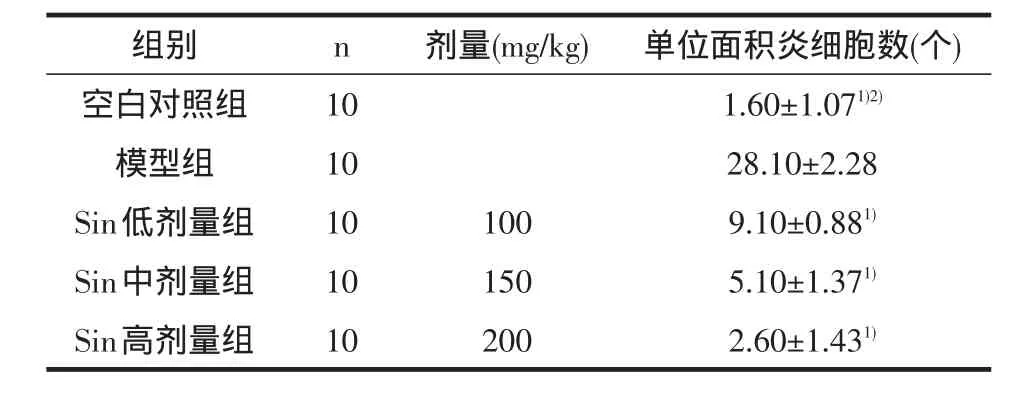
表1 各组大鼠蛛网下腔炎细胞数比较
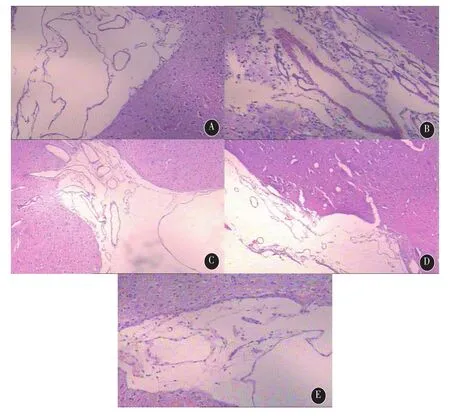
图1 各组动物脑干蛛网膜下腔HE染色图像。A、B、C、D、E分别显示:空白组、模型组、Sin低剂量组、Sin中剂量组、Sin高剂量组(×400)

图2 青藤碱对大鼠蛛网膜下腔炎性细胞的影响
偏头痛是一种反复发作的原发性头痛,是临床常见病、多发病。但其发病机制目前尚未完全明了。偏头痛的血管学认为偏头痛与ANI有关。偏头痛的神经血管学说认为:三叉神经血管系统的激活可以诱发ANI。ANI表现为血管扩张、血浆蛋白渗出、血管壁肿胀及肥大细胞脱颗粒。一般认为ANI可以致痛[1]。在硬脑膜,ANI是由三叉神经血管周围纤维释放各种血管活性神经肽引起的,血管活性神经肽的释放引起血管扩张,血浆蛋白渗出和促炎症因子的释放,如缓激肽、前列腺素和质子[4]。NTG是一种脂溶性化合物,易透过血脑屏障,是NO的供体,NTG及其衍生物NO可增加硬膜细胞因子和iNOS的表达,产生ANI,而诱发偏头痛。且NO具神经毒性作用,可激发三叉神经-血管反射,引起脑血管扩张,产生偏头痛。最近的研究结果表明炎性分子可能与偏头痛的发病机制有关,NO被认为起到关键性作用的炎性分子[5]。注射NTG可引起大鼠硬脑膜迟发性炎症反应,并调节促炎性细胞因子IL-1β和IL-6产生[6]。炎性细胞因子能激活中性粒细胞和淋巴细胞,而引起脑膜中中性粒细胞和淋巴细胞增多。研究证据表明:在ANI中细胞因子被认为是疼痛介质,它们可能引起偏头痛的疼痛[7]。我们的观察结果与何秋[8]等观察的结果是一致的:空白对照组的大鼠蛛网膜下腔血管周无明显炎性反应,模型组的大鼠蛛网膜下腔血管周有大量淋巴细胞、单核细胞等炎性细胞浸润及血管扩张。Ucevler[9]等及梅海云[[10]等的研究也提示:单核/巨噬细胞与偏头痛的神经源性疼痛有关,表明淋巴细胞及单核细胞等促炎性细胞因子确实存在于偏头痛的神经源性疼痛机制过程中。
Sin是从中药青风藤中提取的单体生物碱,具有明显抗炎、抗免疫、镇痛、镇静、镇咳等药理作用。有研究认为Sin抑制巨噬细胞的炎性物质前列腺素F(PGF)和白三烯合成,降低细胞中NO合成是其抗炎机制[11]。梁瑞燕等[12]通过体外实验研究表明:Sin对IL-1β基因表达有较强的抑制作用,并认为Sin可能是通过抑制炎症性细胞因子的产生而发挥其抗炎作用。研究表明,Sin通过抑制前列腺素的合成和COX-2的活性而达到抑制急、慢性炎症反应的作用;研究证实,Sin可通过抑制炎性细胞因子如IL-1β、IL-2、IL-8、TNF-α等的表达及合成而产生抗炎作用;Sin还能有效抑制巨噬细胞释放IL-1及TNF-α,从而有效抑制了新一轮炎症的启动[13];Sin具有镇痛作用,其镇痛作用弱于吗啡,作用部位在中枢[11]。综上所述,Sin具有抑制炎性细胞因子的释放,从而抑制偏头痛的ANI反应。本实验研究发现,NTG可引起模型组大鼠蛛网膜下腔血管周炎性细胞明显增多,Sin各剂量干预组上述反应明显减轻,Sin高剂量组与空白组比较无差异。因此我们推测:Sin具有减轻偏头痛的ANI反应,从而达到治疗偏头痛的作用,可能是其治疗偏头痛的作用机制之一。
[1] 匡培根.偏头痛[J].中国疼痛医学杂志,2002,8(2):111-115.
[2] 李琴,周冀英.偏头痛患者脑脊液中相关生物标志物的研究现状[J].中国神经精神疾病杂志2010,36(3):189-191.
[3] Olesen J,Jansen-Olesen I.Towards a reliable animalmodel of migraine[J].Cephalalgia,2012,32(7):578-580.
[4] Markowitz S,Saito K,Moskowitz MA.Neurogenically mediated leakage of plasma protein occurs from blood vessels in duramater butnotbrain[J].JNeurosci,1987,7(12):4129-4136.
[5] LongoniM,Ferrarese C.Inflammation and excitotoxicity:role in migraine pathogenesis[J].Neurol Sci2006,27:S107-S110.
[6] Reuter U,Bolay H,Jansen-Olesen I,et al.Delayed inflammation in ratmeninges:implications formigraine pathophysiology [J].Brain,2001,124:2490-2502.
[7] Empl M,Sostak P,Riedel M,et al.Decreased sTNF-RI in migraine patients?[J].Cephalalgia,2003,23:55-58.
[8] 何秋,王怀良,章新华,等.5-HT1受体激动剂对偏头痛大鼠脑膜神经源炎症的影响[J].中风与神经疾病杂志,2007,24 (5):520-524.
[9] Ucevler N,Roqausch JP,Toyka KV,et al.Differental expression of cytokines in painful and painless neuropathies[J].Neurology,2007,69(1):42-49.
[10] 梅海云,杨晓苏.核因子-κB抑制剂对偏头痛患者血清培养正常人单核细胞株表达的血清促炎细胞因子的影响[J].国际神经病学神经外科学杂志,2010,37(3):215-217.
[11] 李乐,张彩玲,宋必卫.青藤碱的药理研究与临床应用[J].中药新药与临床药理,2006,17(4):310-313.
[12] 梁瑞燕,曹柳英,王文君,等.青藤碱抗炎作用机理研究[J].广州中医药大学学报,2007,24(2):141-143.
[13] 李藴麟,粟戟,尹小军,等.青藤碱替代激素治疗类风湿性关节炎疗效分析[J].兰州大学学报(医学版),2013,39(3):18-21.
Effects of sinomenine on inflammatory cells of subarachnoid in a rat model of migraine.
LUO Guobiao,LIU Xiaoli,Yang Li.
Department of Neurology,The Affiliated Hospital of Zunyi Medicine College,Zunyi 563099,China.Tel: 0855-8218920.
ObjectiveTo examine the effects of sinomenine(Sin)on inflammatory cell numbers of subarachnoid small perivascular and explore the role of anti-inflammatory of Sin in the treatment of migraine in a rat model of migraine.MethodsHealthy wistar ratswere random ly divided into 6 groups:normalgroup,modelgroup and Sin low dose group,Sin middle dose group and Sin high dose group.The ratmigrainemodelwas established by subcutaneously administration of nitroglycerin.The brain andmater of ratswere decapitated follo wing 4 h of medical intervention.HE stainingwas used to stain inflammatory cells and inflammatory cells within perivascular spaceswere counted under lightmicroscope.ResultsCompared to normal group,the inflammatory cells(mainly lymphocyte andmonocyte) within perivascular spaceswere increased significantly in model group[(28.10±2.28)vs.(1.60±1.07),P<0.01)];The inflammatory cells in all three Sin groupswere significantly reduced compared withmodel group[Sin high dose group(2.60±1.43)、Sinmiddle dose group (5.10±1.37)、Sin low dose group(9.10±0.88)vs.(28.10±2.28),P<0.01].ConclusionsSin can significantly reduce inflammatory cells within perivascular spaces in the ratmodel of migraine,suggesting thatSin can effectively treatmigraine.
Migraine Sinomenine Subarachnoid Inflammatory cells
R651.1
A
2013-10-09)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.04.002
☆贵州省省长基金项目(黔省专合字(2008)112号)
*贵州省遵义医学院附属医院神经内科(遵义 563099)
※现在为贵州省黔东南州人民医院神经内科
△贵州省遵义医学院附属医院病理科
