丙酮酸盐对阿尔茨海默病大鼠学习记忆的影响☆
2014-04-27王晓楠胡雪君杨旸王斯琪
王晓楠胡雪君杨旸王斯琪
丙酮酸盐对阿尔茨海默病大鼠学习记忆的影响☆
王晓楠*胡雪君*杨旸*王斯琪*
目的研究丙酮酸盐对阿尔茨海默病(Alzheimer’s disease,AD)模型大鼠学习记忆的影响并探讨其与海马神经细胞死亡的关系。方法将36只wistar大鼠随机分为空白对照组、AD模型组和丙酮酸盐治疗组,根据实验要求给药处理6周,同时观察各组大鼠一般情况,Morris水迷宫实验检测大鼠学习记忆能力,苏木精-伊红(hematoxylin and eosin,HE)染色检测海马神经细胞死亡,利用 2′,7′-dichlorodihydrofluorescein diacetate (H2DCF-DA)来检测海马CA1区内活性氧(reactive oxygen species,ROS)聚集情况。结果丙酮酸盐治疗组与AD模型组比较,一般情况均明显改善,逃避潜伏期均明显缩短(41.37±6.24,31.67±7.26,24.26±7.16,20.45±5.72, 19.36±5.89,均P<0.05);原平台象限活动时间明显增加(50.36±7.46 s,P<0.05),穿越原平台次数明显增多(3.98± 1.23次/2 min,P<0.05),海马CA1区锥体神经细胞死亡显著减少(P<0.05),海马神经细胞内ROS的水平也显著降低(P<0.05)。结论丙酮酸盐可能通过降低海马组织内ROS的产生,减少海马神经细胞死亡,从而提高AD模型大鼠的学习记忆水平。
丙酮酸盐 阿尔茨海默病 学习记忆
阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,以进行性记忆减退和认知功能障碍为主要临床症状,但AD的病因和发病机制复杂,目前AD的确切病因尚不清楚,许多病理过程参与其中,神经细胞外β-淀粉样蛋白(β-amy⁃loid,Aβ)沉积是AD的主要神经病理学特征之一[1]。可溶性Aβ寡聚体是导致神经元功能紊乱并最终导致AD记忆损伤的上游因素,其神经毒性的作用机制尚不明确,研究表明主要与Ca2+紊乱和氧化应激(活性氧ROS的产生)等密切相关[2-3]。丙酮酸盐可作为细胞保护剂,改善严重低血糖所致的神经细胞死亡和认知功能障碍[4-5],保护神经细胞拮抗β-淀粉样蛋白所致的神经细胞死亡[6]。为此,我们观测丙酮酸盐对AD大鼠模型认知功能和海马神经细胞的影响,旨在为AD的防治提供新的思路及有益的实验数据。
1 材料与方法
1.1 实验动物雄性Wistar大鼠,体重200~250 g,清洁级,由中国医科大学实验动物中心提供,适应性饲养1周后,经Morris水迷宫测试36只反应正常的大鼠,随机分为对照组(control)、AD模型组(AD)、和丙酮酸盐治疗组(AD+Py),每组l2只。
1.2 AD模型大鼠及用药方法除对照组外,将实验动物以3.6%水合氯醛腹腔注射(1 mL/100 g体重),麻醉后固定于脑立体定向仪上,按脑立体定位仪图谱,于AP-3.0 mm,ML±2.0 mm,DV4.0 mm,即为海马定位点,以微量注射器自脑表面垂直进针,在5 min内将1 μL Aβ1-42寡聚体(4 μg/μL)缓慢注入,留针5 min,缓慢退针,牙托粉填补针孔。所有操作均在无菌下进行,皮肤切开处用青霉素抗菌,缝合伤口。将大鼠放回笼中,单笼饲养至大鼠完全清醒,自由活动进食[7]。对照组在相同立体定位条件下,注射等体积PBS。术后1 d大鼠完全清醒,能自由活动进食后,丙酮酸盐治疗组给予干预治疗,每天腹膜注射丙酮酸钠500 mg/kg,对照组及AD模型组腹膜注射等渗NaCL注射液(104.5 mg/ kg),连续注射6周。在术后1周进行Morris水迷宫实验,以对照组大鼠逃避潜伏期均值的95%上限值为标准,将超出上限值者确定为痴呆大鼠[8]。
1.3 Morris水迷宫实验药物干预6周后,将每只大鼠头颈部毛发用普通染发剂涂黑,进行定位航行;测试时实验室温度在24~25℃,水迷宫中加入奶粉1 kg,用热水冲开,再用水加至高过安全平台1cm,水温保持现在22℃,左右。末次给药1 d后,采用Morris水迷宫定位航行和空间探索实验测定大鼠间学习记忆能力。其中定位航行试验历时5 d,每天4次,每次间隔20 min。第五天进行空间探索实验(即除去安全平台观察大鼠2分钟内在平台象限的游泳路程与总路程之比)。每次均3组平行进行。
1.4 海马神经细胞死亡的测定各组实验大鼠在最后一次进行Morris水迷宫测试后,各组分别取6只大鼠,常规灌注取材,制作石蜡切片,根据大鼠脑立位定位图谱选海马区附近连续切片12张,片厚4 μm,切片用PBS液漂洗2次,每次5 min,加入经苏木精染色15~30 min,用水冲洗3 h,然后加入伊红染色5 min,用乙醇分色。常规脱水、透明、封片,光镜下观察海马神经细胞形态变化。
1.5 海马神经细胞内活性氧(reactive oxygen spe⁃cies,ROS)聚集的测定各组实验大鼠在最后一次进行Morris水迷宫测试后,各组分别取6只大鼠,取出完整海马组织,利用2′,7′-dichlorodihy⁃drofluorescein diacetate (H2DCF-DA, Invitrogen, USA)来检测海马CA1区内ROS聚集情况[6]。
1.6 统计学方法采用SPSS17.0进行统计学处理,计量资料以表示,组间差异显著性检验采用单因素方差分析,组间两两比较采用Scheffe法,检验水准α=0.05。
2 结果
2.1 一般情况两周内各组无明显差异,但之后AD模型组大鼠逐渐出现行动和反应迟缓,饮食减少,体质量下降,并进行性加重;而丙酮酸盐治疗组上述情况均有改善。
2.2 Morris水迷宫检测如表1及表2所示,各组大鼠平均逃避潜伏期均日渐缩短,AD模型组与对照组比较逃避潜伏期明显延长(P<0.05),原平台象限活动时间明显减少(P<0.05),穿越原平台次数明显减少(P<0.05)。丙酮酸盐治疗组与AD模型组比较:逃避潜伏期均明显缩短(P<0.05),原平台象限活动时间明显增加(P<0.05),穿越原平台次数明显增多(P<0.05)。
表1 各组大鼠定向航行实验中每日平均逃避潜伏期(,s)

表1 各组大鼠定向航行实验中每日平均逃避潜伏期(,s)
1)与对照组比较P<0.05;2)与AD组比较P<0.05
2.3 苏木精-伊红染色如图1所示,对照组大鼠海马CA1区锥体神经元形态正常;AD模型组大鼠CA1区锥体神经元排列紊乱,神经元肿胀或皱缩,染色质聚集,白质区组织疏松,有胶质细胞增生现象;丙酮酸盐治疗组大鼠海马CA1区锥体神经元形态正常。
2.4 海马神经细胞内ROS的聚集情况如图2所示,与对照组相比较AD模型组大鼠海马神经细胞内ROS的水平明显增高(P<0.05),而丙酮酸盐治疗组大鼠海马神经细胞内ROS的水平未见明显变化(P>0.05)。与AD模型组相比较,丙酮酸盐治疗组大鼠海马神经细胞内ROS的水平明显降低(P<0.05)。
3 讨论
AD是一种神经退行性疾病,以进行性记忆减退和认知功能障碍为主要临床症状,但AD的病因和发病机制复杂,目前AD的确切病因尚不清楚,许多病理过程参与其中,神经细胞外β-淀粉样蛋白(Aβ)沉积是AD的主要神经病理学特征之一[1]。AD的发病机制研究,近十年的主导假说是Aβ毒性学说,尤其是可溶性Aβ寡聚体的神经毒性作用日益被重视[9-11]。可溶性Aβ寡聚体的神经毒性远强于其他不可溶性类淀粉样蛋白,AD病情严重程度和突触缺失程度与Aβ总量相关,但非线性关系,而与可溶性Aβ寡聚体呈线性相关。本研究利用Aβ1-42寡聚体海马内注射制作AD大鼠模型。Aβ寡聚体是导致神经元功能紊乱并最终导致AD记忆损伤的上游因素,其神经毒性的作用机制尚不明确,研究表明主要与Ca2+紊乱和氧化应激(活性氧ROS的产生)等密切相关[3,12]。随着对Aβ寡聚体在AD形成和发展中的认识和研究的不断深入,靶向Aβ寡聚体的治疗策略将成为AD治疗中的重要途径之一,有望很快进入临床应用。与以往治疗策略不同,Aβ寡聚体靶向治疗不仅改善AD早期症状,而且可能减缓或减轻症状的恶化程度。
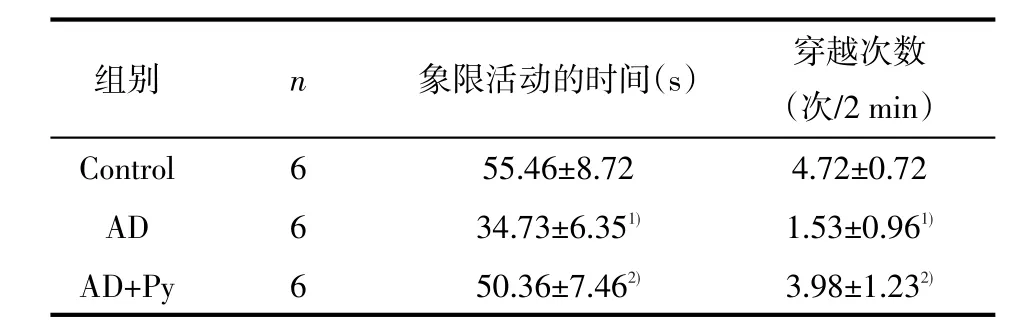
表2 各组大鼠空间探索试验中原平台象限活动时间和穿越原平台次数
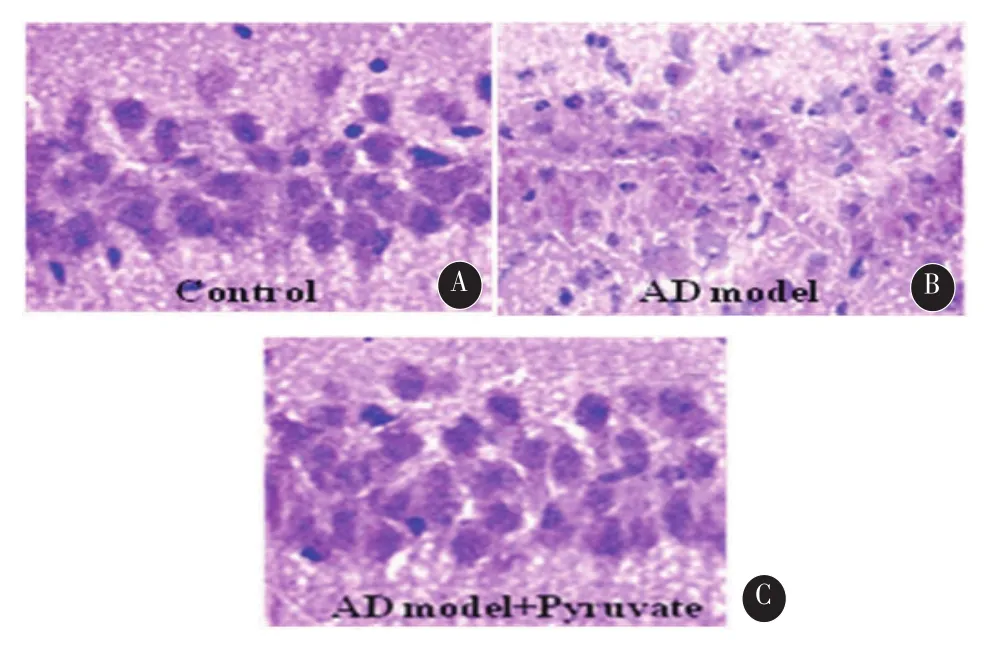
图1 各组大鼠海马组织CA1区的HE染色(400×)
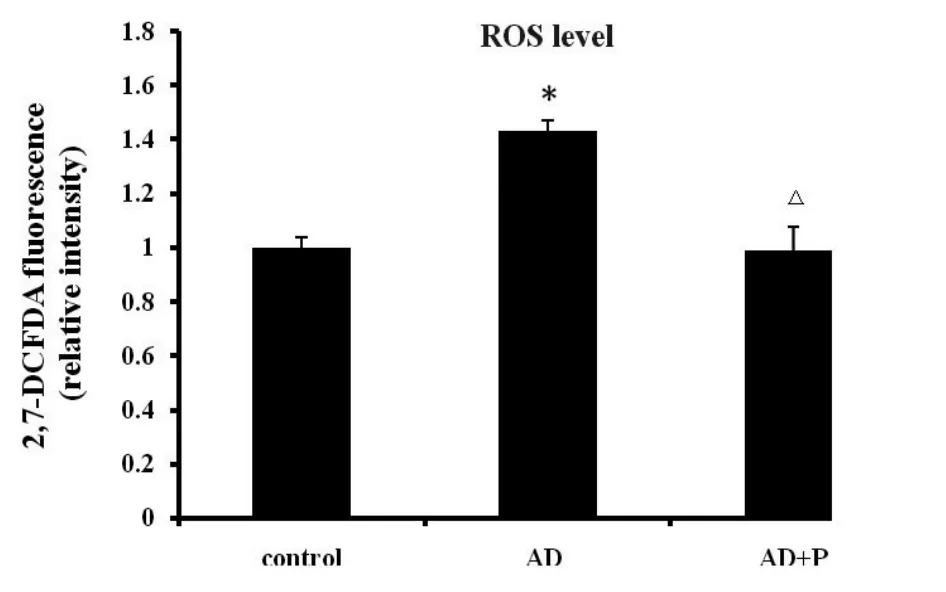
图2 各组大鼠海马神经细胞内ROS的聚集情况 *与对照组比较P<0.05;△与AD组比较P<0.05
外源性的丙酮酸盐(pyruvate)在体内转化为丙酮酸根阴离子和(或)丙酮酸起作用。丙酮酸是体内糖酵解的中间产物,位于无氧酵解和有氧氧化代谢交接处,属α-酮酸,是三大营养物质代谢的枢纽,其分子量小,可通过血脑屏障,经单羧酸转运体自由进出细胞和线粒体,为丙酮酸盐在体内作用提供保障。丙酮酸盐不仅可作为三羧酸循环的底物产生腺苷三磷酸(ATP)为组织正常生理结构功能的维持提供能量,还可作为细胞保护剂,保护神经细胞拮抗谷氨酸盐所致的神经毒性作用[13]并抑制鼠体内氧自由基的氧化作用[14]。丙酮酸盐主要通过两种机制起到抗氧化作用:其一,可直接通过非酶促的去碳酸基反应抑制过氧化氢;其二,补充丙酮酸盐,可增强柠檬酸循环,柠檬酸产生增多后,抑制磷酸果糖激酶,从而进入磷酸戊糖旁路,产生还原型辅酶II(NADPH),从而间接地增加谷胱甘肽(GSH)抗氧化能力。丙酮酸盐还可增加辅酶I/还原型辅酶I(NAD+/NADH)的比值,促进三羧酸循环反应。
本研究发现AD模型组逃避潜伏期明显延长,原平台象限活动时间和穿越原平台次数明显减少,且大鼠海马组织内ROS的产生及CA1区锥体细胞的死亡显著升高。同时发现丙酮酸盐预处理实验组一般情况较AD模型组明显改善,逃避潜伏期明显缩短,原平台象限活动时间和穿越原平台次数明显增加,大鼠海马组织内ROS的产生及CA1区锥体细胞的死亡显著减少,说明丙酮酸盐有效地改善了AD模型大鼠的学习记忆水平。由此我们推测丙酮酸盐一方面可能通过逆转Aβ寡聚体介导的Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)自动磷酸化水平的抑制来阻止Aβ寡聚体诱导的长时程增强(LTP)抑制,从而改善学习和记忆的损害;另一方面可能通过维持细胞内ATP水平及NAD+水平来拮抗Aβ寡聚体诱导的海马神经细胞死亡,从而延缓AD进展;丙酮酸盐的抗氧化作用可能是丙酮酸盐神经保护作用的上游机制,但这一假说有待进一步研究证实。
[1]Selkoe DJ.The molecular pathology of Alzheimer′s disease[J].Neuron,1991,6(4):487-498.
[2]Nimmrich V,Grimm C,Draguhn A,et al.Amyloid beta oligo⁃mers(A beta1-42globulomer)suppress spontaneous synaptic ac⁃tivity by inhibition of P/Q-type calcium currents[J].J Neurosci, 2008,28(4):788-797.
[3]Florent S,Malaplate-Armand C,Youssef I,et al.Docosahexae⁃noic acid prevents neuronal apoptosis induced by soluble amy⁃loid-beta oligomers[J].J Neurochem,2006,96(2):385-395.
[4]Suh SW,Aoyama K,Matsumori Y,et al.Pyruvate administered after severe hypoglycemia reduces neuronal death and cognitive impairment[J].Diabetes,2005,54(5):1452-1458.
[5]Wang XN,Song XZ,Takata T,et al.Amyloid-β neurotoxicity restricts glucose window for neuronal survival in rat hippocam⁃pal slice cultures[J].Expe Gerontol,2010,45(11):904-908.
[6]Wang X,Takata T,Bai X,et al.Pyruvate prevents the inhibi⁃tion of the long-term potentiation induced by amyloid-β through protein phosphatase 2A inactivation[J].J Alzheimers Dis,2012,30(3):665-673.
[7]Hu S,Begum AN,Jones MR,et al.GSK3 inhibitors show bene⁃fits in an Alzheimer's disease(AD)model of neurodegeneration but adverse effects in control animals[J].Neurobiol Dis,2009, 33(2):193-206.
[8]黄涛波,吕诚,胡小令,等.雷公藤内酯醇对AD模型大鼠海马神经细胞凋亡的影响[J].中国老年学杂志,2010,30(19):2766-2770.
[9]Kayed R,Head E,Thompson JL.Common structure of soluble amyliod oligomers implies common mechanism of pathogenesis [J].Science,2003,300(5618):486-489.
[10]Rönicke R,Mikhaylova M,Rönick S,et al.Early neuronal dys⁃function by amyloid β oligomers depends on activation of NR2B-containing NMDA receptors[J].Neurobiol Aging,2011, 32(12):2219-2228.
[11]黄书才,谌红献.ω-3多不饱和脂肪酸对认知功能影响的研究进展[J].中国神经精神疾病杂志,2013,39(2):111-114.
[12]段冉冉,李燕飞,贾延劼.与阿尔茨海默病发病机制相关的microRNA的研究进展[J].中国神经精神疾病杂志,2013,39(9):569-573.
[13]Miao Y,Qiu Y,Lin Y,et al.Protection by pyruvate against glu⁃tamate neurotoxicity is mediated by astrocyes through a glutathi⁃one-dependent mechanism[J].Mol Biol Rep,2011,38(5): 3235-3242.
[14]Varma SD,Heyde K,Henein M,et al.Oxidative damage to mouse lens in culture[J].Protective effect of pyruvate.Biochem Biophy Acta,2003,1621(3):154-155.
Effects of pyruvate on learning and memory in a rat model of Alzheimer’s disease.
WANG Xiaonan,HU Xue⁃jun,YANG Yang,WANG Siqi.
Departments of Respiratory and Infectious disease,the First affiliated Hospital of China Med⁃ical University,Shengyang,110001,China.Tel:024-83283770.
ObjectiveTo study the effects of pyruvate on learning,memory and neuronal cell death of the hippo⁃campus in a rat model of Alzheimer’s disease(AD).MethodsA total of 36 rats were randomly divided into control group,AD model group,and pyruvate group.General condition was observed after 6-week dipsacus treatment.Morris water maze was used to determine 1earning and memory in animals.Hematoxylin and eosin(H-E)staining was used to quantify neuronal death in the hippocampus.The reactive oxygen species(ROS)was assessed by using 2′,7′-dichlorodi⁃hydrofluorescein diacetate(H2DCF-DA).ResultsCompared with AD model group,pyruvate group showed improved gen⁃eral condition,shortened escape latency(41.37±6.24,31.67±7.26,24.26±7.16,20.45±5.72,19.36±5.89,respectively P<0.05),increased activity time on the former platform quadrant(50.36±7.46 s,P<0.05),increased number of crossing the former platform(3.98±1.23 time/2 min,P<0.05),reduced ROS levels and decreased neuronal cell death in CA1 of the hippocampus decreased(respectively,P<0.05).Conclusions Pyruvate can improve the learning and memory and de⁃crease the neuronal cell death through preventing the ROS production in AD rats.
Pyruvate Alzheimer’s disease Learning and memory
2
A
2013-08-02)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2014.02.006
☆ 国家自然科学基金资助项目(编号:81200246),高等学校博士学科点专项科研基金(编号:20122104120004),辽宁省自然科学基金项目(编号:2013010025-401)
* 中国医科大学附属第一医院呼吸感染科(沈阳110001)
