人工牛黄抗口腔纤维化效应及机制初探
2014-04-24朱丹霞代剑平万倩英陈小璇王革非李康生
朱丹霞 代剑平* 万倩英 陈小璇 王革非 李康生
(汕头大学医学院微生物与免疫学教研室,广东 汕头 515031)
人工牛黄抗口腔纤维化效应及机制初探
朱丹霞 代剑平* 万倩英 陈小璇 王革非 李康生
(汕头大学医学院微生物与免疫学教研室,广东 汕头 515031)
目的研究人工牛黄抗槟榔诱导的口腔纤维化的效应及药理机制。方法培养小鼠口腔黏膜成纤维细胞、氯胺T法、明胶酶谱分析、qRT-PCR、ELISA和Western blotting等。结果人工牛黄可抑制槟榔提取物(Areca nut extract,ANE)诱导的口腔黏膜成纤维细胞的异常增殖及胶原累积。药理研究显示,人工牛黄可显著拮抗ANE诱导的MMP2活性下降和胶原基因的表达上调,抑制ANE诱导的TIMP-1和TIMP-2基因表达,及CTGF、TGFβ1、IL-6和TNFα的转录及释放,抑制ANE诱导的AKT、ERK/JNK MAPK和NF-κB信号通路的活化及氧化应激。结论人工牛黄具有良好的抗纤维化作用,是一种很有应用前景的抗口腔黏膜纤维化药物。
牛黄;槟榔;口腔黏膜纤维化;抗纤维化
长期嚼食槟榔可诱发口腔黏膜纤维化(OSF),其病理特征是口腔黏膜下胞外基质异常积累,并伴炎性细胞浸润和上皮萎缩[1]。槟榔提取物(Areca nut extract,ANE)可诱导TGFβ、IL-6和前列腺素E2分泌,上调COX-2和波形蛋白表达,激活PI3K/Akt、PKCα、ERK/ JNK/p38 MAPK和NF-κB信号通路,与OSF的发生和进一步癌变密切相关[2,3]。天然牛黄(Calculus bovis)由牛科牛(Bubalus bubalis L.)干燥胆结石加工而来,现临床常用人工牛黄。牛黄能抑制血管平滑肌细胞增殖[4],其主要成分牛磺酸能抑制肝、胰、肾、肺和心纤维化,并具抗肿瘤活性[5,6]。牛黄胆红素可抑制肾和肺纤维化[7,8]。为预防和治疗槟榔诱导的OSF,我们研发了一种咀嚼片,牛黄是其主要成分之一[9]。我们前期研究发现牛黄可抑制正常培养的成纤维细胞增殖和胶原合成,抑制金属蛋白酶抑制剂(TIMP)-1产生[10],本研究进一步揭示人工牛黄抗ANE诱导OSF的效应及机制。
1 材料与方法
1.1 材料
人工牛黄(Calculus bovis,CB)购自镇江存仁堂有限责任公司,批号095072。槟榔购自毫州中药材市场(批号096108,安徽),经江苏大学韩帮兴博士鉴定并于本实验室保存。槟榔提取物(ANE)参照中国药典(2005版)。高效液相色谱(LC200,JASCO,日本)测定人工牛黄含胆红素0.67%,槟榔提取物含槟榔碱0.31%。
1.2 细胞培养和MTT实验
Balb/c小鼠[(20±2)g,雌雄各半]正常饲养1周,颈椎脱臼处死,无菌取口腔黏膜,成纤维细胞培养方法参照之前报道[10]。实验方案经汕头大学医学院实验动物中心审批。牛黄(CB)和ANE对小鼠口腔黏膜成纤维细胞生长的影响用MTT法测定[10]。CB系列浓度(0、12.5、25、50、100、200 μg/mL)和ANE系列浓度(6.25、12.5、25、50、100、200、400 μg/mL)用10% FCS DMEM培养液配制,DMSO≤0.5%。药物处理48 h,空白对照为10% FCS DMEM培养液(DMSO=0.5%)。
1.3 羟脯氨酸测定
小鼠口腔黏膜成纤维细胞(1×105/孔)接种24孔板,24 h,再加含ANE(1.25、2.5、5、10、20 μg/mL)10% FCS DMEM培养液,同时加或不加12.5 μg/mL CB,48 h;收集上清,氯胺T法测羟脯氨酸含量[10]。胶原蛋白量用μg/106个细胞表示,假定胶原蛋白含13.5%羟脯氨酸。
1.4 明胶酶谱分析
细胞处理同羟脯氨酸测定,收集上清,用于明胶酶谱分析和ELISA测定;收集细胞用于qRT-PCR和Western blotting分析。MMP-2/-9活性用Bandscan软件进行灰度扫描并用面积乘平均灰度值表示[10]。
1.5 实时定量PCR(qRT-PCR)
细胞处理同羟脯氨酸测定,Trizol提取总RNA,核酸酶DNase I处理,反转录并做实时定量PCR。试剂盒购自Invitrogen并按说明书进行。引物设计用Primer Express 3.0软件(表1)。结果表示为2-ΔΔCt。
1.6 酶联免疫吸附反应(ELISA)
细胞处理同羟脯氨酸测定,ELISA试剂盒(北京达科为生物技术有限公司)测定上清液CTGF、TGFβ1、IL-6、TNF-α和IL-1水平。细胞因子水平用pg/mL表示。
1.7 抗氧化测定
细胞处理同羟脯氨酸测定,还原型谷胱甘肽 (GSH),丙二醛(MDA),一氧化氮(NO),羟自由基(OH),总超氧化物歧化酶(T-SOD),谷胱甘肽还原酶(GR),过氧化氢酶(CAT)以及谷胱甘肽过氧化物酶(GSH-Px)水平的测定均用相关试剂盒(南京建成生物工程研究所)测定。
1.8 蛋白质印迹(Western blotting)
细胞处理同羟脯氨酸测定,抗Akt、p-Akt、ERK、p-ERK、JNK、p-JNK、p38、p-p38、和NF-κB p65抗体以及辣根过氧化物酶标记的抗兔或抗山羊二抗均购自CST公司(美国)。检测NF-κB p65时,提取细胞核蛋白。蛋白质浓度测定用BCA蛋白测定试剂盒(碧云天,中国),20 μg蛋白质上样用于SDS-PAGE电泳[11]。
1.9 数据分析
数据用SPSS13.0单因素方差分析(ANOVA)进行统计,表示为平均值±标准差。
2 结 果
2.1 CB拮抗ANE诱导的口腔黏膜成纤维细胞异常增长
如图1A示,CB可剂量依赖性地抑制成纤维细胞增长,在≤12.5 μg/mL时无明显细胞毒性。如图1B示,在低浓度(6.25~12.5 μg/mL)下,ANE可显著促进成纤维细胞增长,而在高浓度(50~400 μg/mL)下,ANE又能显著抑制细胞增长。CB(12.5 μg/mL)能有效拮抗ANE效应。
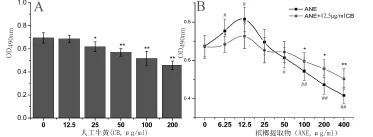
图1 牛黄(CB)拮抗ANE诱导的口腔黏膜成纤维细胞异常增长。(A)MTT法测定CB的细胞毒性。(B)CB拮抗ANE诱导的口腔黏膜成纤维细胞异常增长。n=5, *P<0.05和**P<0.01与相同ANE浓度的仅ANE处理的对照组相比。
2.2 CB拮抗ANE诱导的MMP2活性下降,胶原蛋白及TIMP1-/-2表达上调和胶原累积
ANE可显著抑制人口腔黏膜成纤维细胞MMP-2分泌,提高TIMP-1表达,诱导胞外胶原异常沉积[12]。本研究显示(图2A),ANE在2.5~20 μg/mL范围内可显著促进胶原累积,CB(12.5 μg/mL)能有效抑制ANE诱导的胶原蛋白积累。明胶酶谱分析显示(图2B、C和D),ANE能显著抑制MMP-2和MMP-9的活性,CB(12.5 μg/mL)能显著提高ANE(12.5 μg/mL)抑制的MMP-2活性。qRT-PCR结果显示(图2E),ANE(12.5 μg/mL)可显著促进口腔黏膜成纤维细胞Col1A1、Col3A1、TIMP1和TIMP-2表达。CB可显著抑制ANE刺激的Col1A1、Col3A1、TIMP1和TIMP-2表达。
2.3 CB对ANE诱导的细胞因子转录和释放的影响
CTGF、TGFβ1、IL-6、IL-1和TNF-α对OSF的发生有重要作用[13]。本研究qRT-PCR和ELISA检测显示(图3),ANE能显著促进CTGF、TGFβ1、IL-6和TNFα的转录和释放,CB能显著抑制ANE诱导的这些细胞因子转录和释放,但对IL-1无显著作用。
2.4 CB抑制ANE诱导的AKT、ERK/JNK MAPK 和 NF-κB信号通路的激活
ANE可激活PI3K/AKT、ERK/JNK/p38 MAPK 和 NF-κB信号通路[2,3]。本研究显示(图4),ANE能显著提高p-Akt、p-ERK、p-JNK、p-p38及细胞核NF-κB p65水平,CB可显著抑制PI3K/AKT、 ERK/JNK MAPK 和 NF-κB通路的激活,而对p38 MAPK通路无显著影响。
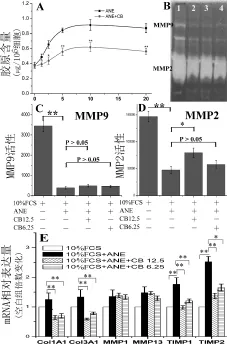
图2 CB拮抗ANE诱导的MMP2活性下降,胶原蛋白及TIMP1-/-2表达上调和胶原累积。(A)氯胺T法测定CB对ANE诱导胶原蛋白积累的影响。n=5,*P<0.05和**P<0.01与相同ANE浓度的仅ANE处理的对照组相比。(B、C和D)明胶酶谱试验,泳道1(空白):10% FCS;泳道2(模型组):10% FCS + ANE(12.5μg/mL);泳道3:10% FCS + ANE(12.5 μg/mL)+ CB(12.5 μg/mL);泳道4:10% FCS+ANE(12.5 μg/mL)+CB(6.25 μg/mL)。(E)qRT-PCR测定结果。
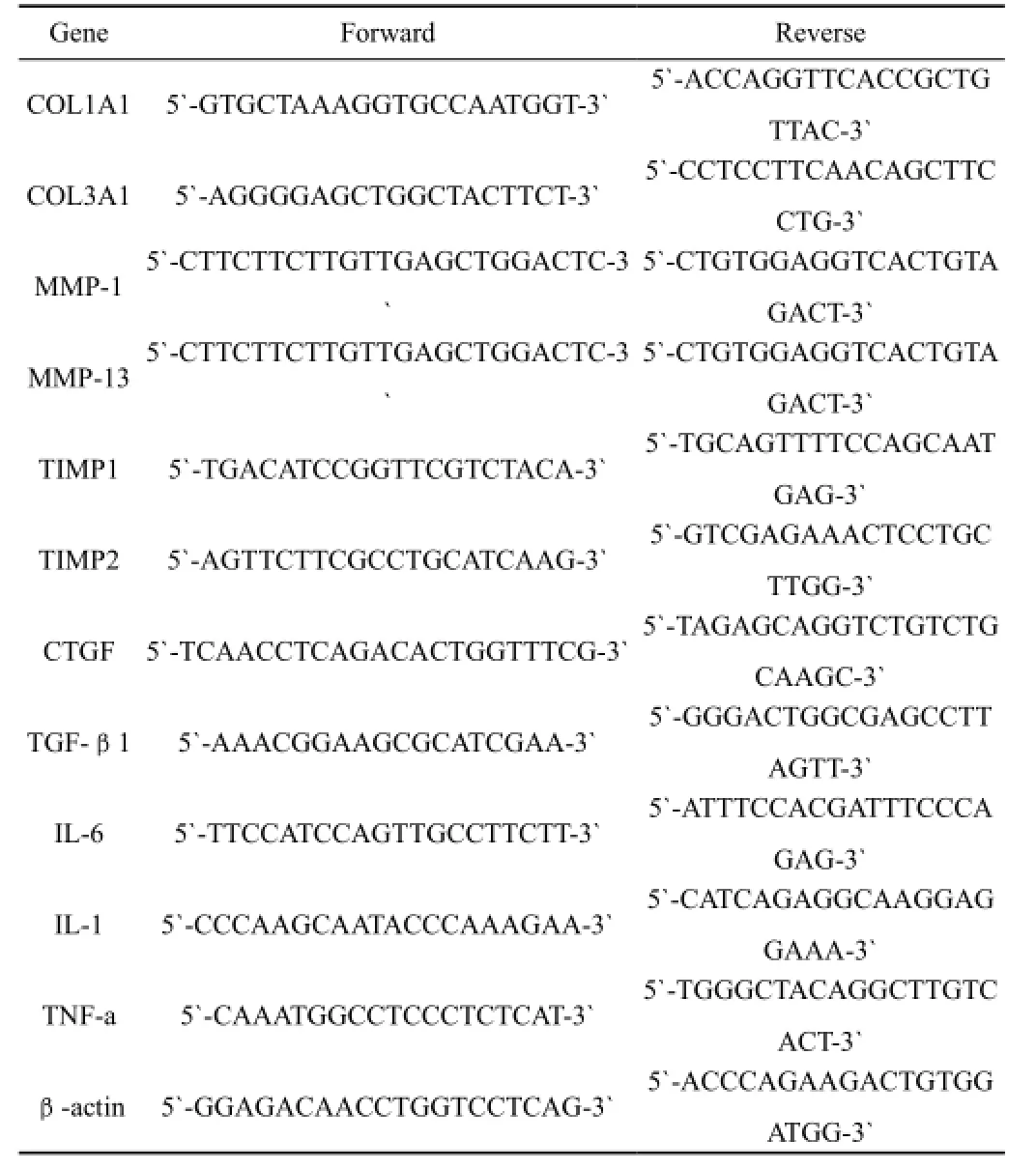
表1 qRT-PCR试验所用引物序列
2.5 CB抑制ANE诱导的氧化应激
ANE能促进活性氧(ROS)产生,降低谷胱甘肽(GSH)水平,并在OSF发生中扮演重要角色[9,10]。本研究显示(表2),ANE可显著降低GSH水平,促进NO 和HO·产生,抑制GR、CAT 和 GSH-Px活性。相反,CB能显著拮抗ANE诱导的氧化应激反应。

图3 CB影响ANE诱导的细胞因子转录和释放。(A)qRT-PCR试验结果,(B)ELISA试验结果,n=5,*P<0.05和**P<0.01同10% FCS+ANE(12.5 μg/mL)组相比。
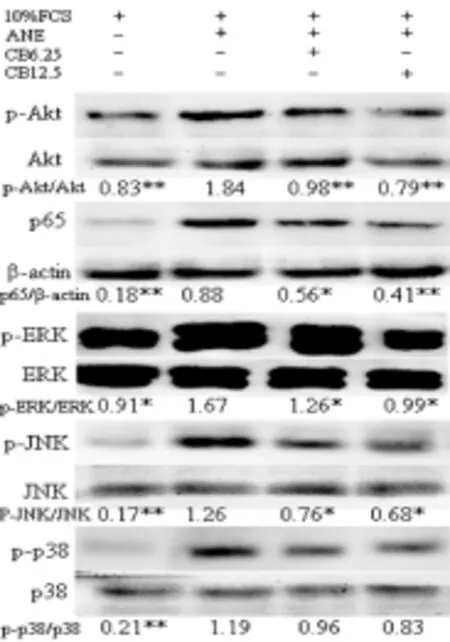
图4 CB对ANE诱导的AKT、ERK/JNK/p38 MAPK 和 NF-κB通路的影响。n=3,*P<0.05和**P<0.01同10% FCS+ANE(12.5 μg/mL)组相比。
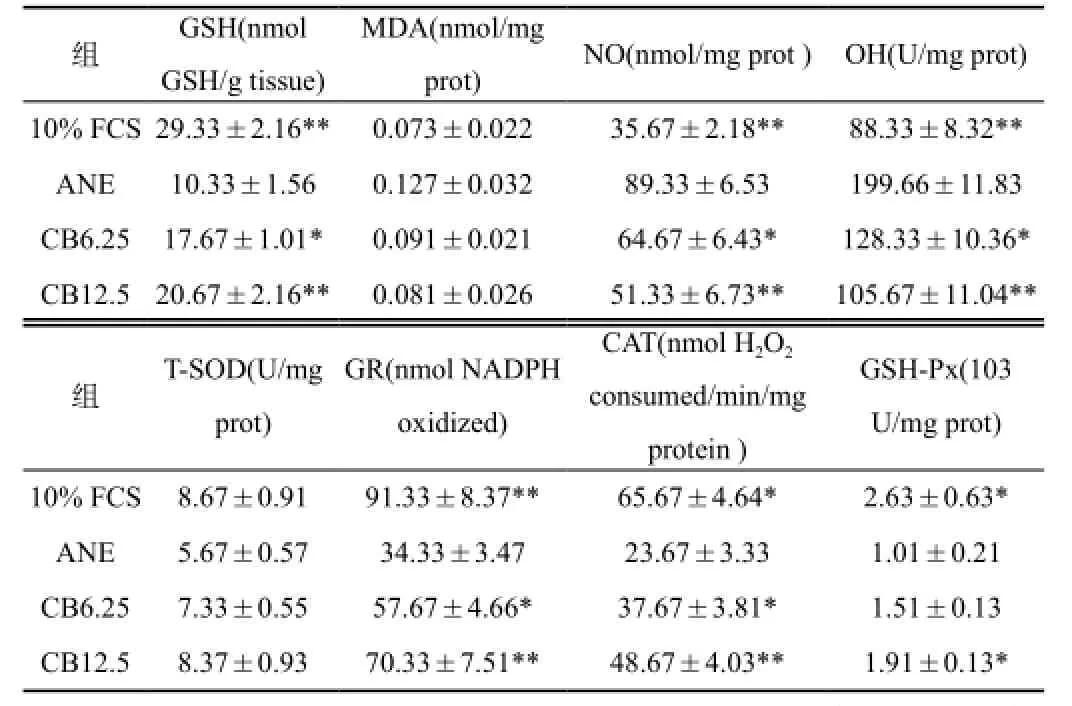
表2 牛黄对ANE诱导的氧化应激的影响
3 讨 论
嚼食槟榔是OSF及口腔鳞状细胞癌发生发展的重要因子。为此,我们研发了一种中药配方以治疗OSF,CB是其主要成分之一。在本研究中,我们发现CB可剂量依赖性地抑制小鼠口腔黏膜成纤维细胞增殖,在药效药理试验中,我们选择低浓度12.5 μg/mL作为牛黄实验浓度,因为这个浓度的CB对口腔黏膜成纤维细胞无明显毒性。此外,低浓度ANE能有效促进成纤维细胞增殖,高浓度ANE表现出强烈的细胞毒性。
MMPs和TIMPs能严密控制胶原积累[13]。人MMPs家族含23个成员,以MMP-2和MMP-9为代表的胶原酶,能降解几乎所有的细胞外基质。TIMPs是MMPs强有力的抑制剂。TIMP家族有四个成员,其中TIMP-1和TIMP-2以自由形式存在,TIMP-1和TIMP-2能以1∶1的比例结合MMPs,抑制MMPs的活性[13]。本研究显示CB能拮抗ANE诱导的MMP-2活性的下降及TIMP-1/-2水平的上调。此外,CB还显著降低CTGF、TGFβ1、IL-6及TNFα等细胞因子的转录与释放,这些皆与OSF的发生密切相关。
现代研究显示,氧化应激可激活PI3K/Akt、MAPK及NF-κB等信号通路,并且这些信号通路的激活可调节MMPs和TIMPs表达,进而调控胶原积累[14]。根据本研究实验结果,我们推测CB可通过抑制ANE诱导的氧化应激,进而抑制PI3K/Akt、ERK/JNK MAPK及NF-κB信号通路,通过调节MMPs和TIMPs表达,最终抑制胞外基质积累和ANE诱导的OSF。总之,本研究证实CB具有良好的抗纤维化作用,是一种很有应用前景的抗OSF药物。
[1] Lin HJ,Lin JC.Treatment of oral submucous fibrosis by collagenase: effects on oral opening and eating function [J].Oral Dis,2007,13(4):407-413.
[2] Shimada K,Azuma Y,Kawase M,et al.Taurine as a marker for the identification of natural Calculus Bovis and its substitutes [J]. Adv Exp Med Biol,2013,776:141-149.
[3] Peng C,Tian J,Lv M,et al.Development and Validation of a Sensitive LC-MS-MS Method for the Simultaneous Determination of Multicomponent Contents in Artificial Calculus Bovis [J].J Chromatogr Sci,2014,52(2):128-136.
[4] Mizuno M,Chung HJ,Maruyama I,et al.Inhibitory effects of bezoar bovis on intimal formation and vascular smooth muscle cell proliferation in rat [J].Am J Chin Med,2005,33(3):439-447.
[5] Das J,Vasan V,Sil PC.Taurine exerts hypoglycemic effect in alloxaninduced diabetic rats,improves insulin-mediated glucose transport signaling pathway in heart and ameliorates cardiac oxidative stress and apoptosis [J].Toxicol Appl Pharmacol,2012,258(2):296-308.
[6] Pilz M,Holinka J,Vavken P,et al.Taurine chloramine induces apoptosis in human osteosarcoma cell lines [J].J Orthop Res,201 2,30(12):2046-2051.
[7] Kasap B,Soylu A,Ertoy Baydar D,et al.Protective effects of bilirubin in an experimental rat model of pyelonephritis [J]. Urology,2012,80(6):1389 e1317-1322.
[8] Wang HD,Yamaya M,Okinaga S,et al.Bilirubin ameliorates bleomycin-induced pulmonary fibrosis in rats [J].Am J Respir Crit Care Med,2002,165(3):406-411.
[9] Dai JP,Chen J,Han BX,et al.Regulation of calculus bovis on the function of mice oral fibroblasts [J].Sheng wu gong cheng xue bao,2009,25(3):448-451.
[10] Dai JP,Chen J,Bei YF,et al.Influence of borneol on primary mice oral fibroblasts: a penetration enhancer may be used in oral submucous fibrosis [J].J Oral Pathol Med,2009,38(3):276-281.
[11] Dai JP,Zhao XF,Zeng J,et al.Drug Screening for Autophagy Inhibitors Based on the Dissociation of Beclin1-Bcl2 Complex Using BiFC Technique and Mechanism of Eugenol on Anti-Influenza A Virus Activity [J].PloS one,2013,8(4):e61026.
[12] Chang YC,Yang SF,Tai KW,et al.Increased tissue inhibitor of metalloproteinase-1 expression and inhibition of gelatinase A activity in buccal mucosal fibroblasts by arecoline as possible mechanisms for oral submucous fibrosis [J].Oral oncol,2002,38(2):195-200.
[13] Tseng YH,Chang CS,Liu TY,et al.Areca nut extract treatment down-regulates involucrin in normal human oral keratinocyte through P13K/AKT activation [J].Oral oncol,2007,43(7):670-679.
[14] Lu KH,Lin CW,Hsieh YS,et al.Selaginella tamariscina (Beauv.) possesses antimetastatic effects on human osteosarcoma cells by decreasing MMP-2 and MMP-9 secretions via p38 and Akt signaling pathways [J].Food Chem Toxicol,2013,59:801-807.
Effect and Mechanism of Calculus Bovis on Areca Nut Extract-induced Oral Submucous Fibrosis in Vitro
ZHU Dan-xia, DAI Jian-ping*, WAN Qian-ying, CHEN Xiao-xuan, WANG Ge-fei, LI Kang-sheng
(Department of Microbiology and Immunology, Shantou University Medical College, Shantou 515041, China)
ObjectiveIn this study, we have investigated the anti-fibrotic activity of calculus bovis on areca nut-induced oral submucous fibrosis (OSF) in vitro.MethodsHydroxyproline assay, gelatin zymography, antioxidant assay, qRT-PCR, ELISA and western blotting were used.ResultsCalculus bovis could inhibit the ANE-induced abnormal growth and collagen accumulation of oral mucosal fibroblasts. Then we studied the underlying mechanism and found that calculus bovis (6.25 and 12.5 μg/mL) could significantly augment the ANE-induced decrease of MMP2 activity, inhibit the ANE-induced expression of Col1A1, Col3A1, TIMP-1 and TIMP-2, the transcription and release of CTGF, TGFβ1, IL-6 and TNFα, the ANE-induced oxidant stress, and the ANE-induced activation of PI3K/AKT, ERK/JNK MAPK and NF-κB signal pathways.ConclusionCalculus bovis possesses excellent anti-fibrotic activity and is a promising drug for OSF.
Calculus bovis; Areca nut; Oral submucous fibrosis; Anti-fibrosis
R739.85
B
1671-8194(2014)16-0001-04
国家自然科学基金资助项目(81374040,31170852,81001322)
*通讯作者:E-mail: daijpedu2008@163.com
