T1期阴茎鳞状细胞癌竞争生存分析
2014-04-22顾伟杰朱耀姚旭东张世林戴波张海梁施国海叶定伟
顾伟杰朱 耀姚旭东张世林戴 波张海梁施国海叶定伟*
1. 复旦大学附属肿瘤医院泌尿外科(上海 200032); 2. 复旦大学上海医学院肿瘤学系
·论 著·
T1期阴茎鳞状细胞癌竞争生存分析
顾伟杰1,2朱 耀1,2姚旭东1,2张世林1,2戴 波1,2张海梁1,2施国海1,2叶定伟1,2*
1. 复旦大学附属肿瘤医院泌尿外科(上海 200032); 2. 复旦大学上海医学院肿瘤学系
目的比较T1G1-3,cN0阴茎鳞状细胞癌(SCCP)患者肿瘤特异性死亡率(CSM)和其他原因导致的死亡率(OCM)。方法 2004年至2009年SEER数据库诊断为SCCP分期为T1G1-3,cN0患者641例。采用Fine和Gray竞争风险模型估计不同肿瘤分级的CSM,使用Gray检验比较各组的CSM,再利用竞争风险回归模型探索影响CSM的因素。结果原发肿瘤切除术(PTE)后5年,发生CSM和OCM分别为12.38%和30.60%。根据肿瘤分级(G1、G2、G3)分为三组,各组术后5年CSM分别为7.34%、15.05%和17.47%,差异有统计学意义(P<0.05);术后5年OCM分别为29.52%、28.45%和37.69%,差异无统计学意义(P>0.05)。肿瘤分级为G3的患者相比于G1的患者有2.45倍风险发生CSM(95%CI 1.09-5.62,P<0.05)。然而未发现G2期患者相比G1期患者发生CSM的风险更高。结论 T1G3和T1G2患者术后5年出现CSM概率较高,适合进行腹股沟淋巴结清扫术(ILND);而T1G1术后5年发生CSM较低,积极随访监测是较好的选择。
阴茎肿瘤; 肿瘤, 鳞状细胞; 竞争风险; SEER规划
阴茎癌是一种少见的男性泌尿生殖系统恶性肿瘤,其中鳞状细胞癌(SCCP)占95%[1]。阴茎鳞状细胞癌易于通过淋巴道转移,有微小转移灶的患者在淋巴结清扫手术后能够实现长期无瘤生存。但由于对淋巴结转移检测的不准确及淋巴结清扫手术的严重并发症,局部淋巴结的积极治疗仍然存在争议。据估计只有39.1%~49%的阴茎癌患者进行了腹股沟淋巴结清扫术(ILND)。这可能导致过低估计肿瘤淋巴结转移风险。本研究对未行ILND阴茎鳞状细胞癌患者(T1G1-3)的肿瘤特异性死亡率(CSM)进行分析,探讨对这类患者是否有必要进行积极的局部淋巴结治疗。
对象与方法
本研究收集了美国SEER数据库2004年至2009年临床分期分级为T1G1、T1G2、T1G3且原发肿瘤切除术(PTE)后诊断为SCCP的患者614例。患者的基线情况如表1所示:中位年龄为68.5(25~102)岁,白种人居多(81.9%)。原发灶分期标准依据2002年UICC的TNM分期系统,入选患者均为T1期;组织学分级则根据Broders系统划分,其中G1、G2、G3的患者分别为 245例、273例和 96例。中位随访时间21.0(0.1~71)月。
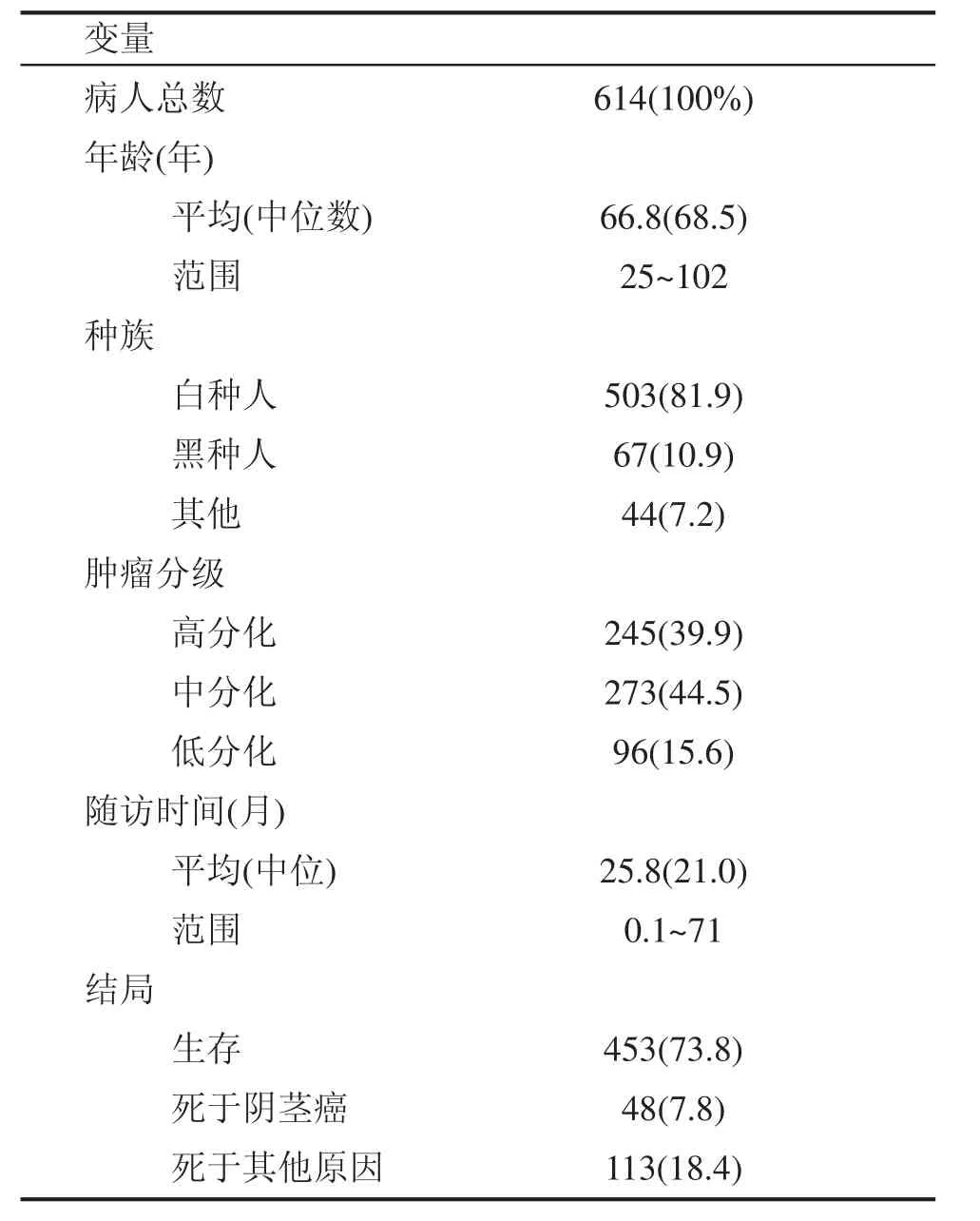
表1 T1G1-3,c?N0阴茎鳞状细胞癌患者基线特征
由于研究对象除了出现我们感兴趣结局肿瘤特异性死亡(CSM)外,也有其他意外结局(OCM),如心脏疾病、脑血管病、阻塞性肺病等。意外结局的出现会导致感兴趣的事件不能发生,即出现了竞争。学界认为,将竞争风险按删失处理,将导致生存函数的错估,故应该使用竞争风险模型[2]。
Fine等[3]提出了一种边际分布的半参数比例风险模型,这个模型主要优点在于:可以直接估计协变量对边际概率模型的影响。它是用部分似然函数和加权技术得到估计值,然后再利用边际风险模型估计出个体的累积风险及其置信区间[4]。主要模型如下:

Fr(t, Z) 表示协变量Z在时间t上r终点事件累积风险,λr0(S)为时间s上r终点事件的基础风险,β是协变量系数向量。
本研究主要分析阴茎鳞状细胞癌患者的CSM,死于其他原因为竞争事件,未发生死亡事件标记为截尾数据。采用Fine和Gray竞争风险模型估计不同肿瘤分级的CSM,使用Gray检验比较各组的CSM,再利用竞争风险回归模型探索影响CSM的因素[3]。所有统计分析均用R3.0.0软件实现[5]。
结 果
本组患者48例死于阴茎癌,113例患者发生了竞争事件,453例为截尾数据。原发肿瘤切除术(PTE)后5年,发生CSM和OCM分为别12.38%和30.60%。根据肿瘤分级(G1、G2、G3)分为3组,计算累计发生率,分别绘制出各组事件累积发生(CIF)曲线。结果显示术后5年CSM分别为7.34%、15.05%和17.47%,经Gray检验,各组CSM之间的差异有统计学意义(P<0.05);术后5年OCM分别为29.52%、28.45%和37.69%,差异没有统计学意义(P>0.05),见表2,图1~3。竞争风险回归模型探索影响CSM的因素,将肿瘤分级、年龄和人种作为自变量纳入模型,经分析发现肿瘤分级为G3的患者发生CSM的风险是G1的患者的2.45倍(95%CI 1.09-5.62,P<0.05)。然而单因素和多因素分析均未发现分级为G2的患者发生CSM的风险比G1的患者更高。此外,年龄和人种也不是影响CSM的独立因素,见表3。
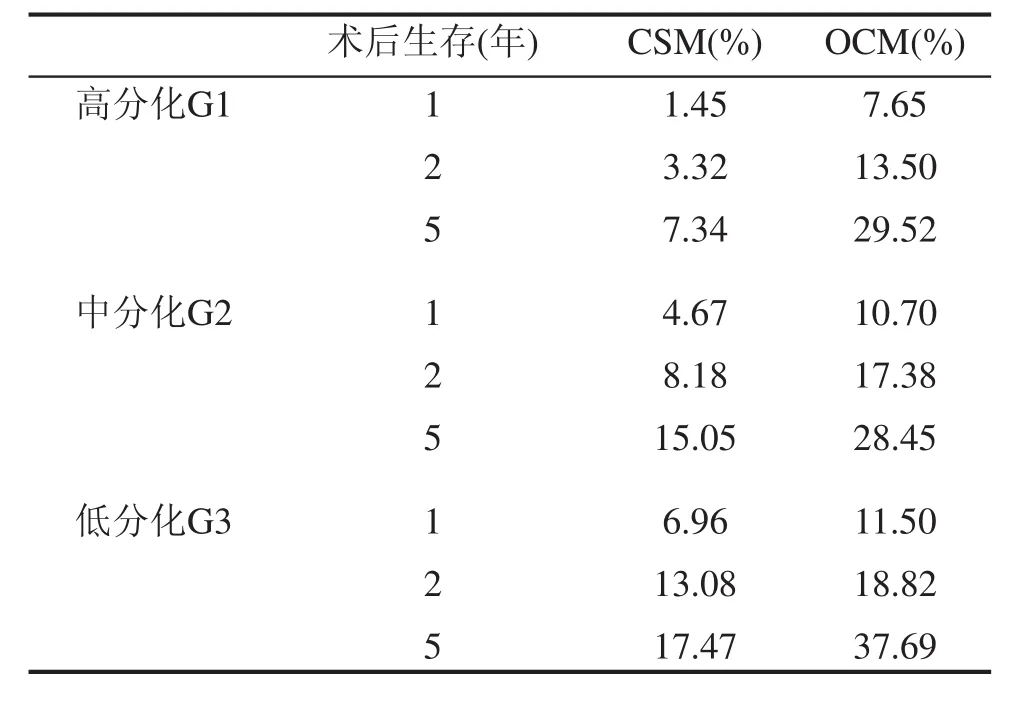
表2 不同肿瘤分级患者PTE术后CSM和OCM
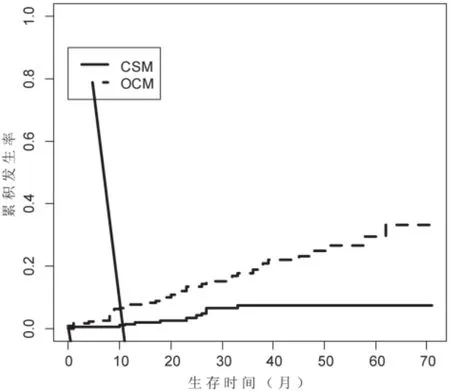
图1 T1G1期阴茎鳞状细胞癌患者事件累积发生(CIF)曲线
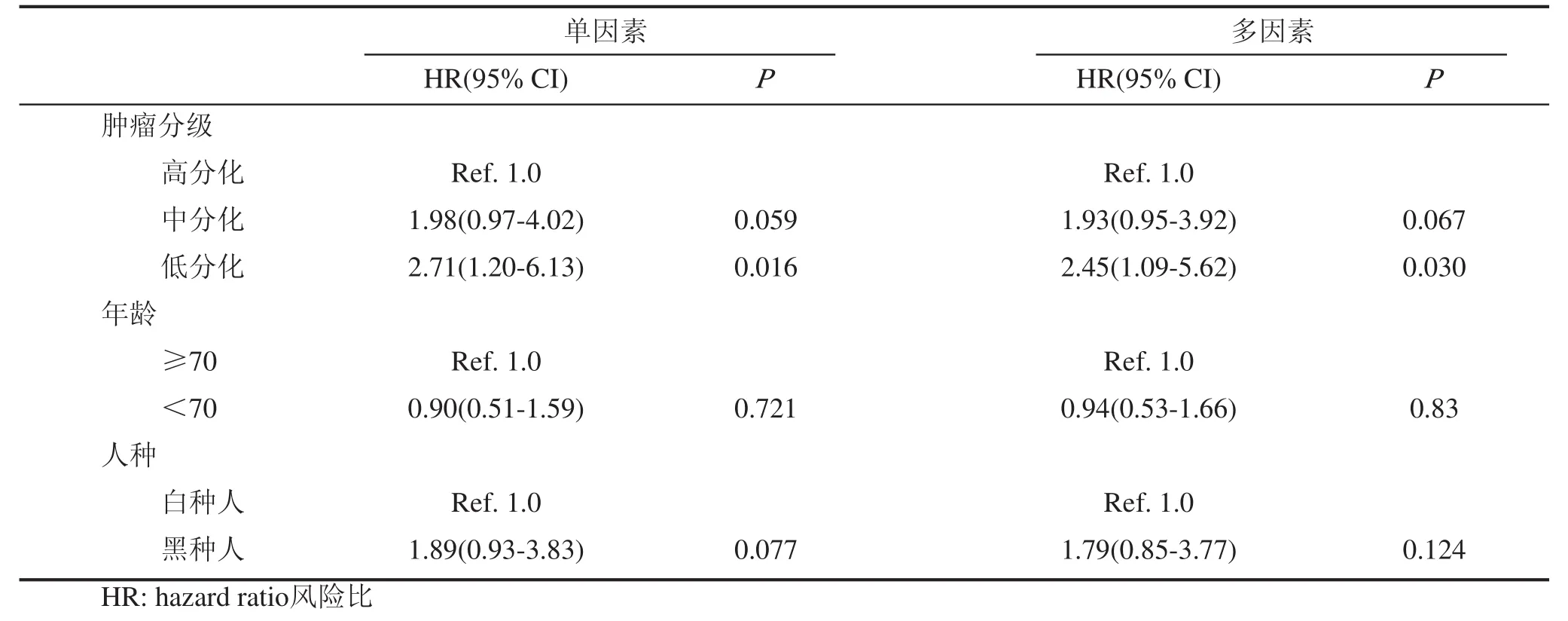
表3 单因素和多因素竞争风险回归探索影响阴茎癌患者CSM的因素
讨 论
关于阴茎癌患者局部淋巴结治疗颇有争议,欧洲泌尿协会(EUA)指南推荐对T1G2-3阴茎癌患者行腹股沟淋巴结清扫(ILND)[6],然而北美的指南仅推荐T1G3的患者接受该手术[7],而实际的临床实践中只有部分T1G2-3阴茎癌患者进行了ILND,因为该患者是否进行ILND还需要考虑其本身情况,例如年龄、其他合并症等。之前有关T1,cN0期的SCCP的研究病例数较少,且CSM的范围较宽(0.0%~17.6%)[8-10]。最近Thuret利用SEER数据库对1988年至2006年T1G1-3阴茎癌患者进行了竞争分析,结果显示T1G1、T1G2和T1G3患者PTE术后5年的CSM分别为2.6%、10.0%和15.9%[11]。本研究利用SEER数据库更新后2004年至2009年T1G1-3患者的数据,探讨哪些患者需要进行积极的淋巴结治疗。
本研究结果显示PTE术后5年未进行ILND的T1G1、T1G2和T1G3患者发生CSM分别为7.34%、15.05%和17.47%。T1G3患者术后5年的CSM(17.47%)说明术后5年大约6个患者中就有1个死于SCCP,这个结果提示对那些临床上未发现腹股沟淋巴结转移的患者实施ILND可能得到临床获益。之前已经提及,EUA和北美的临床指南也均支持对这些患者实施ILND。T1G2患者术后5年的CSM为15.05%也说明将近6个病人中有1人会最终死于SCCP。EUA指南支持对这类患者进行ILND,但北美的指南没有支持也没有反对这一做法。我们的研究结果倾向于EUA的指南推荐。单因素和多因素竞争风险回归分析发现年龄可能并不是影响CSM的重要因素。T1G1患者术后5年的CSM为7.34%,说明大约13个患者中有1个死于SCCP,提示T1G1期患者死于SCCP概率相对较低,进行ILND未必有临床获益,积极随访是较好的选择。
由于研究使用的是SEER数据库,所用资料为回顾性数据,目前也没有关于这一问题的大规模随机临床试验,所以临床实践中,医生还是要结合患者实际情况和患者本人意愿决定是否要进行ILND来降低发生CSM的风险。
根治性ILND的临床并发症较多,尽管这些并发症是可以控制的,但是考虑到患者的生存质量,对T1期患者行根治性ILND可能并不是一个好的选择。1988年Catalona提出一种改良ILND,将清扫范围缩小并保留大隐静脉[12]。该技术可以减少手术风险,改良ILND主要并发症包括皮瓣坏死、伤口感染、水肿、和淋巴囊肿[13,14],并且如果在术中发现阳性淋巴结,改良ILND可更换成根治性ILND。阴茎癌动态前哨淋巴结活检术也可以应用于这些患者,但是该技术并未形成统一的标准,SPECT/CT显影会遗漏1/3淋巴结阳性的患者,EUA推荐采用该技术的泌尿外科中心每年至少有20例患者的经验[15]。因此,该方法可能不适合T1G2 和T1G3的患者。
另外,本研究各组别OCM都比较高,分别为29.52%、28.45%和37.69%,所以对T1,cN0期SCCP患者术后积极随访不可或缺。
本研究也有较多的局限性。首先,本研究所用SEER数据库病例为回顾性数据;其次,肿瘤是否突破周围间隙,淋巴管是否栓塞都有可能增加CSM,而SEER数据库没有包含这些信息[16,17];第三,本研究采用的数据为2004年至2009年诊断为SCCP的患者,因此这些随访的时间相对较短,可能会影响CSM的估计。
1 Df L, Ca P. Tumors of the penis. Campbell urology 8th ed, Pc W, Ab R, Philadelphia: Saunders, 2002: 2945-2982.
2 Hakulinen T, Rahiala M. An example on the risk dependence and additivity of intensities in the theory of competing risks. Biometrics 1977; 33(3): 557-559
3 Fine J, Gray R. A proportional hazards model for the subdistribution of a competing risk. J Am Statist Assoc 1999; 94: 496-509
4 江一涛, 胡海兰, 魏巧玲, 等. 竞争风险模型的发展与应用. 中国卫生统计 2009; 26(4): 445-447
5 Scrucca L, Santucci A, Aversa F. Regression modeling of competing risk using R: an in depth guide for clinicians. Bone Marrow Transplant 2010; 45(9): 1388-1395
6 Pizzocaro G, Algaba F, Horenblas S. European Association of Urology (EAU) guidelines group on penile cancer. Eur Urol 2010; 57(6): 1002-1012
7 National Cancer Institute, US National Institutes of Health. Available at http://www.cancer.gov/cancertopics/ pdq/treatment/penile/HealthProfessional
8 Fraley EE, Zhang G, Manivel C, et al. The role of ilioinguinal lymphadenectomy and significance of histological differentiation in treatment of carcinoma of the penis. J Urol 1989; 142(6): 1478-1482
9 Theodorescu D, Russo P, Zhang ZF, et al. Outcomes ofinitial surveillance of invasive squamous cell carcinoma of the penis and negative nodes. J Urol 1996; 155(5): 1626-1631
10 Schlenker B, Tilki D, Gratzke C, et al. Intermediatedifferentiated invasive (pT1 G2) penile cancer-oncological outcome and follow-up. Urol Oncol 2011; 29(6): 782-787
11 Thuret R, Sun M, Abdollah F, et al. Competing-risks analysis in patients with T1 squamous cell carcinoma of the penis. BJU Int 2013; 111(4 Pt B): E174-179
12 Catalona WJ. Modifi ed inguinal lymphadenectomy for carcinoma of the penis with preservation of saphenous veins: technique and preliminary results. J Urol 1988; 140(2): 306-310
13 Bouchot O, Rigaud J, Maillet F, et al. Morbidity of inguinal lymphadenectomy for invasive penile carcinoma. Eur Urol 2004; 45(6): 761-765, discussion765-766
14 Bevan-Thomas R, Slaton JW, Pettaway CA. Contemporary morbidity from lymphadenectomy for penile squamous cell carcinoma: the M.D. Anderson Cancer Center Experience. J Urol 2002; 167(4): 1638-1642
15 Leijte JA, van der Ploeg IM, Valdes Olmos RA, et al. Visualization of tumor blockage and rerouting of lymphatic drainage in penile cancer patients by use of SPECT/CT. J Nucl Med 2009; 50(3): 364-367
16 Graafland NM, Lam W, Leijte J A, et al. Prognostic factors for occult inguinal lymph node involvement in penile carcinoma and assessment of the high-risk EAU subgroup: a two-institution analysis of 342 clinically node-negative patients. Eur Urol 2010; 58(5): 742-747
17 Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol 2009; 27(2): 169-177
(2013-08-12收稿)
Competing risk analysis in patients with T1 squamous cell carcinoma of the penis
Gu Weijie1,2, Zhu Yao1,2, Yao Xudong1,2, Zhang Shilin1,2, Dai Bo1,2, Zhang Hailiang1,2, Shi Guohai1,2, Ye Dingwei1,2*
1. Department of Urology Fudan University Shanghai Cancer Center, Shanghai 200032, China; 2. Department of Oncology Shanghai Medical College, Fudan University Corresponding author: Ye Dingwei, E-mail: dwyeli@163.com
ObjectiveTo comparatively analyze cancer-specifi c mortality (CSM) and other-cause mortality (OCM) in individuals with stage T1G1-3 clinically node-negative (cN0) squamous cell carcinoma of the penis (SCCP).Methods Total of 641 SCCP patients treated with primary tumor excision (PTE) without an inguinal lymph node dissection (ILND) were identified relying on the Surveillance, Epidemiology and End Results (SEER) registries between 2004 and 2009. Cumulative incidence plots were used to depict the effect of CSM relative to OCM. Competing risk regression analysis was used to quantify the risk of CSM or OCM under normalization of age, race and tumor grade.Results The 5-year CSM and OCM rates after PTE were 12.38% and 30.06% respectively. The 5-year CSM without ILND were 7.34%, 15.05% and 17.47% in patients with T1G1, T1G2 and T1G3 (P<0.05). The 5-year OCM rates were 29.52%, 28.47% and 37.69% in patients with T1G1, T1G2 and T1G3 (P>0.05). Patients with G3 had 2-fold higher CSM rates than those with G1(95%CI 1.09-5.62, P<0.05). However, such results were not found in patients with G2.Conclusion The T1G3 and T1G2 patients are suitable for ILND due to high CSM rates. T1G1 patients are preferred to long term active follow-up due to relatively low CSM rates.
penile neoplasms; neoplasms, squamous cell competing risk; SEER program
10.3969/j.issn.1008-0848.2014.01.002
R 737.27
*通讯作者, E-mail: dwyeli@163.com
