重视妊娠失败中的男性因素评估
2014-04-22白文俊
白文俊 耿 冲
北京大学人民医院泌尿外科,北京大学人民医院男性健康管理研究所(北京 100044)
·专家述评·
重视妊娠失败中的男性因素评估
白文俊 耿 冲
北京大学人民医院泌尿外科,北京大学人民医院男性健康管理研究所(北京 100044)
随着经济的发展和社会的进步,公众对不孕不育及妊娠失败的关注度不断增加,尤其发生反复妊娠失败(即连续两次或两次以上发生在妊娠早期、中期的自然流产[1])的时候,而其中男性因素越来越受到重视。妊娠失败的男性因素常被关注的有:年龄、身体状况、精液常规异常(如少精、弱精、畸形精子)、免疫学异常(存在抗精子抗体)、内分泌异常(性腺轴或甲状腺功能异常)、生殖系统感染炎症、精索静脉曲张、染色体异常(体细胞染色体异常、精子染色体异常、精子DNA损伤等)、药物、手术、不良生活方式(如吸烟、酗酒)、电离辐射及其他未知因素。
那么上述哪些因素是导致妊娠失败的直接原因和间接原因呢?为此,许多专家学者对此做了相关的研究。
精液参数异常与妊娠失败
Gil-Villa等[1]对23例反复妊娠失败者及11例近期生育者进行对比研究,评价与比较两组精液参数、精子膜脂质过氧化反应、精浆抗氧化能力及精子染色质的完整性。结果发现,近期生育组的精子正常形态率、精子浓度、精子前向运动能力更高,而反复妊娠失败组患者精子畸形率及精子膜脂质过氧化反应较高。
Bhattacharya等[2]对74例反复妊娠失败男性精液进行常规参数及精子DNA完整性检测,并以65位正常生育男性精液作为对照。结果发现:两组样本年龄、精子浓度、精子总数及精子前向运动能力无显著性差异;而两组的活动精子总数、活动精子百分率,更重要的是精子DNA完整率有显著性差异;结论认为精子DNA完整性检测应作为常规项目。
有研究[3,4]表明大头、多尾精子的染色体多倍体、非整倍体率高,精子DNA碎裂指数高,超过99%的精子染色体数目异常发生在X, Y, 13, 18, and 21;精子二倍体、三倍体及四倍体率分别为18.42%, 6.14%和33.99%。该类患者不建议行卵胞浆内单精子注射技术(ICSI),不只成功率低,且易出现染色体异常妊娠失败。
氧化应激反应异常与妊娠失败
精子浆膜富有多元不饱和脂肪酸,胞质内仅含有低浓度清除酶,DNA修复能力有限,所以容易受到氧化应激反应的损害。而精子胞质内含有大量抗氧化剂以保护DNA免受损伤及脂质过氧化反应。但是过量的氧化应激反应产生大量氧化应激产物,致使DNA损伤,从而造成精子DNA碎片形成,胚胎发育异常,最终妊娠失败。形态异常的精子及白细胞产生氧化应激产物,导致氧化应激损伤。这些氧化应激产物及损伤可以影响到精子的质量和功能,进一步影响到精卵结合、受精卵植入及胚胎早期发育。Gil-Villa等[5]研究选取17例其配偶于怀孕12周内有2次以上流产病史的男性患者,其中9例(53%)精子DNA断裂指数增高或硫代巴比妥酸反应物升高。这9例男性中的6例摄入富抗氧化剂食物或抗氧化辅剂(β胡萝卜素、维生素C、维生素E、锌)至少3个月,其配偶均成功生育。结论提示:增加摄入富抗氧化剂食物或抗氧化辅剂有助于降低精子DNA断裂或精子脂质过氧化水平,改善反复妊娠失败的患者其生育结局。
病原体感染与妊娠失败
Matovina等[6]对108例妊娠失败患者(其中54例染色体核型正常,38例不正常,16例染色体核型不明)进行回顾性研究,没有检测出解脲脲原体、人型支原体、人巨细胞病毒(HCMV)或腺病毒相关病毒;1例患者(0.9%)检测出衣原体DNA,8例患者(7%)检测出人乳头状病毒(HPV)DNA 。研究未能证实衣原体、解脲脲原体、人型支原体、人巨细胞病毒、腺病毒相关病毒感染在早期妊娠失败中的作用,而人乳头状病毒在胚胎染色体异常及妊娠失败中的作用有待进一步研究。
遗传学异常与妊娠失败
男性不育相关性遗传学异常包括:染色体异常、基因突变(缺失、错义、无义,异常终止码)、基因表达异常(表观遗传、外显率)和精子DNA损伤。其中与妊娠失败有明确相关的是染色体异常和精子DNA损伤,见图1。
一、染色体异常的类型与原因
染色体异常包括了数目异常(如三体,Down综合征、21三体;克氏征等)、结构异常(如染色体片段重复、缺失、易位或倒位,标记染色体等)及多态性(如Y染色体大小、随体大小有无、次级缢痕的增长或缩短等)。
染色体异常的原因也有化学因素(药物如抗肿瘤药物,苯妥英钠等;农药如有机磷等; 工业毒物如苯、甲苯、铝、砷、氯丁二烯等;食品添加剂如环己基糖精等)、物理因素(如电离辐射)、生物因素(生物类毒素如真菌毒素;病毒如风疹、巨细胞及乙肝病毒等)、 年龄因素(有报道称母亲年龄在35岁以上,由于生殖细胞老化,宫内环境差,易出现染色体畸变;而父亲年龄在35岁以上,与染色体异常的关系目前初步确定)。
二、染色体数目异常的双方概率
胚胎染色体数目异常可能源自父母双方,常见的非整倍体胚胎中双方来源概率,见表1
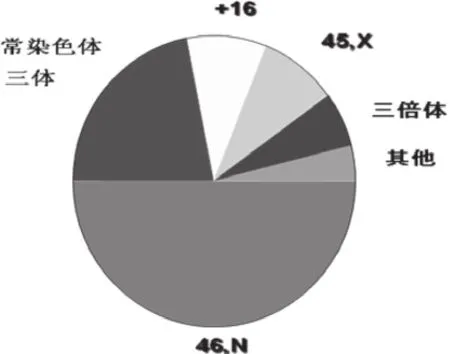
图1 妊娠失败的遗传学原因
三、染色体异常与妊娠结局
染色体数目异常导致胚胎出现非整倍体及染色体不平衡,可能导致胎停育及自然流产。常见染色体多倍体及非整倍体胚胎发育的结局,见表2

表1 染色体非整倍体的来源

表2 染色体数目异常与妊娠结局
(一)染色体易位与妊娠结局
1. 相互易位与妊娠结局 正常情况染色体减数分裂(2:2分离)形成四价体,分离方式如为对位分离(见图2A:AD和BC),则形成正常精子或平衡易位精子,可能正常生育。
异常染色体分离有以下几种情况:(1)减数分裂时,染色体如果2:2分离(如图2B),邻位1(AC和BD)分离,邻位2 (AB和CD)分离,均产生不平衡易位精子。这表现为胎儿异常(部分三体或缺体)。(2)减数分裂时,染色体如果3:1分离:ACD,ABD,BCD形成三体,A、B、C、D形成单体。这表现为胎儿异常(三体或缺体)。(3)减数分裂时,染色体如果4:0分离,表现为胎儿异常(多体或缺体)。以上情况均可能导致妊娠失败。
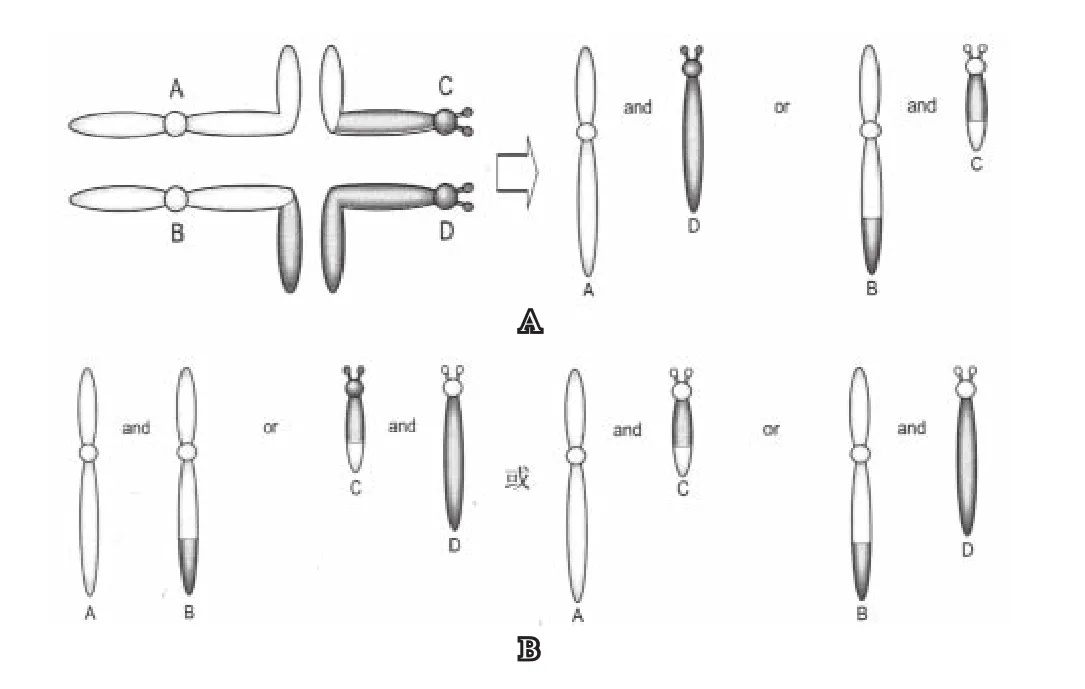
图2 减数分裂时,发生易位的同源染色体(AB和CD)形成4价体及分离模式
2. 罗伯逊易位与妊娠结局 (1)非同源性(非同源染色体间易位),如45,XY, der(14;21)(q10;q10),减数分裂时,染色体如果2:2分离,可能出现正常胚胎;平衡易位携带;三体(21)、单亲双体(14)或妊娠失败。其发生的概率分别为:1/6、1/6、4/6(见图3);(2)同源性(同源染色体间易位),如21:21融合(见图4),减数分裂时不能形成正常精子——必然产生染色体缺体或双体。不能正常妊娠生育——出生子代或为Down综合征,或妊娠失败。 国外6 例家族报告,出生了21个 Down综合征孩子, 发生12例 妊娠失败。
(二)倒位与妊娠结局
如果着丝粒在倒位环的外面时(见图5A),则减数分裂后期出现双着丝粒染色体及无着丝粒的染色体断片。如果着丝粒在倒位环的里面时(图5B),减数分裂时在环内发生染色体片段交换后,会使交换后的染色单体带有缺失或重复。上述情况均可能形成染色体不平衡的精子,导致妊娠失败。
(三)环状染色体与妊娠结局
细胞在有丝分裂时表现不稳定,只有部分细胞可见环状染色体,其他细胞为染色体缺体(无环状染色体),可能造成妊娠失败。
(四)染色体多态性与妊娠结局
染色体多态性主要表现为异染色质的变异,特别是含有高度重复DNA的结构异染色质。染色体的多态性包括:Y染色体的长度变异:大Y(大于18号染色体)或小Y(小于1/2G组染色体);随体的大小、有无;次级缢痕的增长或缩短。目前对于染色体多态性与胚胎发育的关系有争议,国内专家多认为二者有关,国外则不然。
四、男女双方年龄与染色体异常及妊娠失败率
Elise等[7]根据欧洲不育症多中心研究数据(1991~1993)(N=3174),结合男女双方年龄单变量多因素逻辑回归分析得出:女性年龄≥35岁,流产风险增高;在女性≥35岁且男性≥40岁,流产风险尤为突出。故当双方年龄均较高时,妊娠失败风险较高。
Singh等[8]选取66例年龄20~57岁个体,评价精子DNA损伤与凋亡和年龄的关系,结果显示:DNA损伤比例随年龄增加而逐渐增加,而凋亡率相关性呈相反趋势。
Fisch等[9]根据纽约州卫生署先天异常登记信息,统计1983~1997间共3419例 Down综合征患者出生时父母年龄,得出结论:男性在35岁前对子代患Down综合征无明确影响;35岁以后随年龄增长患病风险提高,并且男性年龄在子代患Down综合征中占50%的风险。
五、Y染色体与妊娠结局[10]
完全性AZFc缺失患者的大量精子存在性染色体缺体,子代可能出现45, X0 Turner’s综合征及两性畸形 。46, XY/45, X0嵌合型患者,部分两性畸形患者的AZFc 缺失率为33%;有证据表明,Yq微缺失患者存在Y染色体整体不稳定性,以致形成45, X0 细胞系。
尽管有上述的理论风险,但Yq微缺失者的子代表型通常正常,其原因可能在于45,XO胚胎的低种植率和高自然流产率。
六、精子DNA损伤与妊娠失败
(一)精子的遗传学及表观遗传学与胚胎发育[11-17]

图3 减数分裂时,非同源性罗伯逊易位染色体的分离模式及胚胎结局

图4 同源性罗伯逊易位
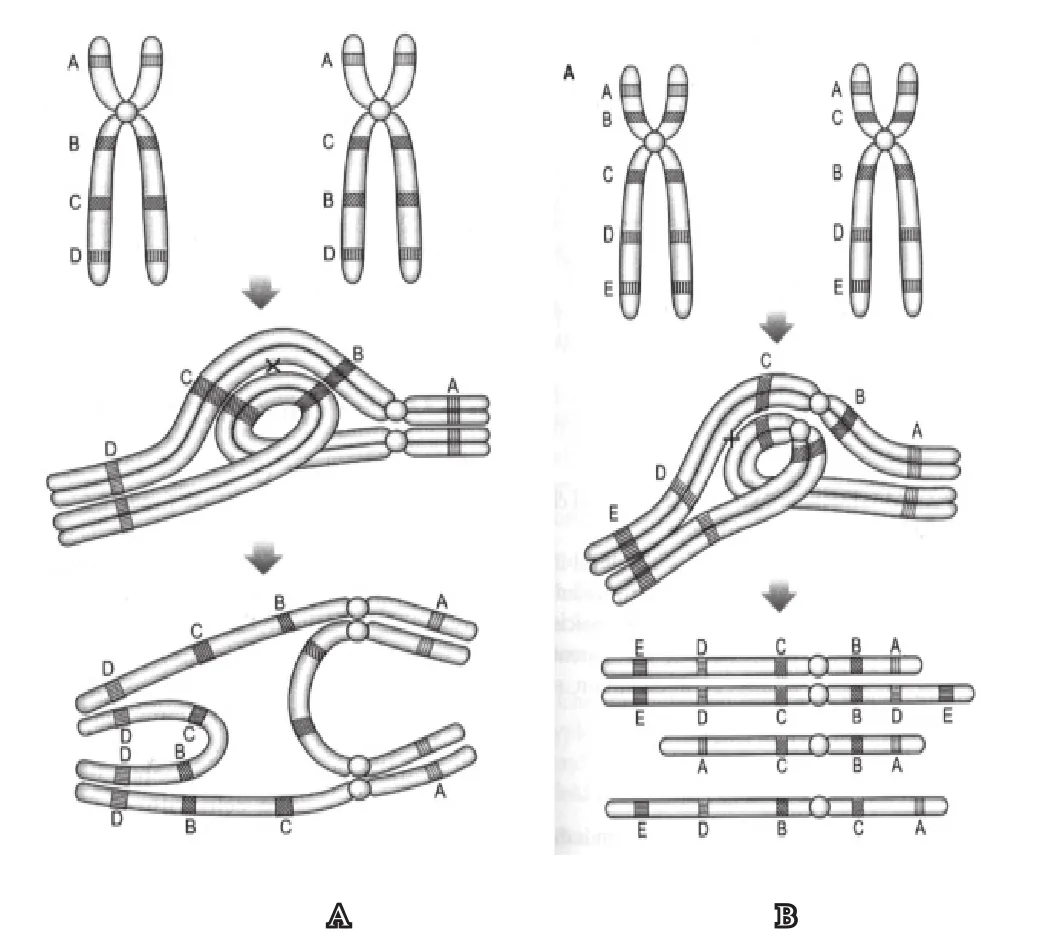
图5 减数分裂时,发生倒位的同源染色体联会及片段交换模式
精子核基因组独特地分为两部分:中心为环状线圈形的鱼精蛋白包装的DNA,无转录及翻译活性,外周为组蛋白包装的DNA(5-15%),保留了核小体结构,该区域包含了发育所需基因、microRNA及信号因子( signaling factors )的激活子,见图6

图6 精子核基因组
其中组蛋白包装的DNA对环境有害因素高度敏感,特别是氧化损伤。染色体端粒维持着染色体和基因组的完整性,该段富含鸟嘌呤的重复序列对自由基诱导的DNA损伤高度敏感。精子染色体端粒的快速改变,即端粒的加速老化,是男性不育症的病因基础。端粒短对卵裂有不利影响,生成异形的囊胚。
卵母细胞受精时,精子除输送核DNA外,还包括卵母细胞活化因子(受精所必需)、中心体(细胞分裂必需)及多种受精卵发育必需的mRNA。发育中精子表观性修饰的研究提示,精子表观基因组在胚胎发育中发挥的关键作用。
表观修饰作用包括DNA甲基化、组蛋白尾部修饰、定向组蛋白保留及鱼精蛋白整合入核染色质,所有变化对精子发育有重要影响。精子经历的上述变化,其目的不仅是通过精子生成屏蔽DNA,而且需要表观修饰作用为后续的胚胎发育做准备。精子遗传物质的损害或上述表观修饰作用的异常势必影响精子的授精潜力及胚胎的早期发育。
(二)精子染色体异常与精子DNA损伤[10]
精子的非整倍体,特别是性染色体的非整倍体、染色体易位与严重的生精障碍相关;精子的非整倍体及精子DNA损伤(单链或双链),与妊娠结局相关。
(三)精子DNA损伤的原因
精子DNA损伤包括精索静脉曲张[18-20]、化疗及放疗[21-23]、吸烟[23-26]、ROS及白细胞精子症[27-31]、凋亡异常[32,33]、鱼精蛋白缺乏[34]等。
(四)精子DNA损伤的检测
精子DNA损伤可通过彗星实验(Comet试验)及精子染色质扩散试验( SCD )等方法进行检测。
1. Comet试验 细胞溶解后碱性液使DNA变性,进行电泳。正常对照的精子表现为球形,核浓聚。而DNA损伤的细胞表现如彗星,彗星尾部为DNA碎片(图7)。
2. 精子染色质扩散试验( SCD ) SCD是彗星试验的改版(图8)。

图7 Comet实验
(五)精子DNA损伤与妊娠结局
Henkel等[35]通过对249例接受体外受精联合胚胎移植技术(IVF)患者标本进行研究。结果显示包含DNA损伤的精子可使卵母细胞受精,形成2原核期,但到4细胞期,父方基因启动表达,由于氧化损伤,精子DNA碎裂,即使已形成囊胚,也会出现胚胎发育中止。
成熟精子修复DNA损伤的能力有限,而卵母细胞修复精子DNA损伤的能力取决于其胞质和基因组的品质,后者随女方年龄增加而显著下降。同时精子DNA的品质也与男方年龄相关,年龄越大精子DNA损伤的概率可能越大。精子DNA修复失败,可能导致妊娠失败或胎儿异常。
综上所述,目前认为,妊娠失败的男性的直接因素主要是精子染色体数目异常、结构异常及精子DNA损伤,间接因素是可能导致精子染色体数目异常、结构异常及精子DNA损伤的内部因素(如精子凋亡异常,氧化应激反应异常,精索静脉曲张、吸烟等)和外部因素(某些药物,化学品,电离辐射等)。处理策略是染色体异常应做遗传咨询,精子DNA损伤过度应积极寻找病因(如吸烟、静脉曲张及感染及炎症等),并做相应的预防和治疗。胚胎发育异常男方检查项目:体检及影像学检查(B超)、精液常规、染色体核型分析、精子DNA损伤的检测等。还应告知夫妻双方,目前反复妊娠失败的干预方法循证医学证据不足,观察试孕是合理策略,即使无任何治疗,2/3夫妻能正常生育[36]。

图8 精子染色质扩散试验
流产, 自然; 男性不育
1 Gil-Villa AM, Cardona-Maya W, Agarwal A, et al. Assessment of sperm factors possibly involved in early recurrent pregnancy loss. Fertil Steril 2010; 94(4): 1465-1472
2 Bhattacharya SM, et al. Association of various sperm parameters with unexplained repeated early pregnancy loss-which is most important? Int Urol Nephrol 2008; 40(2): 391-395
3 Perrin A, Morel F, Moy L, et al. Study of aneuploidy in large-headed, multiple-tailed spermatozoa: case report and review of the literature. Fertil Steril 2008; 90(4): 1201.e13-e17
4 Brahem S, Mehdi M, Elghezal H, et al. Study of aneuploidy rate and sperm DNA fragmentation in largeheaded, multiple-tailed spermatozoa. Andrologia 2011; 4(2): 130-135
5 Gil-Villa AM, Cardona-Maya W, Agarwal A, et al. Role of male factor in early recurrent embryo loss: do antioxidants have any effect? Fertil Steril 2009; 92(2): 565-571
6 Matovina M, Husnjak K, Milutin N, et al. Possible role of bacterial and viral infections in miscarriages. Fertil Steril 2004; 81(3): 662-669
7 Elise de La Rochebrochard, Thonneau P. Paternal age and maternal age are risk factors for miscarriage result of a multicentre European study. Hum Reprod 2002; 17(6): 1649-1656
8 Singh NP, Muller CH, Berger RE. Effects of age on DNA double-strand breaks and apoptosis in human sperm. Fertil Steril 2003; 80(6): 1420-1430
9 Fisch H, Hyun G, Golden R, et al. The infl uence of paternal age on down syndrome. J Urol 2003; 169(6): 2275-2278
10 Siffroi JP, Le Bourhis C, Krausz C, et al. Sex chromosome mosaicism in males carrying Y-chromosome long arm deletions. Hum Reprod 2000; 15(12): 2559-2562
11 Krawetz SA. Paternal contribution: new insights and future challenges. Nat Rev Genet 2005; 6(8): 633-642
12 Carrell DT. Contributions of spermatozoa to embryogenesis: assays to evaluate their genetic and epigenetic fitness. Reprod Biomed Online 2008;16(4):474-484.
13 Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges. Nat Med 2008; 14(11): 1197-1213
14 Barroso G, Valdespin C, Vega E, et al. Developmental sperm contributions: fertilization and beyond. Fertil Steril 2009; 92(3): 835-848
15 Sutovsky P, Schatten G. Paternal contributions to the mammalian zygote: fertilization after sperm-egg fusion. Int Rev Cytol 2000; 195: 1-65
16 Ostermeier GC, Goodrich RJ, Moldenhauer JS, et al. A suite of novel human spermatozoal RNAs. J Androl 2005; 26(1): 70-74
17 Jenkins TG, Carrell DT. The paternal epigenome and embryogenesis: poising mechanisms for development. Asian J Androl 2011; 13(1): 76-80
18 Saleh RA, Agarwal A, Sharma RK, et al. Evaluation of nuclear DNA damage in spermatozoa from infertile men with varicocele. Fertil Steril 2003; 80(6): 1431-1436
19 Fischer U, Jänicke RU, Schulze-Osthoff K. Many cuts to ruin: a comprehensive update of caspase substrates. Cell Death Differ 2003;10(1):76-100
20 Zini A, Finelli A, Phang D, et al. Influence of semen processing technique on human sperm DNA integrity. Urology 2000; 56(6): 1081-1084
21 Chatterjee R, Haines GA, Perera DM, et al. Testicular and sperm DNA damage after treatment with fl udarabine for chronic lymphocytic leukaemia. Hum Reprod 2000; 15(4): 762-766
22 Deane L, Sharir S, Jarvi K, et al. High levels of sperm DNA denaturation as the sole semen abnormality in a patient after chemotherapy for testis cancer. J Androl 2004; 25(1): 23-24
23 Kobayashi H, Larson K, Sharma RK, et al. DNA damage in patients with untreated cancer as measured by the sperm chromatin structure assay. Fertil Steril 2001; 75(3): 469-475
24 Mak V, Jarvi K, Buckspan M, et al. Smoking is associated with the retention of cytoplasm by human spermatozoa. Urology 2000; 56(3): 463-466
25 Künzle R, Mueller MD, Hänggi W, et al. Semen quality of male smokers and nonsmokers in infertile couples. Fertil Steril 2003; 79(2): 287-291
26 Potts RJ, Newbury CJ, Smith G, et al. Sperm chromatin damage associated with male smoking. Mutat Res 1999; 423(1-2): 103-111
27 de Lamirande E, Eiley D, Gagnon C. Inverse relationship between the induction of human sperm capacitation and spontaneous acrosome reaction by various biological fl uids and the superoxide scavenging capacity of these fl uids. Int J Androl 1993; 16(4): 258-266
28 Zini A, De Lamirande E, Gagnon C. Low levels of nitric oxide promote human sperm capacitation in vitro. J Androl 1995; 16(5): 424-431
29 Twigg J, Fulton N, Gomez E, et al. Analysis of the impact of intracellular reactive oxygen species generation on the structural and functional integrity of human spermatozoa: lipid peroxidation, DNA fragmentation and effectiveness of antioxidants. Hum Reprod 1998; 13(6): 1429-1436
30 Iwasaki A, Gagnon C. Formation of reactive oxygen species in spermatozoa of infertile patients. Fertil Steril 1992; 57(2): 409-416
31 Zini A, de Lamirande E, Gagnon C. Reactive oxygen species in semen of infertile patients: levels of superoxide dismutase- and catalase-like activities in seminal plasma and spermatozoa. Int J Androl 1993; 16(3): 183-188
32 Baccetti B, Collodel G, Piomboni P. Apoptosis in human ejaculated sperm cells (notulae seminologicae 9). J Submicrosc Cytol Pathol 1996; 28(4): 587-596
33 Sakkas D, Seli E, Bizzaro D, et al. Abnormal spermatozoa in the ejaculate: abortive apoptosis and faulty nuclear remodelling during spermatogenesis. Reprod Biomed Online 2003; 7(4): 428-432
34 Cho C, Jung-Ha H, Willis WD, et al. Protamine 2 defi ciency leads to sperm DNA damage and embryo death in mice. Biol Reprod 2003; 69(1): 211-217
35 Henkel R, Hajimohammad M, Stalf T, et al. Infl uence of deoxyribonucleic acid damage on fertilization and pregnancy. Fertil Steril 2004; 81(4): 965-972
36 Branch DW, Gibson M, Silver RM. Recurrent miscarriage. N Engl J Med 2010; 363(18): 1740-1747
(2013-12-15收稿)
10.3969/j.issn.1008-0848.2014.01.001
R 698.2; R 714.21
