猪链球菌2型主要毒力因子三重荧光定量PCR检测方法的建立
2014-04-15王蓉蓉孙卫东刘迎春陈永军薛俊欣
王蓉蓉,孙卫东,蒋 蔚,刘迎春,陈永军,薛俊欣,张 梦,王 权
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 南京农业大学动物医学院,南京 210095)
猪链球菌2型主要毒力因子三重荧光定量PCR检测方法的建立
王蓉蓉1,2,孙卫东2,蒋 蔚1,刘迎春1,陈永军1,薛俊欣1,2,张 梦1,王 权1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 南京农业大学动物医学院,南京 210095)
根据GenBank中猪链球菌2型三种毒力因子CP2SJ、MRP、EF基因序列,利用Primer Express 3.0软件分别设计3对特异性的引物及相应的Taqman探针。CP2SJ、MRP、EF探针5′端分别标记FAM、HEX、CY5荧光发射基团,3′端标记BHQ1淬灭荧光基团。通过优化反应体系和程序,建立了一种基于Taqman探针法的三重荧光定量PCR,可同时检测上述三种毒力基因。该方法灵敏度高,CP2SJ、MRP、EF的最低检测限分别为90、40、60拷贝数/μL的质粒;特异性强,与其他病原菌无交叉反应;重复性好,变异系数均小于3%。整个检测扩增在60 min内完成。以上结果表明本试验所建立的三重荧光定量PCR方法的敏感性、重复性及特异性均较好,可用于同时快速检测猪链球菌2型三种毒力因子。
猪链球菌2型;三重荧光定量PCR;毒力因子
猪链球菌是猪的一种常见病原体,由猪链球菌2型引起的疾病是一种重要的人畜共患病。世界动物卫生组织(OIE)将猪链球菌病列为B类疫病,我国将其列为二类动物疫病[1]。依据荚膜多糖的差异,将猪链球菌划分35个血清型,又以猪链球菌2型(Streptococcus suisserotype 2,S.Suis2)流行区域最为广泛,毒性也最强,是全球范围内发生的猪链球菌病的主要病原。感染猪链球菌后可导致猪产生很多疾病如败血症、脑膜炎、关节炎等,严重者还会导致突然死亡等,部分从业人群接触感染后会产会中毒性休克、败血症、脑膜炎及死亡等恶劣后果[2-4]。
猪链球菌的致病力与毒力因子密切相关。荚膜多糖(capsulalr polysaccharide, CPS)是目前已确定公认的猪链球菌2型细菌毒力因子。此外,大部分猪源性强毒力猪链球菌2型菌株同时具有溶菌酶释放蛋白(muramidase-released protein,MRP)和胞外因子(extracellular protein factor,EF)。Vecht等[5]研究认为根据MRP和EF的有无,猪链球菌2型存在着3种表型:MRP+EF+、MRP+EF-和MRP-EF-。人工感染小鼠和猪的实验表明MRP+EF+菌株可致猪产生典型脑膜炎、多发性关节炎和多发性浆液炎等疾病;MRP+EF-菌株仅引起较为温和的疾病;而MRP-EF-菌株则无致病性。随着养猪业的发展,猪链球菌2型广泛分布在各大小猪场及农村散养的猪群中,并且其发病率一直呈上升趋势。目前针对该病原的方法多为传统的细菌分离鉴定,耗费时间长且结果不准确,亦不能明确其所带毒力因子。
本研究针对猪链球菌2型三个公认的毒力因子CPS2J、MRP、EF分别设计相应引物及Taqman探针,建立了一种简便、准确、快速的三重荧光定量PCR检测方法,为猪链球菌2型的检测以及其毒力因子的研究提供有效的技术支持,也有助于对猪链球菌的有效防控措施的制定,对食品及公共卫生安全具有一定的意义。
1 材料与方法
1.1 主要试剂和仪器哥伦比亚血琼脂平板购自上海科玛嘉微生物技术有限公司;DNAMarker(DL2000)购自美国Promega公司;2×PCRTaqMix购自广州东盛生物科技有限公司;荧光定量PCR试剂盒购自大连(TaKaRa)宝生物公司;质粒小量提取试剂盒购自杭州爱思进生物技术公司;胶回收试剂盒购自杭州爱思进生物技术公司;细菌基因组DNA快速提取试剂盒购自北京TIANGEN生化有限公司。
Gel Doc EZ Imager凝胶成像系统购自美国Bio-Rad公司;PCR分析仪购自德国Eppendorf公司;ABI 7500 Fast Real-Time PCR仪购自美国ABI公司。
1.2 种系背景明确的试验对照菌株ATCC35246株(马链兽疫亚种,Streptococcusequi subsp zooepidemicus,SEZ,分离自中国四川病猪)、猪链球菌2型(Streptococcus suis serotype 2,S.Suis2)Ha9801强毒株、弱毒株T15等由南京农业大学预防兽医组实验室惠赠;无乳链球菌、化脓链球菌、猪沙门氏菌、猪链球菌1型、猪链球菌9型等由本研究室保存。
1.3 引物及探针根据GenBank中S.Suis2的CPS2J、MRP和EF基因序列(登录号:AF118389.1、X64450.1和JF813492.1)各自设计一对引物及相应探针(表1)。其中探针5′端标记荧光报告基团依次为FAM、HEX、CY5,3′端均标记BHQ1淬灭荧光基团。引物和探针由上海基康生物科技有限公司合成。
1.4 猪链球菌2型细菌基因组DNA的提取取2mL细菌增菌培养液,10000×g离心1min,尽量吸净上清,然后加入180μL裂解液(20mmol/LpH8.0Tris、2mmol/LNa2-EDTA、1.2 %Triton、终浓度为20mg/mL的溶菌酶),37℃处理30min以上。然后按细菌基因组DNA快速提取试剂盒步骤进行提取。将所得DNA于-20℃保存备用。
1.5 目的片段的PCR扩增及纯化以Ha9801菌株DNA为模板,分别用CPS2J、MRP、EF基因引物扩增各自特异性目的片段。PCR反应体系:Premix12.5μL、上下游引物各1μL、模板1μL,用双蒸水补足至25μL。扩增过程:95℃预变性5min;95℃变性35s,59℃退火20s,72℃延伸30s,40个循环;72℃终延伸10min。PCR反应结束后,扩增产物取6μL用1.5%琼脂糖进行凝胶电泳,用BIO-RAD凝胶成像系统拍照记录结果。按DNA胶回收试剂盒说明书纯化回收PCR产物。
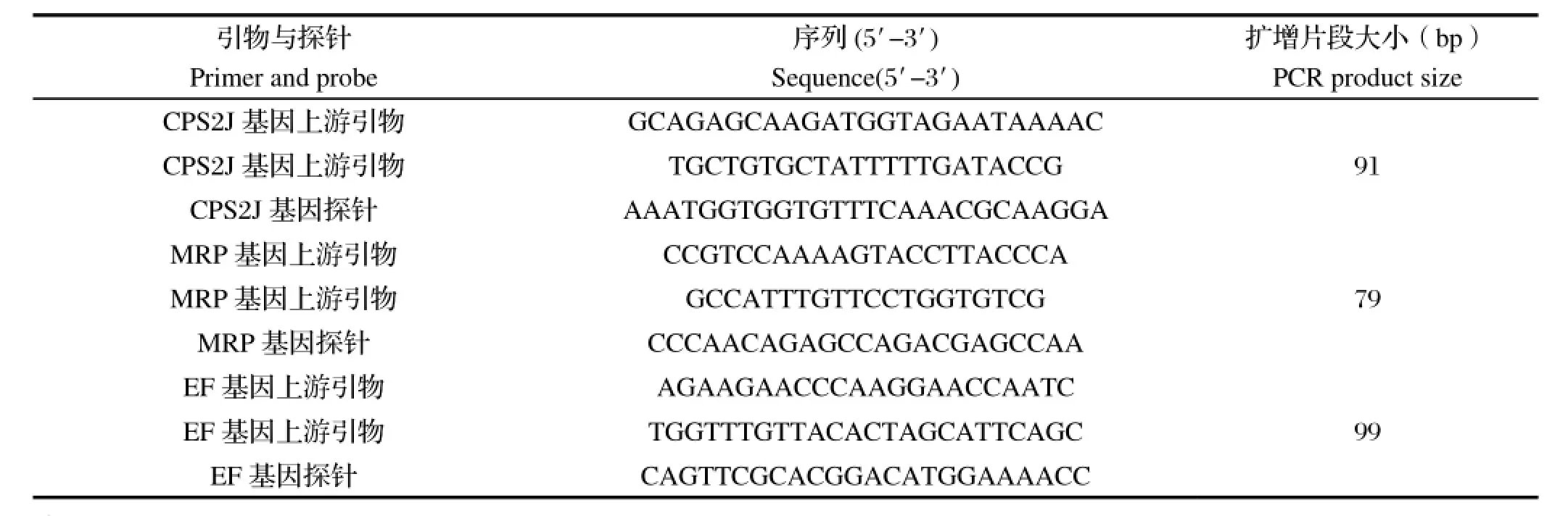
表1 猪链球菌2型多重实时荧光定量PCR三重引物与探针Table 1 The primer pairs and Taqman probes in the triple real-time qPCR for S.suis2
1.6 重组质粒的构建及浓度测定将上述获得的目的片段分别与T载体连接。体系:SolutionⅠ5μL、pMD18-Tvector1μL、胶回收产物4μL,总体积10μL。16℃过夜连接。取DH5α感受态细胞50μL至连接产物中,冰浴30min;42℃热击90s,迅速静置冰上2~3min;向每个离心管中加入950μL的LB液体培养基,混匀后置于37℃摇床,150×g振荡培养45min,使菌体复苏;取转化后的菌液400μL,涂Amp+LB琼脂平板,37℃培养,约12h左右长出大小适宜菌落;挑取5~8个单菌落,分别接种于2mLAmp+LB液体培养基,置摇床,37℃、180×g培养6~8h;取菌液测得OD值至0.6~0.8时,分别取1μL菌液作为模板,用各自对应的上下游引物,进行PCR扩增,PCR产物经1.5 %的琼脂糖凝胶电泳及凝胶成像观察,并选取其中3~5个阳性克隆送上海英潍捷基公司测序验证。取测序结果正确的阳性克隆菌液2mL,按照质粒小量提取试剂盒说明书提取质粒,分别命名为pMD18T-CPS2J、pMD18T-MRP、pMD18T-EF,-20℃保存备用。用BIO-RAD核酸蛋白分析仪分别测定重组质粒的浓度3次,各取其平均值。
1.7 三重荧光定量PCR方法的建立
1.7.1 反应条件的优化和标准曲线的建立 先建立并优化单个靶基因检测体系,在此基础上,逐步改变引物与探针的浓度(采用矩阵法)以达到最佳的扩增效率,获得良好的荧光曲线,继而进行三重实时荧光定量PCR体系组合和条件优化。依照已建立的三重荧光定量PCR反应条件,将重组质粒标准品用无核酸酶污染的双蒸水稀释至1010拷贝/μL,然后依次进行10倍梯度稀释,以不同质粒浓度标准品为模板进行三重荧光定量PCR扩增反应,建立动力扩增曲线和标准曲线。
1.7.2 敏感性试验 用灭菌ddH2O梯度稀释含CPS2J、MRP、EF基因的已知浓度质粒DNA,进行三重荧光定量PCR扩增,运用优化后的方法来检测,根据检测的阈值来判断该方法的敏感性。
1.7.3 特异性试验 对猪链球菌2型Ha9801强毒株、猪链球菌2型弱毒株T15、无乳链球菌、化脓链球菌、猪沙门氏菌、猪链球菌1型、猪链球菌9型、马兽疫链球菌亚种等分别提取DNA,提取的细菌基因组DNA为模板进行三重荧光量PCR扩增。
1.7.4 重复性试验取 108、107、106拷贝数/μL 3组不同浓度的重组质粒标准品DNA,每组做3次重复检测。对结果进行统计学分析,计算每个稀释度Ct值和拷贝数的标准偏差(s)和变异系数(CV)。
2 结果
2.1 目的片段的获得扩增产物经琼脂糖凝胶电泳(图1),条带大小均与预期一致,其大小依次为:91、79、99 bp。将测序所得结果与猪链球菌2型CPS2J、MRP、EF基因序列对比,同源性为100%。

图1 猪链球菌2型CPS2J、MRP、EF基因的PCR扩增Fig.1 The amplif cation of CPS2J、MRP、EF gene from S.suis2 by PCR
2.2 重组质粒的制备和浓度测定选取其中3~5个阳性克隆直接送上海英潍捷基公司测序,经测序并与GenBank上公布的同种细菌基因序列比对,同源性均为100%。重组质粒的浓度计算公式为:(6.02×1023)×(ng/μL×10-9)/(DNA length)=拷贝数/μL。计算结果:pMD18T-CPS2J浓度为3.58×1010拷贝数/μL,pMD18T-MRP浓度为2.87×1010拷贝数/μL,pMD18T-EF浓度为6.68×1010拷贝数/μL。
2.3 反应条件的优化及标准曲线的建立 对三重荧光定量PCR各条件进行优化后,最终确定反应体系为:Premix ExTaq(2X) 12.5 μL,ROX Reference Dye Ⅱ 0.4 μL,CPS2J上下游引物分别为0.2、0.4μL,MRP上下游引物分别为0.3、0.2 μL,EF上下游引物均为0.4 μL,探针用量均为0.2μL,模板1 μL,用灭菌ddH2O补足至25 μL。体系中所用引物和探针的浓度均配成20 pmol/mL。反应条件,95℃预变性1 min;95℃变性15 s,60℃退火并延伸34 s,扩增40个循环;在60℃结束开始收集荧光信号;全部扩增检测在60 min内完成。
重组质粒标准品在浓度103~108拷贝/μL间都能检测出荧光信号,扩增曲线圆滑平整(图2),且标准曲线均具有良好的线形关系。以起始模板数的对数为X轴,Ct值为Y轴作图,得到3条标准曲线方程(图3)。方程如下:CPS2J:-3.281528X+35.610966,R2=0.997910;MRP:-3.303893X+35.863792,R2=0.997389;EF:-3.228872X+35.863792,R2=0.997897。

图2 S.suis 2 CPS2J、MRP、EF三重实时荧光定量PCR动力学扩增曲线Fig.2 The dynamic curve of the triple Real-Time qPCR for CPS2J, MRP and EF in S.suis 2

图3 三重荧光定量PCR检测S.suis2 中CPS2J、MRP、EF基因的标准曲线Fig.3 The standard curves of the triple Real-Time qPCR for CPS2J, MRP and EF in S.suis2
2.4 敏感性试验
2.4.1 普通PCR检测猪链球菌2型敏感性试验 用常规PCR方法通过对10倍梯度稀释的猪链球菌2型三种毒力因子基因阳性质粒进行检测,发现CPS2J、MRP、EF基因均能检测最低至104拷贝数/μL。
2.4.2 三重荧光定量PCR检测猪链球菌2型敏感性试验 经过检测,在重组质粒CPS2J模板为90拷贝数/ μL时仍能检测出荧光信号值。在重组质粒MRP模板为40拷贝数/μL时仍能检测出荧光信号值;在重组质粒EF模板为60拷贝数/μL时仍能检测出荧光信号值,与一般常规PCR检测灵敏度104拷贝数/μL相比,敏感性大大提高,详见图4。
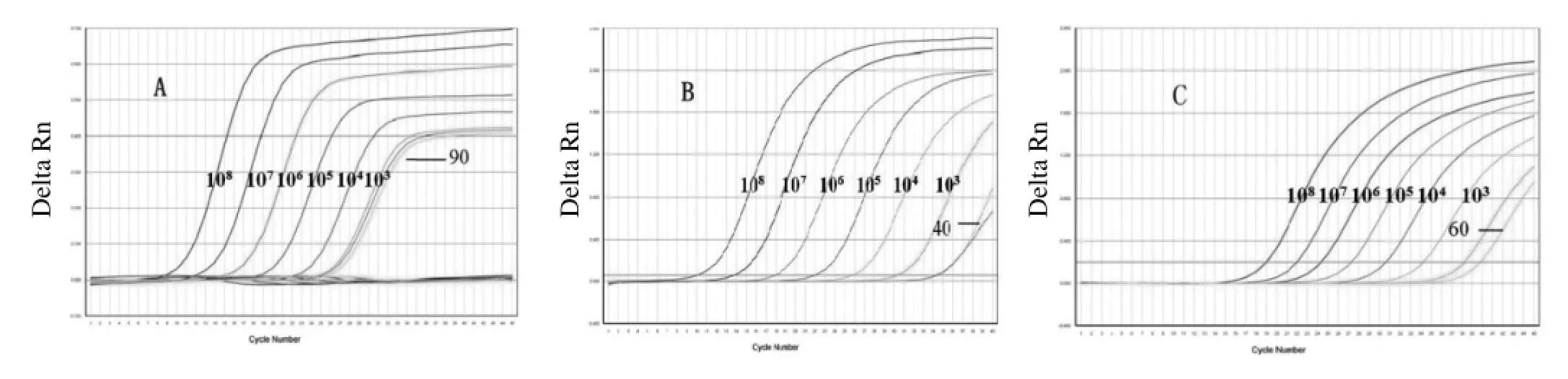
图4 三重荧光定量PCR检测的敏感性试验Fig.4 The sensitivity of of the triple Real-Time qPCR
2.5 三重荧光定量PCR检测猪链球菌2型的特异性该方法能够特异的检测出猪链球菌2型强毒菌株Ha9801的CPS2J、MRP、EF三毒力因子,弱毒株T15的CPS2J、MRP二毒力因子(图5)。用重组质粒标准品pMD18T-CPS2J、pMD18T-MRP、pMD18T-EF作为阳性对照,能分别检测出各自的扩增曲线,而无乳链球菌、化脓链球菌、猪链球菌1型、猪链球菌9型、马兽疫链球菌亚种在Ct值30以内均未出现扩增曲线(图6),判定为阴性,说明该检测方法具有良好的特异性。

图5 三重荧光定量PCR区分猪链球菌2型强弱毒株试验的扩增曲线Fig.5 The amplif cation curve of the triple Real-Time qPCR to distinguish the virulent, less-virulent and avirulent strains of S.suis2

图6 三重荧光定量PCR特异性扩增曲线Fig.6 The amplif cation curves of the triple Real-Time qPCR in specif city test
2.6 三重荧光定量PCR的重复性试验取108、107、106拷贝数/μL 3组不同浓度的标准品DNA,每组做3次重复检测。对结果进行统计学分析,计算每个稀释度Ct值和拷贝数的标准偏差(s)和变异系数(CV)。结果(表3)显示变异系数均小于3%,重复性较好。
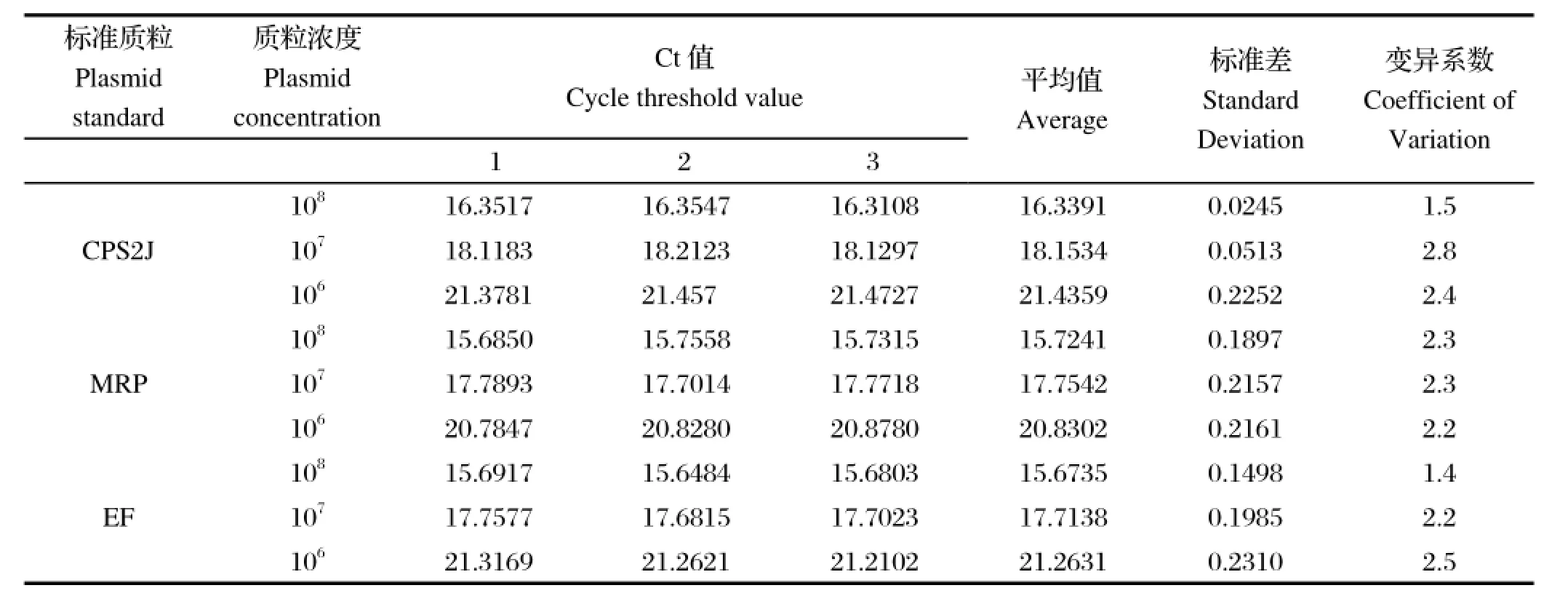
表3 三重实时荧光定量PCR重复试验结果Table3 The results of repeatability test for triple Real-time qPCR
3 讨论
猪链球菌是一种危害严重的条件性致病菌,亚临床的病原携带者是猪链球菌的主要传染源[6]。目前还没有证据证明可以人传人,人感染猪链球菌病是直接接触感染[7]。该病原对我国食品安全、畜牧业生产安全以及相关从业人员威胁巨大。加强对猪链球菌尤其是对猪链球菌2型的检测力度,对预防和控制猪链球菌病有重要的意义。实时荧光定量PCR不仅有常规PCR技术的扩增高效率的特点,还具有探针的高度特异性、光谱技术的高敏感性和精确性等特点[8],被广泛运用于医疗、药物研究、病原菌的检测等体外扩增技术[9,10]。整个反应过程是由仪器自动控制并进行结果分析,避免了后续电泳等步骤,减少了污染[11,12]。
猪链球菌菌株根据毒力因子的差异,可分为强毒力株、弱毒力株和无毒力株[13]。表现型MRP+EF+菌株强毒菌株能引起严重的临床症状,MRP+EF-弱毒株仅能引起轻微症状,MRP-EF-无毒株感染仔猪后则完全无毒力表现。本试验建立的Taqman法实时荧光定量PCR,通过对猪链球菌2型三个主要毒力因子基因CPS2J、MRP、EF的分析,设计了特异性的引物及相应的探针。优化反应体系后显示CPS2J、MRP和EF基因扩增效率基本同单重qPCR一致,而且三种荧光信号的收集均不存在互相干扰,可建立良好动力学扩增曲线及标准曲线。该方法具有特异性强、灵敏度高、重复性好、经济实惠、操作便捷等优点,在1 h内可完成猪链球菌2型CPS2J基因、MRP基因和EF基因的同时检测。本实验室初步将上述方法应用于猪链球菌的分离株毒力鉴定,结果发现与传统的鉴定方法结果一致,为进一步将三重荧光定量PCR检测方法应用于猪链球菌分离株毒力鉴定奠定基础。
[1] Brassard J, Gottschalk M, Quessy S. Cloning and purification of the Streptococcus suis serotype 2 glyceraldehyde-3-phosphate dehydrogenase and its involvement as an adhesion[J]. Vet Microbiol, 2004, 102(1-2): 87-94.
[2] Bartelink A K, van Kregten E. Streptococcus suis as threat to pig-farmers and abattoir workers[J]. Lancet, 1995, 346(8991-8992): 1707.
[3] 钟永庆. 猪链球菌病的鉴定及中草药体外抑菌试验[J].现代农业科技, 2010, (21): 339-342.
[4] 黄凤清, 邱英, 钟远宣, 等. 猪败血型链球菌病的发生及防治[J]. 现代农业科技, 2010, (13): 373-374.
[5] Vecht U, Wisselink H J, Jellema M L,et al.Identification of two proteins associated with virulence of Streptococcus suis type 2[J]. Infect Immun, 1991, 59(9): 3156-3162.
[6] 万遂如. 我国猪链球菌2型流行情况与人类健康[J]. 动物科学与动物医学, 2005, (4): 38-39.
[7] 刘伦光, 张丽杰, 雷凤英, 等. 人感染猪链球菌病屠宰过程危险因素病例对照调查[J]. 预防医学情报杂志, 2007, (5): 537-539.
[8] 周晓丽, 朱国坡, 李雪华, 等. 实时荧光定量PCR技术原理与应用[J]. 中国畜牧兽医, 2010, (2): 87-89.
[9] 周成江, 周立社, 吴刚, 等. 实时荧光定量PCR的研究进展及其应用[J]. 包头医学院学报, 2007, (2): 204-207.
[10] 韩熹, 朱莉莎, 姚建垣. 实时荧光定量PCR分析技术的应用[J]. 生命科学仪器, 2005, (2): 51-52.
[11] 陈旭, 齐凤坤, 康立功, 等. 实时荧光定量PCR技术研究进展及其应用[J]. 东北农业大学学报, 2010, (8): 148-155.
[12] 徐楠楠, 胡桂学. 实时荧光定量PCR技术的研究进展及应用[J]. 黑龙江畜牧兽医, 2011, (21): 24-27
[13] van Leengoed L A, Vecht U, Verheyen E R. Streptococcus suis type 2 infections in pigs in the Netherlands (Part two)[J]. Vet Q, 1987, 9(2): 111-117.
ESTABLISHMENT OF TRIPLE REAL-TIME QPCR FOR DETECTION OF VIRULENCE FACTORS OF STREPTOCOCCUS SUIS SEROTYPES 2
WANG Rong-rong1,2, SUN Wei-dong2, JIANG Wei1, LIU Ying-chun1, CHEN Yong-jun1, XUE Jun-xin1,2, ZHANG Meng1, WANG Quan1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Colledge of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China)
In this study, triple TaqMan real-time PCR assay was developed to simultaneously detect virulence genes CPS2J, MRP and EF ofStreptococcus suisserotype 2. Three pairs of specific primers and fluorogenic-labeled probes were designed and synthesized in accordance with the above target genes using software Primer Express 3.0. The 5′-ends of probes for CPS2J, MRP and EF were individually labeled with FAM, HEX and CY5 and their 3′-ends were all labeled with quencher BHQ1. The reaction system and procedures were optimized. The detection limits for purif ed recombinant plasmids of CPS2J, MRP and EF were 90, 40 and 60 copies/ μL, respectively. There was no cross reaction betweenStreptococcus suisserotype 2 and other pathogens. The variation coeff cient of the established method was less than 3%. The entire detection could be completed within 60 min. In conclusion, the triple TaqMan Real-time PCR assay developed in the present study was fast, sensitive, repeatable and specif c.
Streptococcus suisserotype 2; tripleTaqMan real-time qPCR; virulence factors
S852.616
A
1674-6422(2014)06-0025-07
2014-07-31
公益性行业(农业)科研专项(201303045)
王蓉蓉,女,硕士研究生,预防兽医学专业
王权, E-mail:wangquan@shvri.ac.cn
