六株鸽源新城疫病毒的分离、鉴定及生物信息学分析
2014-04-13李仕超仇旭升刘开春周锦萍鞠厚斌孙英杰宋翠萍刘佩红
李仕超,仇旭升,刘开春,周锦萍,刘 健,鞠厚斌,谭 磊,孙英杰,宋翠萍,刘佩红,丁 铲
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 上海市动物疫病预防控制中心,上海 201103)
·研究论文·
六株鸽源新城疫病毒的分离、鉴定及生物信息学分析
李仕超1,仇旭升1,刘开春1,周锦萍2,刘 健2,鞠厚斌2,谭 磊1,孙英杰1,宋翠萍1,刘佩红2,丁 铲1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 上海市动物疫病预防控制中心,上海 201103)
新城疫是严重危害世界养禽业的一种禽类传染病。近年来,鸽新城疫的流行越来越严重,引起了养殖户和兽医工作者的广泛关注。本研究在4批发病鸽组织病料中分离到了4株鸽源新城疫强毒株和2株鸽源弱毒株。病毒分离株经鸡胚有限稀释法纯化5次后,新鲜尿囊液用于提取病毒RNA。经RT-PCR扩增、测序得到分离株的F基因和HN基因序列。通过对F基因的遗传进化分析发现,4株鸽源强毒株属于ClassⅡ基因Ⅵb亚型,2株鸽源弱毒株与Class II基因II型疫苗株La Sota高度同源。进一步遗传进化分析结果显示,4株鸽源新城疫病毒强毒株与目前国内流行株属于同一遗传分支,这些毒株与欧洲流行株亲缘关系十分相近,而与中国20世纪90年代鸽源分离株遗传距离稍远,因此推测当前鸽源流行强毒株可能源自欧洲。生物信息学分析显示鸽源毒株HN蛋白345~353位的一个线性抗原表位发生了改变,而血清学实验显示La Sota疫苗株和鸽源毒株的交叉血凝抑制存在明显差异,暗示鸽源毒株已经发生了抗原性变异。因此,使用鸡疫苗株La Sota免疫鸽存在免疫失败的风险,需要研发鸽专用新城疫病毒疫苗用于鸽新城疫的防疫工作。
新城疫病毒;鸽源;基因型Ⅵb亚型;F基因;HN基因
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种急性、烈性、高度接触传染性禽类传染病,被世界动物卫生组织(OIE)列为必报传染病[1]。NDV主要感染禽类,感染率和死亡率可达100%[2]。NDV根据致病力差异,可分为弱毒株(lentogenic)、中等毒力株(mesogenic)和亲内脏型强毒株或嗜神经毒株(viscerotropic or neurotropic velogenic)三种类型。NDV只有一个血清型,根据基因遗传距离和基因组长度可以将NDV基因型分为ClassⅠ和ClassⅡ两个大类,前者包括基因1~9型,后者包括基因Ⅰ~Ⅺ型。NDV属于副黏病毒科(Paramyxoviridae)、副黏病毒亚科(Paramyxovirinae)、禽腮腺炎病毒属(Avuluvirus),是一种单股、负链、线性、不分节段的RNA病毒,编码NP、P、M、F、HN和L六种结构蛋白和V、W两种非结构蛋白。其中F蛋白和HN蛋白与NDV毒力密切相关。F蛋白是NDV感染细胞所必需的一种囊膜糖蛋白,能促进病毒囊膜与宿主细胞和相邻宿主细胞之间的融合,调节病毒的入侵和病毒粒子的释放[3]。HN蛋白也是位于NDV表面的一种囊膜糖蛋白,主要参与宿主细胞的吸附。F和HN蛋白是与NDV抗原性最为相关的两种病毒蛋白。
鸽新城疫,即鸽瘟,最早被称为鸽副黏病毒病,该病病原与鸡NDV在血清学上没有显著差异,两者基因序列同源性较高。引起鸽新城疫的NDV毒株一般属于ClassⅡ基因VI型或VII型。基因VII型NDV是目前鸡群中主要的流行毒株,而基因VI型NDV对鸡亦有很强的致病力。鸽感染新城疫的流行历史可以追溯至20世纪70年代,1977年在伊拉克被发现后开始迅速传播[4],1981年传播到埃及,并开始在意大利赛鸽和笑鸽(亦称塞内加尔鸽)中爆发[5]。鸽ND迅速在世界范围内传播,并传播给其他家禽,包括欧洲大部分地区,以色列、埃及、苏丹、印度、乌干达、南非、香港、日本、加拿大和北美养禽业遭受了巨大的损失。1984年英国的家禽中开始流行鸽NDV的变异株[6]。这也就是世界公认的第三次ND大流行[7]。
本研究分离鉴定了的6株鸽源NDV毒株,并设计引物扩增其F基因和HN基因序列。通过遗传进化分析,确定了分离株的基因型及其与当前鸽源流行株、疫苗株的亲缘关系。同时,本研究通过生物信息学软件分析了病毒蛋白抗原性、疏水性,结合血清学研究,比较了鸽源分离株与常用疫苗株的抗原差异性。
1 材料与方法
1.1 主要试剂SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;鸡抗La Sota高免血清、鸽抗La Sota血清及鸽抗ND167血清由本实验室制备;1%鸡红细胞、含青霉素和链霉素两种抗生素的PBS(简称双抗PBS)按照OIE标准制备;Trizol购自Invitrogen公司;反转录酶(M-MLV)、RNA酶抑制剂(RNasin)和pGEM-T easy Vector购自Promega公司;PCR mix购自东盛生物公司;胶回收试剂盒、质粒小提试剂盒及DH5α感受态细菌等购自天根生化科技(北京)有限公司。
1.2 病毒分离自山东省聊城市55周龄的发病蛋鸽采集脏器病料1份,上海养鸽场发病乳鸽病料3份。分离株鸡胚有限稀释法纯化5次,按照OIE常规方法进行HA效价检测和HI血清学鉴定。
1.3 交叉血凝抑制试验按照OIE常规方法分别配制La Sota、ZJ1、9a5b及鸽源分离毒株的4单位病毒。用鸡抗La Sota血清、鸽抗La Sota血清、鸽抗ND167血清3种血清对4单位病毒进行交叉血凝抑制效价的测定。其中鸽的两种血清分别用1%鸡红细胞处理(鸽血清与1%鸡红细胞混合,37℃作用10 min后离心取上清),处理前后分别测定对病毒的血凝抑制效价。
1.4 引物设计参照GenBank中基因Ⅵ型新城疫病毒IT-227/82毒株(GenBank登录号:AJ880277)设计3对引物:VI F4205和VI R5039、VI F5126和VI R7041、VI F6818和VI R8791,由上海生物工程有限公司合成。针对禽流感病毒(Avian influenza virus,AIV)HA、NP和NA基因的3对引物HA-F和HA-R、NP-F和NP-R、NA-F和NA-R由中国农业科学院上海兽医研究所禽流感实验室提供。引物序列见表1。

表1 扩增片段用引物序列Table 1 Primers sequence used in the amplifi cation
1.5 病毒基因扩增分离株通过鸡胚有限稀释法纯化5次后用于后续研究。
1.5.1 病毒RNA提取 取250 μL新鲜尿囊液,加入500 μL Trizol,混匀后室温静置10 min。加入200 μL氯仿、20 μg糖原,振荡混匀,14 000×g、4℃离心10 min。取400 μL上清,加入400 μL异丙醇,-20℃静置10 min后,14 000×g、4℃离心10 min。70%酒精漂洗2次,沉淀干燥后加入40 μL RNAse-free水溶解备用。
1.5.2 反转录 取32.5 μL病毒RNA,依次加入RNA酶抑制剂1 μL、5×反转录酶缓冲液10 μL、2.5 mmol/L dNTP mix 4 μL、6 nt随机引物1 μL、M-MLV反转录酶1 μL,37℃水浴2.5 h,70℃水浴作用灭活5 min。
1.5.3 PCR反应 将尿囊液提取的cDNA分别用NDV、AIV引物扩增。针对NDV F基因片段的鉴定引物为VIF4205和VIR5039;针对AIV HA、NP和NA基因的鉴定引物为HA-F和HA-R、NP-F和NP-R,NA-F和NA-R;扩增ClassⅡ基因VI型NDV-F和HN全基因的引物为VIF5126和VIR7041、VIF6818和VIR8791(引物序列在表1中列出)。PCR反应体系按照东盛公司PCR mix说明书进行。
1.5.4 基因克隆和测序 PCR产物在1%琼脂糖凝胶上电泳检查结果。利用天根普通琼脂糖凝胶DNA回收试剂盒提取PCR产物,将其连入pGEM-T easy Vector。按常规方法转化,蓝白斑筛选,提取质粒。酶切鉴定后,阳性质粒送上海生工公司测序。
1.6 遗传进化分析利用生物信息学软件Lasergene软件的MegAlign模块和MEGA软件比对分离株与GenBank中公布的NDV经典毒株基因序列同源性,并绘制遗传进化发生树。NDV主要参考毒株名称和登录号在表2中列出。

表2 系统发育树中参考的部分新城疫病毒全长序列的GenBank登录号Table 2 Accession number of the complete genome of NDV strains referred in the phylogenetic tree
1.7 抗原性分析利用生物信息学软件Lasergene软件的EditSeq模块根据测序结果预测NDV分离株F和HN蛋白氨基酸序列,并使用Protein模块对4株病毒的F蛋白和HN蛋白进行抗原性和疏水性分析。
2 结果
2.1 病毒分离情况采集鸽病料4份,按质量体积比1:5的比例加入无菌双抗PBS,研磨后离心,上清接种鸡胚。接种胚自48 h开始出现死亡,至84 h鸡胚无存活。通过鸡胚有限稀释法纯化5代,从中分离到6株病毒,分别命名为Pi/China/SD/2012/132株(标记为ND132)、Pi/China/SH/2013/163株(标记为ND163)、Pi/China/SH/2013/164株(标记为ND164)、Pi/China/SH/2013/167株(标记为ND167)、Pi/China/SH/2013/168株(标记为ND168)和Pi/China/SH/2013/169株(标记为ND169)。5代纯化后,6株病毒尿囊液的血凝价分别测定为25、26、29、26、26和29。
2.2 交叉血凝抑制试验结果利用La Sota和鸽源分离株的病原和血清进行交叉血凝抑制试验,测定交叉血凝抑制效价如表3,表中数据为3次试验测定的平均值。血清学试验结果显示鸽La Sota血清能够有效中和鸽源毒株的血凝反应,而鸽抗ND167血清不能够有效中和La Sota株的血凝反应。
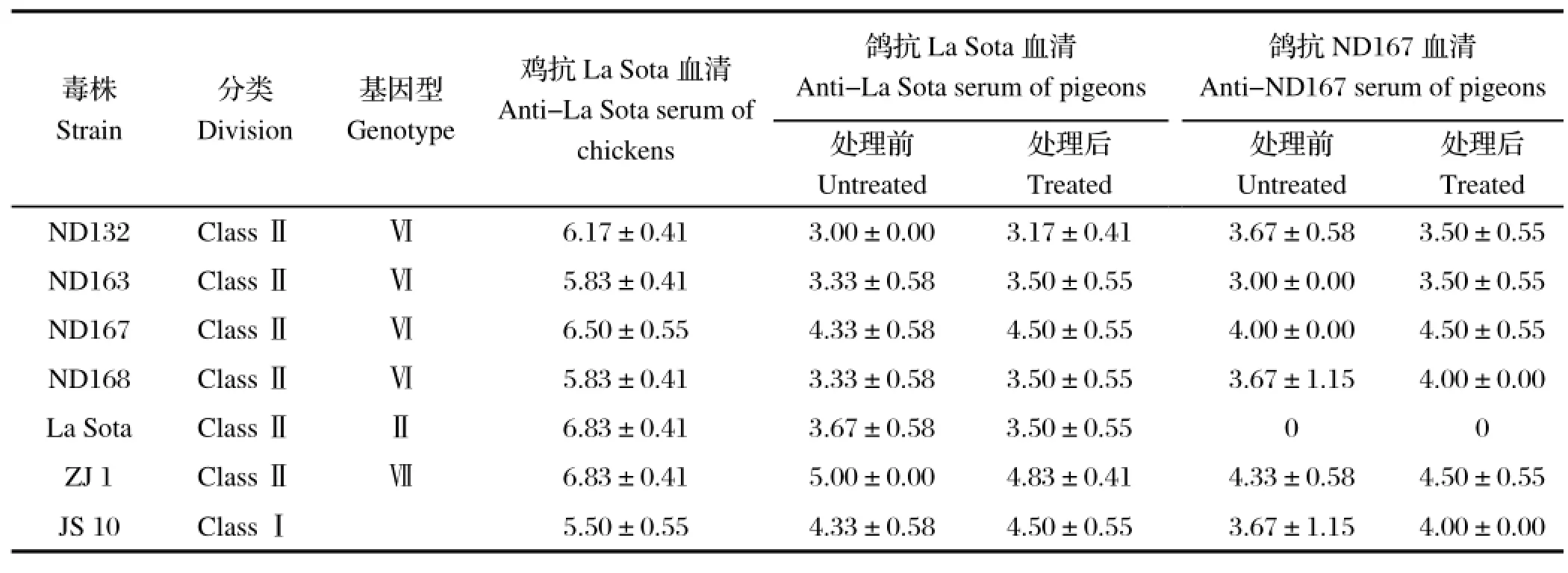
表3 两种血清对不同病毒的血凝抑制效价Table 3 Cross-hemagglutination inhibition titers of two serums for different strains
为了明确鸽源毒株与La Sota株之间的抗原性差异,根据公式R=计算病毒的抗原相似系数R值,其中r1=甲血清对乙抗原的血抑滴度/甲血清对甲抗原的血抑滴度;r2=乙血清对甲抗原的血抑滴度/乙血清对乙抗原的血抑滴度。R代表两病毒株间的抗原性差异,R<0.5表示抗原差异性大;0.5≤R<0.67表示病原抗原差异小;0.67≤R≤1.5表示无抗原性差异。计算得出鸽源分离株ND167与La Sota的病原相似系数R值为0.3,表明本研究分离到的鸽源毒株与La Sota株间存在明显的抗原性差异。
2.3 病毒基因扩增结果用NDV通用鉴定引物VIF4205/VIR5039扩增ND132、ND163、ND167和ND168四株病毒的F基因片段,扩增出800 bp左右目的条带(见图1);而用AIV的3组鉴定引物均不能扩增出相应目的片段。利用NDV F和HN基因扩增引物VIF4967/VIR7041和VIF6818/VIR8791也可扩增出预期大小的目的片段(图略)。分别回收PCR片段,将其连入pGEM-T easy Vector后质粒送生工测序。测序结果用Lasergene软件MegAlign模块进行拼接,获得完整的分离株F和HN基因序列。
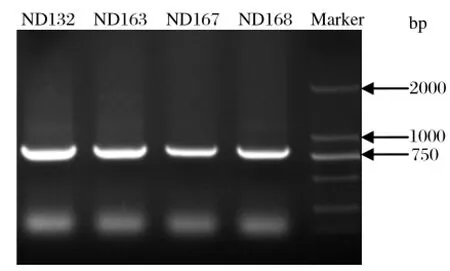
图1 引物VIF4205/VIR5039扩增ND132、ND163、ND167、ND168结果Fig.1 The electrophoresis result of ND132,ND163,ND167,ND168 amplifi ed by VIF4205 /VIR5039
2.4 遗传进化分析结果利用MEGA软件对获得的基因序列进行遗传进化分析,结果显示本研究中分离到的ND132、ND163、ND167、ND168均属于ClassⅡ类基因Ⅵb亚型,与国内目前流行毒株同源性较高(图2)。在ND163和ND168病料中,同时分离到2株弱毒NDV株,分别命名为ND164和ND169。测序结果显示这2株病毒与ClassⅡ基因Ⅱ型经典疫苗株La Sota F基因片段的同源性高达99.9%,推测为两家疫苗厂使用的La Sota活疫苗污染。

图2 根据ND132、ND163、ND167、ND168 F基因前163个氨基酸位点测序结果,采用MEGA软件构建遗传进化树Fig.2 Phylogenetic tree of NDV strain ND132,ND163,ND167 and ND168 using MEGA based on comparison of first 163 aa of F gene
用Lasergene软件预测获得鸽源NDV分离株F和HN蛋白氨基酸序列,与La Sota株序列比对后发现,3株上海株病毒蛋白的同源性均高于99.8%,而3株上海株与山东ND132同源性为95.1%~96.5%。4株鸽源VIb亚型分离株F蛋白裂解位点基序均为112 RRQKR F 117,即标准强毒裂解位点;HN长度均为1716 nt,编码571 aa,均符合强毒株的基因特征。
2.5 抗原性分析结果利用生物信息软件对4株分离株F蛋白和HN蛋白的抗原性和疏水性进行分析,结果发现,除少数几个位点呈现差异外,与经典La Sota的F蛋白和HN蛋白的抗原性和疏水性呈现整体一致性(图3为ND167与La Sota比较)。NDV HN蛋白345~353位的aa普遍存在一个线性抗原表位,单个氨基酸的突变会改变单抗对病毒的识别。本研究发现4株鸽源分离株在该位点存在2个突变:G347E和E349D,表明该抗原表位已经发生改变。而HN蛋白受体结合部位和NA活性位点氨基酸序列则没有发生突变,均为E401、R416、Y526和R174;6个保守潜在糖基化位点也没有发生变化,均为119、341、433、481、508和538位的aa。

图3 新城疫病毒ND167和La Sota株F和HN蛋白的抗原性与疏水性比较Fig .3 Comparison of the antigenicity and hydrophobicity of the F and HN protein between La Sota and ND167a: F蛋白抗原性; b: F蛋白疏水性; c: HN蛋白抗原性; d: HN蛋白疏水性a: Antigenicity of F; b: Hydrophobicity of F; c: Antigenicity of HN; d: Hydrophobicity of HN
3 讨论
新城疫是一种急性、烈性禽类传染病,对我国养禽业造成严重的经济损失。近年来,鸽中流行的新城疫也越来越受到重视。由于鸽活动范围广,其携带的传染病原严重威胁着养禽业的健康发展。鸽新城疫最早于1963年发现于德国,自1977年在中东地区发现后,迅速传播到欧洲、美国等地。20世纪80年代,在东欧的野鸽中报道了低致病性鸽源副粘病毒的爆发[5],随后这一病毒又传播到意大利[8]和东欧的野鸽及赛鸽[9]。1984年在英国感染鸽的排泄物引发22例鸡新城疫[10],至此,鸽新城疫对养禽业的威胁逐渐受到重视。2001年,加拿大有一场类似的鸽副粘病毒的爆发[11]。2010年法国和2011年瑞典相继在动物健康和兽医实验室机构(Animal Health and Vetevinary Laboratories Agency,AHVLA)报导了养禽业中鸽源新城疫的感染,并怀疑是由于野禽进入家禽中引起。澳洲的赛鸽和观赏鸽在2011年也分离到了首例鸽新城疫。目前为止,鸽新城疫在欧洲国家被认为是一种地方性流行病[12]。1985年,该病传播到亚洲[13-15]。自深圳及珠海检出鸽NDV后,南方沿海地区、江浙沪及山东省、北京市、黑龙江省等北方地区,乃至甘肃省、新疆维吾尔族自治区等地均有此病出现。近年来,我国鸽养殖量越来越大,养殖种类也越来越多,疫病的防控也因而显得更加重要。对鸽源NDV的分子流行病学研究,可为预测疾病的流行趋势和毒力进化提供数据支持,为疫病防控和研制有效疫苗、制定科学有效的防疫措施提供理论依据,对养禽业的健康发展具有重要意义。
遗传进化分析结果表明,分离的ND132、ND163、ND167、ND168 4个NDV毒株均属于ClassⅡ基因Ⅵb型。分离到的4株鸽源强毒株与目前国内分离到的鸽源NDV一样,均属于ClassⅡ基因Ⅵb亚型。刘华雷等[16]对北京市、江苏省分离到的5株鸽源NDV(包括)进行了遗传进化分析,结果也为Ⅵb亚型。2010~2012年在我国分离到的8株鸽Ⅰ型副粘病毒也属于Class Ⅱ基因Ⅵb亚型,其中pi/CH/LLN/110713(GenBank登录号:JX486552)是我国首次报导的分离自中国且与国外毒株相似的毒株,推测中国的鸽源副粘病毒可能源自海外[15]。Ⅵb亚型NDV对鸽子具有较强的宿主特异性。本研究分离得到的4株鸽源毒株与dove/Italy/2736/00毒株(GenBank登录号:AY562989)在一个分支上,亲缘关系十分相近,推测这4株鸽源强毒株可能是由赛鸽比赛等原因由欧洲传到中国。
分离到的ND163和ND168中混有基因Ⅱ型疫苗株La Sota,推测是由于鸽场长期对幼鸽使用La Sota活疫苗免疫对病料造成了污染。鸽场在使用La Sota免疫鸽子后,并没有起到有效的保护作用。因此,本研究集中研究了鸽Ⅵ型NDV与经典的La Sota毒株的基因和蛋白差异。3株上海株病毒蛋白的同源性均高于99.8%,与山东ND132同源性为95.1%~96.5%。4株病毒F蛋白112~117位蛋白酶裂解位点富含强碱性氨基酸,HN长度均为1716 nt,571 aa,符合强毒株的显著序列特征。鸽源毒株F蛋白和HN蛋白的抗原性和疏水性与经典La Sota弱毒株基本一致,而F和HN是决定病毒抗原性的主要蛋白,表明分离的鸽源NDV与鸡NDV抗原性整体差异不大。本研究发现4株鸽源NDV分离株与La Sota株主要的抗原差异位点在于HN蛋白的一个线性抗原表位345~353处的aa。4株鸽源分离株在该位点存在2个突变:G347E和E349D,单个氨基酸的突变会改变单抗对病毒的识别,表明该抗原表位已经发生了改变。
血清学试验显示La Sota疫苗株和鸽源毒株的交叉血凝抑制存在明显差异。抗La Sota鸽血清能够有效中和鸽源毒株的血凝反应,而抗鸽源毒株的血清却不能够有效中和La Sota株的血凝反应。抗原相似系数表明鸽源NDV强毒株与La Sota的抗原性差异显著,这与生物信息学分析的结果并不完全一致,暗示鸽源NDV毒株某些氨基酸位点的突变可能造成了抗原空间结构的改变,进而对抗原蛋白的空间表位造成了影响。因此,在实践中使用La Sota疫苗对鸽子进行免疫存在着免疫失败的风险,急需有针对性地研发鸽专用NDV疫苗,以促进我国养鸽业健康发展。
[1] Ballagi-Pordány A,Wehmann E,Herczeg J,et al. Identification and grouping of Newcastle disease virus strains by restriction site analysis of a region from the F gene [J]. Arch Virol,1996,141(2): 243-261.
[2] Miller P J,Decanini E L,Afonso C L,et al. Newcastle disease: evolution of genotypes and the related diagnostic challenges [J]. Infect Genet Evol,2010,10(1): 26-35.
[3] de Leeuw O S,Koch G,Hartog L,et al. Virulence of Newcastle disease virus is determined by the cleavage site of the fusion protein and by both the stem region and globular head of the haemagglutinin-neuraminidase protein [J]. J Gen Virol,2005,86(6): 1759-1769.
[4] Kaleta E F,Alexander D J,Russell P H,et al. The first isolation of the avian PMV-1 virus responsible for the current panzootic in pigeons ? [J]. Avian Pathol,1985,14(4): 553-557.
[5] Biancifiori F,Fioroni A. An occurrence of Newcastle disease in pigeons: virological and serological studies on the isolates [J]. Comp Immunol Microbiol Infect Dis,1983,6(3): 247-252.
[6] Alexander D J,Wilson G W,Russell P H,et al. Newcastle disease outbreaks in fowl in Great Britain during 1984 [J]. Vet Rec,1985,117(17): 429-434.
[7] Box P G,Holmes H C,McCartney E,et al. Vaccination of pigeons against paramyxovirus 1 infection [J]. Vet Rec,1985,117(21): 555-556.
[8] Terregino C G,Cattoli C G,Gorssele B,et al.Characterization of Newcastle disease virus isolates obtained from Eurasian collared doves (Streptopelia decaocto) in Italy [J]. Avian Pathol,2003,32(1): 63-68.
[9] Ujvári D E,Wehmann E,Kaleta E F,et al. Phylogenetic analysis reveals extensive evolution of avian paramyxovirus type 1 strains of pigeons (Columba livia) and suggests multiple species transmission [J]. Virus Res,2003,96(1-2): 63-73.
[10] Aldous E W,Feller C M,Mynn J K,et al. A molecular epidemiological investigation of isolates of the variant avian paramyxovirus type 1 virus (PPMV-1) responsible for the 1978 to present panzootic in pigeons [J]. Avian Pathol,2004,33(1-2): 258-269.
[11] Toro H F,Hoerr J,Farmer K,et al. Avian paramyxovirus: association with common avian pathogens in chickens and serologic survey in wild birds [J]. Avian Dis,2005,49(1): 92-98.
[12] Alexander D J. Newcastle disease in the European Union 2000 to 2009 [J]. Avian Pathol,2011,40(6): 547-558.
[13] Lister S A,Alexander D J,Hogg R A,et al. Evidence for the presence of avian paramyxovirus type 1 in feral pigeons in England and Wales [J]. Vet Rec,1986,118(17): 476-479.
[14] Alexander D J,Parsos G,Marshall R,et al. Infection of fowls with Newcastle Disease virus by food contaminated with pigeon faces [J]. Vet Rec,1984,115(23): 601-602.
[15] Guo H,Liu X,Han Z,et al. Phylogenetic analysis and comparison of eight strains of pigeon paramyxovirus type 1 (PPMV-1) isolated in China between 2010 and 2012 [J]. Arch Virol,2013,158(6): 1121-1131.
[16] 刘华雷,周斌,郁斌,等. 五株鸽副粘病毒国内分离株F基因片段的克隆与分子特性[J]. 病毒学报,2004,20(4): 378-381.
ISOLATION,IDENTIFICATION AND BIOINFORMATICS ANALYSIS OF SIX NEWCASTLE DISEASE VIRUSES OF PIGEON ORIGIN
LI Shi-chao1,QIU Xu-sheng1,LIU Kai-chun1,ZHOU Jin-ping2,LIU Jian2,JU Hou-bin2,TAN Lei1,SUN Ying-jie1,SONG Cui-ping1,LIU Pei-hong2,DING Chan1
(1.Shanghai Veterinary Research Institute,CAAS,Shanghai 200241,China; 2.Shanghai Animal Disease Control Center,Shanghai 201103,China)
Newcastle disease is a severe infectious disease in birds,threatening poultry industry worldwide. Pigeons are very susceptible to Newcastle disease virus (NDV) infection,which causes high morbidity and mortality. In this study,six NDV strains were isolated from the pigeon tissue samples,four of which were highly virulent and two were low virulent. These pigeon viruses were cloned 5 times in embroynated SPF chicken eggs via limited dilution method. The fresh allantoic fl uids were collected for RNA extraction. The resulting RNA samples were converted to cDNAs followed by PCR amplification and sequencing of F and HN genes. Phylogenetic analysis based on F gene sequences showed that four highly virulent strains belonged to Class Ⅱ Ⅵb subgenotype and two low virulent strains were similar to La Sota and belonged to Class Ⅱ genotype Ⅱ. In addition,four highly virulent strains were more closely related to the strain isolated in Italy a few years ago than those strains obtained in China in 1990’s. Therefore,these virulent pigeon strains currentlyprevailing in China might originate from Europe. Bioinformatics analysis revealed that a linear epitope consisting of amino acids 345-353 on HN protein of these pigeon strains changed as compared with the classic vaccine strain La Sota. In addition,hemagglutination inhibition revealed a noticeable difference between these pigeon strains and La Sota. The results support that chicken vaccine strains do not effectively protect pigeons from NDV infection thus the vaccines designed for pigeon use are much needed.
Newcastle disease virus; pigeon; genotype Ⅵb; F gene; HN gene
S852.659.5
A
1674-6422(2014)05-0001-09
2014-02-17
863计划(2011AA10A209);公益性行业(农业)科研专项经费(201303033,201003012);中央级公益性科研院所基本科研业务费专项资金项目(2013JB03)
李仕超,女,硕士研究生,预防兽医学专业
丁铲,E-mail:shoveldeen@shvri.ac.cn
