不同免疫方式对仔猪免疫高致病性猪繁殖与呼吸综合征、猪瘟、猪口蹄疫三种疫苗抗体水平的影响
2014-04-13张步娴屈素洁莫胜兰粟艳琼陆文俊施开创
胡 杰,张步娴,屈素洁,莫胜兰,粟艳琼,陆文俊,施开创,李 军
(广西动物疫病预防控制中心,南宁 530001)
·简报·
不同免疫方式对仔猪免疫高致病性猪繁殖与呼吸综合征、猪瘟、猪口蹄疫三种疫苗抗体水平的影响
胡 杰,张步娴,屈素洁,莫胜兰,粟艳琼,陆文俊,施开创,李 军
(广西动物疫病预防控制中心,南宁 530001)
采用不同的免疫方式,对38头36~38日龄健康仔猪进行高致病性猪繁殖与呼吸综合征、猪瘟、猪口蹄疫3种疫苗进行免疫,分别于免疫前(0 d)和免疫后15、30、45、60、90 d采血进行这3种疫病抗体检测。结果发现效果最好的方法是先免疫猪瘟和口蹄疫疫苗14 d后再免疫高致病性猪繁殖与呼吸综合征疫苗;其次是猪瘟疫苗和高致病性猪繁殖与呼吸综合征疫苗分别释稀后混合为1针,口蹄疫疫苗另作1针同时分点注射;免疫效果最差的是高致病性猪繁殖与呼吸综合征、猪瘟、猪口蹄疫3种疫苗同时分3点注射。
免疫程序;高致病性猪繁殖与呼吸综合征;猪瘟;猪口蹄疫;抗体
猪瘟、口蹄疫、高致病性猪繁殖与呼吸综合征是近年来危害我国养猪业的三大主要动物疫病,被国际动物卫生组织列为A类动物疫病,我国将其都列为一类动物疫病。长期以来,由于引种、饲养管理、防疫等方面不规范,许多猪场不同程度出现死胎、仔猪增重慢、繁殖障碍等问题,严重制约养猪业发展。通过调查发现,免疫方式不合理是其中一个主要原因。在免疫过程中出现免疫副作用大,随意制定免疫方法,或是根据国家的春秋两防固定时间免疫等给猪场造成不应有的损失。任宇斓等[1]用3种疫苗不同组合同时分点免疫,发现3种疫苗任意组合对高致病性猪繁殖与呼吸综合征抗体阳性率基本没有变化,但对猪瘟和口蹄疫效价有一定影响。张长龙等[2]采用先免疫接种猪瘟疫苗,1周后免疫接种口蹄疫和高致病性猪繁殖与呼吸综合征疫苗,认为二者有明显的协同促进作用,而3种疫苗同时分点注射免疫相互之间干扰较大,猪瘟病毒抗体产生时问推迟,不宜推广使用。陶得和等[3]对高致病性猪繁殖与呼吸综合征、猪瘟、口蹄疫疫苗同时免疫进行试验,认为不同免疫时间对猪瘟抗体和高致病性猪繁殖与呼吸综合征抗体没有影响,但对口蹄疫抗体有影响,即3种疫苗同时免疫效果优于其他两种疫苗分别组合;文萍萍等[4]进行了猪瘟脾淋苗、猪O型口蹄疫和猪繁殖与呼吸综合征灭活苗两两联合应用的免疫效果进行了观察,发现猪瘟和猪口蹄疫疫苗同时免疫效果较好,猪口蹄疫和高致病性猪繁殖与呼吸综合征疫苗同时免疫效果较差,猪瘟疫苗和高致病性猪繁殖与呼吸综合征疫苗同时免疫效果不明显。以上说法差异较大,到底哪种方式最合理,没有可比性。根据国家对这三大类疫病的强制免疫的要求,从节约人力、物力、时间,最佳防控效果等多方面考虑,本研究结合广西当前猪场3种疫苗的种类以及常见的几种免疫方式,制定了不同的免疫方案进行跟踪调查,力求找到最佳免疫方式,为当地养殖企业和村级防治员的免疫防控工作提供理论依据。
1 材料与方法
1.1 材料
1.1.1 疫苗 口蹄疫O型灭活疫苗(OMYA98/BY/2010株)购于中农威特生物科技股份有限公司,批号H120539J;政府采购细胞源猪瘟疫苗购于南京天邦生物科技有限公司,批号:129107;高致病性猪繁殖与呼吸综合征活疫苗(TJM-F92株)购于山西隆克尔生物股份有限公司,批号:3212012。
1.1.2 实验猪 选择36~38日龄临床健康,未免疫仔猪,经采血检测猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪口蹄疫病毒(Foot and mouth disease virus,FMDV)、猪瘟病毒(Classical swine fever virus,CSFV)抗体全部呈阴性的38头仔猪做试验。
1.1.3 检测试剂 猪瘟正向间接血凝诊断抗原购自于兰州兽医研究所,批号:20121014;猪O型口蹄疫正向间接血凝诊断抗原购自于兰州兽医研究所,批号:20121014;猪繁殖与呼吸综合征ELISA抗体检测试剂盒由北京天之泰生物有限公司提供,由法国LSI公司生产,批号:5-VETPRA-030。
1.1.4 主要仪器 酶标仪为奥地利Sunrise公司生产;单道微量加样器10~100 μL、多道微量加样器5~50 μL由德国Tranferspette公司生产。
1.2 方法
1.2.1 免疫分组及免疫方法 将38头实验猪随机分成4组。对照组(8头猪):简称“两针两苗组”,使用口蹄疫O型灭活疫苗和细胞源猪瘟疫苗同时分点免疫注射,每头猪注射1 mL(头份),不免疫高致病性猪繁殖与呼吸综合征弱毒疫苗。试验1组(10头猪):简称“两针三苗组”,将猪瘟疫苗和高致病性猪繁殖与呼吸综合征弱毒疫苗分别释稀后混合为1针,口蹄疫O型灭活疫苗作为1针,免疫剂量为1 mL(头份)/头。试验2组(10头猪):简称“三针三苗同组”,使用口蹄疫O型灭活疫苗、细胞源猪瘟疫苗和高致病性猪繁殖与呼吸综合征弱毒疫苗同时分点免疫注射,每头猪注射1 mL(头份)。试验3组(10头猪):简称“三针三苗间组”,先用口蹄疫O型灭活疫苗和政府采购专用细胞源猪瘟疫苗同时分点免疫注射,间隔14 d后,再用高致病性猪繁殖与呼吸综合征弱毒疫苗免疫1次,免疫剂量为1 mL(头份)/头。所有猪在免疫前(0 d)及免疫后的15、30、45、60、90 d分别经前腔静脉采血,分离血清,并于-20℃保存备检。
1.2.2 检测方法 高致病性猪繁殖与呼吸综合征抗体采用ELISA方法检测,具体操作按试剂盒说明书操作;判断标准:IRPC≤20,被检血清高致病性猪繁殖与呼吸综合征抗体阴性,IRPC>20,被检血清高致病性猪繁殖与呼吸综合征抗体阳性。猪瘟和口蹄疫抗体检测均采用正向间接血凝试验检测,判断标准:抗体效价≥1:32,判定被检血清抗体阳性,抗体效价<1:32,判定被检血清抗体阴性。
1.2.3 数据处理及分析方法 利用SPSS软件进行统计学方差分析和变异系数分析。
2 结果与讨论
2.1 免疫后不同时间CSFV、FMDV及HP-PRRSV抗体阳性率从图1A中可以看出,4个组在免疫后,猪瘟病毒抗体迅速上升,对照组和试验3组在免疫后15 d即达到70%以上阳性率,试验1组和2组在免疫后30 d才达到70%以上阳性率;免疫后90 d,试验1和2组已下降到70%以下,分别是50%和60%,对照组CSFV阳性率仍有87.5%,而试验3组抗体阳性率仍保持90%抗体阳性率;3个试验组中试验3组抗体阳性率虽然比试验1和2组产生慢,持续时间却最长,说明试验3组免疫效果优于对照组和试验1、2组。对照组抗体持续时间比试验1组和2组长,说明在3种不同免疫方式中,HP-PRRS疫苗可能会影响与其同时免疫的猪瘟疫苗的效果。

图1 免疫后不同时间CSFV、FMDV和PRRSV抗体阳性率变化规律Fig.1 The postive rates of CSFV,FMDV and PRRSV antibody at different time post vaccination
从图1B看,4个组在免疫FMD疫苗后15 d均达到70 %以上其抗体阳性率,一直持续到免疫45 d,4组差异都不明显,到免疫后60 d逐渐分化,而到免疫后90 d,只有对照组仍保持在70%以上抗体合格率,其余3个试验组均已下降到70%以下抗体阳性率,并且3个试验组抗体阳性率和持续时间均低于对照组,提示HP-PRRS疫苗可能会影响与其同时免疫的FMD效果。而在3个试验组中试验3组抗体持续期和阳性率稍高于试验1组、2组。
从图1C看,在免疫HP-PRRS疫苗前其抗体均为阴性,3个试验组在免疫后15 d抗体合格率逐步提高,30 d全部达到70%以上阳性率,并且到免疫后90 d,所有组抗体合格率仍保持在70%以上。试验3组的阳性率均稍高于试验1组、2组,抗体阳性率从高到低依次是试验3组、试验1组和试验2组。表明试验3组的免疫方法优于试验1组、试验2组。
2.2 免疫后不同时间CSFV抗体和FMDV抗体上升速度变化从图2A看,免疫后15 d 4个组猪瘟病毒抗体均开始上升,但对照组和试验3组上升速度较快,免疫后30 d开始对照组、试验1组抗体上升速度加快,45 d时对照组、试验1组抗体又迅速下降,而试验3组却还在上升,一直延续到60 d,60 d以后所有组CSFV抗体上升速度均减慢。各组平均上升速度从高到低依次为对照组>试验3组>试验1组>试验2组,平均上升值分别为2.37 log2,2.14 log2,1.49 log2和1.38 log2。从抗体提升速度看,对照组高于试验3组,提示HP-PRRS疫苗可能会影响与其同时免疫的猪瘟疫苗免疫效果。这一结果陶得和等[3]研究结果有一定差异,后者认为不同免疫方法对猪瘟抗体产生时间和水平无明显影响。

图2 免疫后不同时间CSFV和FMDV抗体上升速度变化规律Fig.2 The increasing rates of antibodies of CSFV,FMDV at different time post vaccination
从图2B看,免疫后15 d 4个组口蹄疫病毒抗体均上升速度较快,一直持续到45 d左右,又开始迅速下降。免疫后90 d时试验1组和试验2组又回到免疫前状况。4个组抗体上升速度从高到低依次为对照组>试验1组>试验3组>试验2组,平均提升值分别为2.25 log2,1.92 log2,1.88 log2和1.36 log2。从抗体提升速度看,提示HP-PRRS疫苗可能会影响与其同时免疫的FMD疫苗免疫效果。
CSFV、FMDV、PRRSV通过不同方式免疫仔猪后,不同时间所测抗体阳性率见表1。
2.3 方差分析、变异系数分析结果方差分析显示在免疫后30、45 d时各组CSFV抗体之间差异具有极显著统计学意义(P<0.01),60 d各组之间差异具有显著统计学意义(P<0.05),其余时间节点(0、15、90 d)各组之间差异不具有显著统计学意义(P>0.05)。免疫后45 d试验3组与试验1组之间差异具有显著统计学意义(P<0.05)(见表2、3),但试验2组和试验3组之间差异不具有显著统计学意义(P>0.05)。免疫后0~15d时各组差异还不显著,30~45 d时差异具有极显著统计学意义(P<0.01),60 d差异具有显著统计学意义(P<0.05),到90 d时差异不具有显著统计学意义(P>0.05),组间差异符合正态分布的规律,其中试验3组与试验1组之间差异显著(P<0.05),但试验2和试验3组之间差异不具有显著统计学意义(P>0.05),表明试验3组的免疫方法优于试验1组、试验2组。口蹄疫抗体各组之间在所有免疫期间差异均不具有显著统计学意义(P>0.05)。
从变异系数看(见表2、3),CSFV体的4个组从低到高依次是对照组<试验3组<试验1组<试验2组。对照组高于3个试验组,提示HP-PRRS疫苗可能会影响与其同时免疫的CSF疫苗免疫效果。FMDV抗体离散度最低,从低到高依次是试验1组<试验3组<对照组<试验2组。
2.4 在实际生产中,猪群群体免疫要达到70%以上阳性率才达到免疫合格。变异系数越小,群体抗体均衡度越高;离散度越小,疫苗免疫的效果也越好;免疫持续期越长,疫苗免疫应答也越好。综合多方面因素,试验3组在免疫抗体阳性率、免疫持续期、离散度、免疫应答多方面均优于试验1组、试验2组,试验1组又优于试验2组,即最好的免疫方式是先免疫CSF和FMD疫苗14 d后再免疫HP-PRRS疫苗;其次是CSF疫苗和HP-PRRS疫苗分别释稀后混合为1针,口蹄疫疫苗另作1针同时分点注射;免疫效果最差的是HP-PRRS、CSF、FMD 3种疫苗3种疫苗同时分3点注射,但3种疫苗不同方式免疫时,HP-PRRS疫苗可能会影响与其同时免疫的CSF疫苗和FMD疫苗的免疫效果,这一结果与张长龙等[1]一致,与任宇斓等[2]结论存在差异,但由于所用疫苗不同,无法同时比较,而CSF、FMD疫苗单独免疫效果也较好,与文萍萍等[4]结果一致。

表1 不同免疫方式猪瘟病毒、口蹄疫病毒和猪繁殖与呼吸综合征病毒抗体阳性率汇总Table 1 Summary of the positive rates of CSFV,FMDV and PRRSV antibody in different vaccination protocol

表2 猪瘟病毒抗体检测结果Table 2 The detection results of CSFV antibody levels
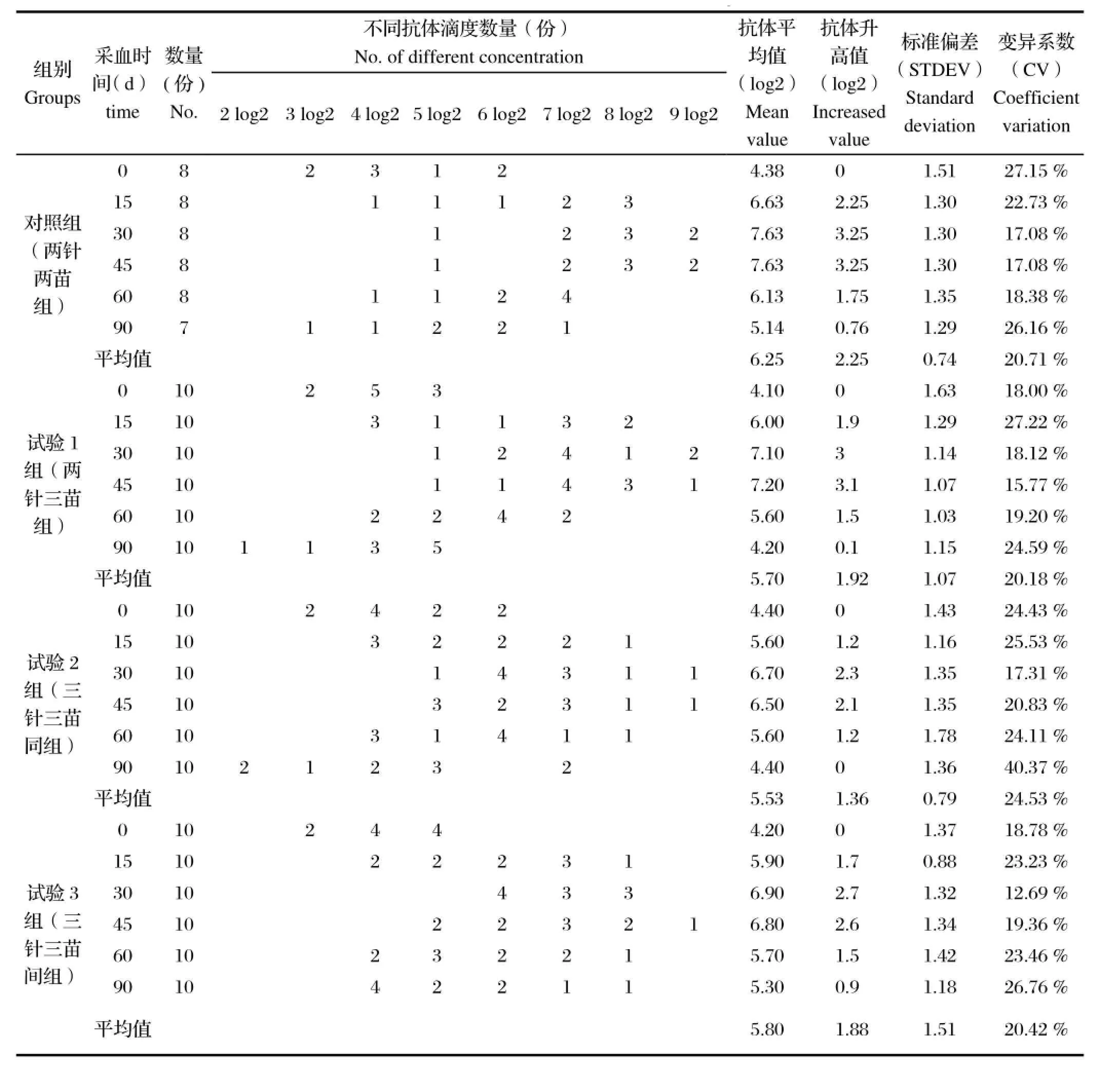
表3 猪口蹄疫病毒抗体检测结果Table 3 The detection results of FMDV antibody levels
[1] 张长龙,严宝英,贾文孝,等. 猪瘟、猪口蹄疫、高致病性猪繁殖与呼吸综合征疫苗有效免疫试验初探[J]. 动物医学进展,2009,30(7): 101-103.
[2] 任宇斓,于厚军,蒋文生,等. 猪口蹄疫、猪瘟、高致病性猪繁殖与呼吸综合征三种疫苗不同组合同时分点免疫效果观察与分析[J]. 中国动物检疫,2011,28(5): 67-71.
[3] 陶得和,漆晶晶,白文丽,等. 高致病性蓝耳病疫苗、猪瘟、口蹄疫疫苗同时免疫试验报告[J]. 河南畜牧兽医,2010,31(6): 6-8.
[4] 文萍萍,陈代平,李金海,等. 猪瘟脾淋苗、猪O型口蹄疫和猪繁殖与呼吸综合征灭活苗两两联合应用的免疫效果观察[J]. 四川畜牧兽医,2010,231(1): 21-22,24.
EFFECT OF DIFFERENT VACCINATION PROTOCOLS ON ANTIBODY LEVELS OF HIGHLY PATHOGENIC PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME,CLASSICAL SWINE FEVER AND FOOT AND MOUTH DISEASE VACCINES IN PIGLETS
HU Jie,ZHANG Bu-xian,QU Su-jie,MO Sheng-lan,SU Yan-qiong,LU Wen-jun,SHI Kai-chuang,LI Jun
(Guangxi Animal Disease Prevention and Control Center,Nanning 530001,China)
Different vaccination protocols were taken to vaccinate thirty-eight 36-38-day-old healthy piglets with highly pathogenic porcine reproductive and respiratory syndrome (HP-PRRS),classical swine fever (CSF) and foot and mouth disease (FMD) vaccines,respectively. The antibody levels of CSFV,FMDV and PRRSV were tested on day 0,15,30,45,60 and 90 post vaccination. The highest antibody levels were detected when CSF and FMD vaccines were used fi rst followed by HP-PRRS vaccine 14 days later. The second choice was that CSF and HP-PRRS vaccines were mixed in one shot on one side of piglets and at the same time FMD vaccine was used on other side. The lowest antibody levels were detected when HP-PRRS,FMD and CSF vaccines were injected at the same time at three separate shots.
Vaccination protocol; highly pathogenic porcine reproductive and respiratory syndrome (HP-PRRS); classical swine fever (CSF); foot and mouth disease (FMD); antibody
S852.659.6
B
1674-6422(2014)05-0061-07
2014-03-07
广西自然科学基金项目(桂科青0832057);广西水产畜牧科技资助项目(桂渔牧科1304559)
胡杰,女,博士,主要从事动物传染病工作
施开创,E-mail:shiraichuang@126.com
