1型鸭甲肝病毒LY0801株VP1基因在鸭胚传代中的变异规律研究
2014-04-13马明杰郭翠平焦玉祥吕佳泓张瑞华陈君豪谢之景姜世金
马明杰,郭翠平,焦玉祥,吕佳泓,孙 振,张瑞华,陈君豪,谢之景,姜世金
(山东农业大学动物医学院 山东省动物生物工程与疾病防治重点实验室,泰安 271018)
1型鸭甲肝病毒LY0801株VP1基因在鸭胚传代中的变异规律研究
马明杰,郭翠平,焦玉祥,吕佳泓,孙 振,张瑞华,陈君豪,谢之景,姜世金
(山东农业大学动物医学院 山东省动物生物工程与疾病防治重点实验室,泰安 271018)
为了解1型鸭甲肝病毒(Duck hepatitis A virus type 1)VP1基因在鸭胚传代中的变异规律,本研究将LY0801株DHAV-1在鸭胚体内传代至30代,分别对1~5、10、15、20、25、30代病毒进行VP1基因的克隆测序。各代次病毒分别以108copies/胚接种9日龄健康鸭胚,测定各组鸭胚的平均死亡时间和病毒在鸭胚尿囊液中的增殖拷贝数。结果表明:DHAV-1在鸭胚传代过程中,不同代次之间出现12个氨基酸的反复变异和同步变异,分别为R43M(K)、T48A、T101S、L169F、T180I、S181L、R183Q、E184A(K)、G187D、D193N、M213R、H219Y;在传代过程中,病毒致死鸭胚的时间逐渐延迟,但病毒在鸭胚内的增殖拷贝数未呈现稳定增长的趋势。
1型鸭甲肝病毒;VP1;变异;致弱
鸭病毒性肝炎(duck viral hepatitis,DVH)是一种由鸭肝炎病毒(Duck hepatitis virus,DHV)感染导致的急性和高度致死性传染病,可引起3周龄以下的雏鸭发生急性肝炎,病死率高,是严重危害养鸭业的疫病之一[1]。DHV包括鸭甲肝病毒(duck hepatitis A virus,DHAV)和鸭星状病毒(duck astrovirus,DAstV)。2009年,国际病毒分类委员第十次病毒分类报告将DHAV归类为小RNA病毒科、禽肝病毒属,目前为该属唯一成员[2,3]。DHAV可分为A、B和C三个基因型,因为相互之间的交叉保护力很差,所以三个基因型分别对应于三个血清型,即DHAV-1、DHAV-2和DHAV-3[4,5]。其中,DHAV-1和DHAV-3是我国的主要流行血清型[6,7]。
DHAV-1病毒基因组为长度约7690 nt的单股正链RNA,由5′UTR、ORF、3′UTR和Poly-A尾巴组成[8]。基因组中的ORF编码一个多聚蛋白(polyprotein),最终被切割成12 个成熟产物[9]。在小RNA 病毒中,结构蛋白VP0、VP3 和VP1 位于病毒壳体的表面,参与病毒抗原位点的形成,其中VP1 蛋白作为主要的宿主保护蛋白,编码主要的抗原位点并具有主要的型特异性中和位点,是决定病毒抗原性的主要成分[10,11]。
尽管针对鸭肝炎的诊断和防治已经做了大量卓有成效的工作,但是在实际生产中该病仍然时有爆发,给养鸭业带来严重危害[12]。有研究认为这可能与病毒在免疫压力和外界环境因素的影响下发生的部分抗原变异有一定关系[13-15]。研究表明,DHAV-1经鸭胚传代后,出现毒力致弱的现象[16]。甘一迪等[17]通过对3株DHAV-1 VP1基因的克隆测序发现,强毒株的第49和183位氨基酸分别为T和H,而弱毒株对应为S和Q。但是以上对DHAV-1的变异规律的研究仅仅是根据从病鸭收集到的流行毒株来进行比较研究的,由于这些病毒之间的系谱关系不清楚,因此很难准确阐明VP1具体变异的规律。本研究在鸭胚上对病毒进行传代试验,通过对VP1基因的克隆测序及毒力的测定,以期为深入了解DHAV-1的遗传变异规律提供依据。
1 材料和方法
1.1 病毒本试验所用传代毒株DHAV-1 LY0801为山东农业大学动物分子病原学实验室分离鉴定并保存,经鉴定为强毒株,已完成全基因组序列的测定,GenBank登录号:FJ436047。
1.2 主要仪器和试剂PCR相关试剂、克隆载体pMD18-T、限制性内切酶BamHⅠ、Hind Ⅲ均购自TaKaRa 公司;病毒RNA 提取Trizol购自北京博大泰克生物公司;RNA反转录试剂盒购自Fermentas公司;胶纯化回收试剂盒、质粒提取试剂盒购自OMEGA BIO-TEK公司;GoldStar Taqman One-Step RT-qPCRKit购自北京康为世纪生物科技有限公司;其他化学试剂均为进口或国产分析纯。
1.3 引物合成参考GenBank收录的DHAV-1的全基因组序列,设计扩增DHAV-1的VP1基因的引物,FVP1:5′- GGCATGTTGTCAATCGACTCAC TG-3′;RVP1:5′- GTCTCAACCTGATGAACCAT TGTAACTGG-3′。引物由上海生工生物工程技术服务有限公司合成。
1.4 DHAV-1 LY0801在鸭胚上的传代无菌采集LY0801攻毒后的病死鸭肝脏,加灭菌生理盐水,研磨,反复冻融3次,5000×g离心10 min,取上清用0.22 μm的一次性滤器过滤,加青霉素、链霉素(终浓度均为2000 IU/mL),37℃作用30 min左右。取无DVAH-1母源抗体的9日龄健康鸭胚,经尿囊腔途径接种鸭胚,接种量为0.2 mL/胚。鸭胚接种后继续孵化,收获24~96 h 死亡胚尿囊液,对应接入下一批健康鸭胚,依此连续传代30代,每隔5代对病毒进行VP1基因序列测定。
1.5 各代VP1基因的测序与分析按病毒RNA提取试剂盒Trizol说明书从尿囊液中提取病毒总RNA。利用引物列表中下游引物分别进行反转录扩增,反应总体积20 μL,置于42℃ 60 min,72℃保温15min。然后以反转录产物作为模板进行PCR反应,扩增条件:95℃ 5 min;95℃ 50 s,58℃ 50 s,72℃ 1 min 10 s,共32个循环;最后72℃延伸10 min,4℃保存。取PCR扩增产物进行琼脂糖凝胶电泳,于凝胶成像系统中观察并记录结果。PCR扩增阳性产物进行回收,并与pMD18-T载体连接,连接产物转化至DH5α感受态细胞,阳性克隆送上海生工生物工程技术服务有限公司进行DNA序列测序,每个代次测至少5个克隆,并与GenBank收录的部分参考毒株进行序列比对与分析,参考毒株见表1。
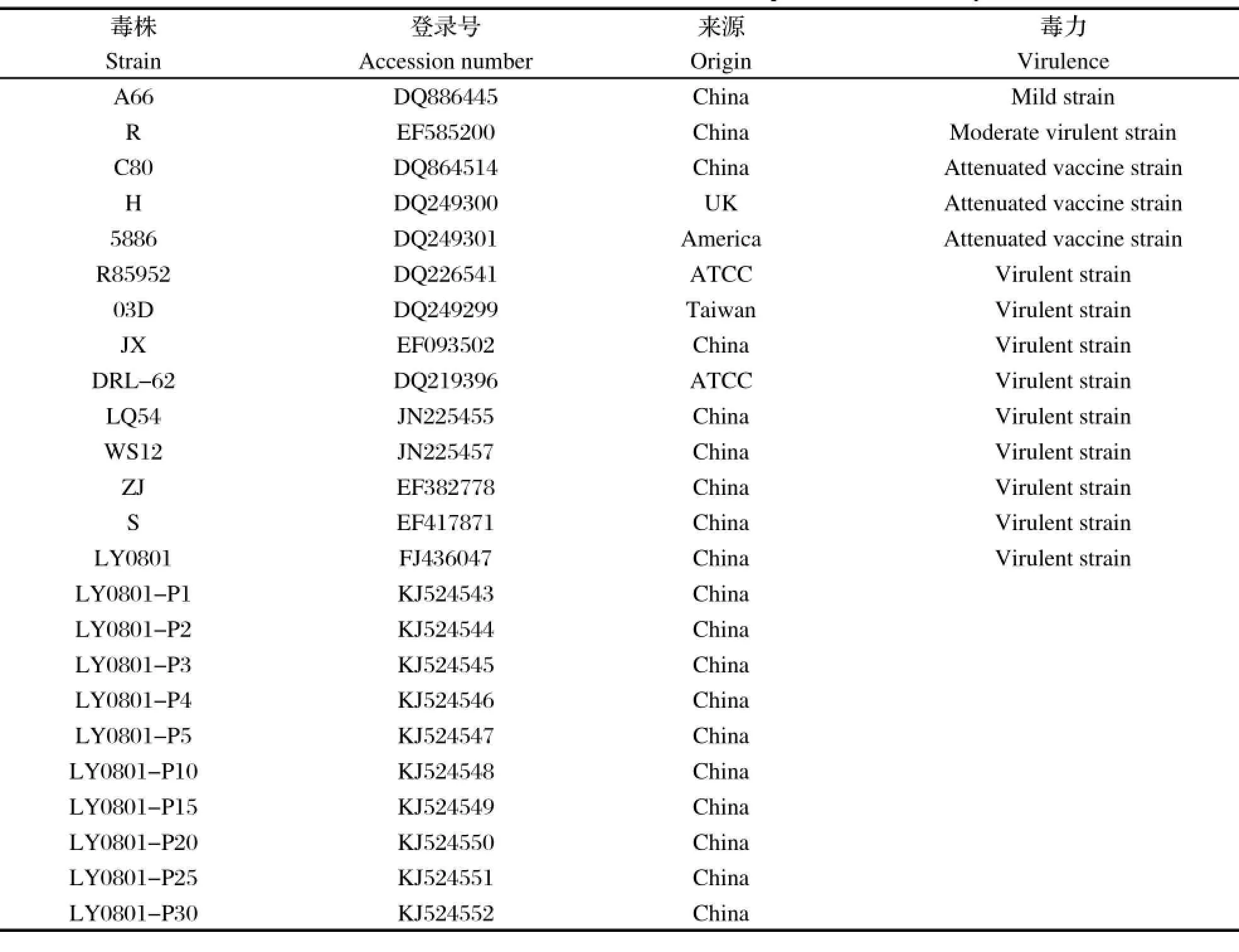
表1 本研究中用于序列比对的毒株Table 1 The DHAV-1 strains used for comparison in this study
1.6 不同代次病毒毒力的检测分别将各代次病毒接种健康鸭胚,108copies/枚,每个代次的病毒接种10个鸭胚。统计24~120 h死亡的鸭胚,计算各组鸭胚的平均死亡时间。
1.7 不同代次病毒复制能力的检测在各代病毒致死的鸭胚中,每一代次分别从死亡鸭胚中选择4个不同时间死亡的鸭胚尿囊液,提取RNA,利用本实验室已建立的Taqman探针荧光定量RT-PCR方法,对LY0801株DHAV-1不同代次的病毒RNA进行检测及数据分析。
2 结果
2.1 LY0801株VP1基因的RT-PCR扩增通过RT-PCR扩增DHAV-1LY0801株不同代次鸭胚传代毒的VP1基因,电泳后均观察到1 kb大小的核酸条带,与预期大小一致,见图1。

图1 DHAV-1 VP1基因RT-PCR扩增电泳图Fig.1 RT-PCR amplifi cation of VP1 gene of DHAV-1
2.2 鸭胚传代毒的VP1序列测定及分析在鸭胚传代过程中,LY0801株DHAV-1的VP1蛋白上出现了12个氨基酸突变位点,分别为R43M(K)、T48A、T101S、L169F、T180I、S181L、R183Q、E184A(K)、G187D、D193N、M213R和H219Y,并且不同代次病毒的这12个aa位点出现同步变异和反复变异现象,而不是点突变的积累(见图2)。与不同毒力的毒?株序列进行比对,未发现鸭胚传代后的氨基酸变异与病毒毒力有明显相关性。序列比对后发现,所有DHAV-1毒株(包括弱毒株、人工致弱疫苗株、中等毒力毒株、自然分离强毒株以及传代前后的LY0801株)VPl蛋白的第194~197位氨基酸均为保守SGD序列,与报道的FMDV Akesu/O/58细胞适应株的细胞受体结合位点相同[22]。
图2 DHAV-1 LY0801株鸭胚传代各代次病毒VP1氨基酸序列与不同毒力参考株病毒的VP1序列比对结果Fig.2 Amino acid sequences alignment of the VP1 protein of different passages of LY0801 strain in duck embryo and DHAV-1 isolates
2.3 不同代次病毒的毒力检测统计120 h内死亡的鸭胚数目,并计算各代次病毒致死鸭胚的平均死亡时间,结果发现随着代次的增加,DHAV-1各代次病毒致死鸭胚的平均时间呈逐渐延长的趋势(表2 )。

表2 不同代次病毒致死鸭胚的平均时间Table 2 The mean death time of duck embryos after being inoculated with different passages of virus
2.4 不同代次病毒的增值能力检测实时荧光定量RT-PCR检测表明,不同代次DHAV-1鸭胚尿囊液的病毒含量差异显著,且并未呈现出适应鸭胚后病毒拷贝数逐步稳定增加的趋势,但每一代病毒在不同时间致死鸭胚的病毒粒子拷贝数相近,结果见表3。
表3 不同代次病毒在致死鸭胚尿囊液的病毒含量Table 3 The viral content of different paaasages of DHAV-1 in duck embryo allantoic fl uid
3 讨论
运用Jameson-Wolf、Kyte-Doolitte、Emini和Karlus-Schulz方法对DHAV-1的VP1蛋白氨基酸序列进行分析,结果显示在VP1蛋白的132~137、 177~186、209~219氨基酸区域具有较好的亲水性、表面可及性和较高的抗原指数,并且在二级结构上含有易形成抗原表位的无规则卷曲和β-转角,表明VP1蛋白B 细胞优势抗原表位可能在此区域内或者附近[18]。DHAV-1 VP1的变异主要集中在C末端高变区180~219位氨基酸[14,18,19]。本研究在DHAV-1鸭胚传代不同代次的病毒中发现,VP1出现变异的12个氨基酸中,有8个(第180、181、183、184、187、193、213及219位氨基酸)位于高变区内,6个位于177~186位和209~219位两个预测的VP1蛋白B 细胞优势抗原表位上。经过序列比对后发现,上述8个氨基酸变异位点均在其他天然毒株中存在(图2)。已有研究表明这些位点的变异并未导致不同毒株之间交叉中和反应的失败和病毒毒力的变化[19]。因此推测LY0801株在鸭胚传代中发生的这8个氨基酸位点的变异至少并未导致DHAV-1主要中和性抗原表位和病毒毒力的改变。另外,第169位氨基酸出现的变异(L169F)只在LY0801株在鸭胚传代后才出现,这一变异是否为毒株特异性变异以及其生物学功能仍然需要进一步研究。
已有研究表明,将DHAV-1 强毒Q株在SPF鸡胚中传代可获得毒力稳定的致弱疫苗株[20]。本研究中各代次DHAV-1致死鸭胚的平均时间逐渐延长,显示DHAV-1对鸭胚致死能力随传代次数的增加呈减弱的趋势,但其VP1序列并没有随着鸭胚传代而发生渐进性突变,而是出现了反复变异的情况,并且12个氨基酸位点在不同的传代毒株中呈现同步变异的现象,表明病毒的毒力与VP1的变异没有明显的相关性。本研究中,测序时每一代病毒均测定了5个克隆以上,结果显示同代病毒VP1基因的序列是一致的,这表明每一代病毒中占优势的准种是一致的。鸭胚作为发育中的生命体会对病毒感染产生相应的免疫抵抗力,从而对病毒施加一定的免疫选择压的作用,但是由于鸭胚的个体差异性使这种选择具有不定向性。我们在鸭胚上传代的其他几株DHAV-1,有3株也出现了与LY0801株类似的同步变异和反复变异现象,而另外2株则发生突变后非常稳定,无反复变异现象(研究结果另文发表),这说明出现反复变异与毒株的特异性有直接关系。同时,不同代次DHAV-1鸭胚尿囊液的病毒含量并未呈现出适应鸭胚后逐步稳定增加的趋势,而表现为传代第1、10、30代病毒拷贝数明显高于其他代次的现象(表3),显示鸭胚传代至30代LY0801株 DHAV-1生物学特性并未稳定。
在小RNA病毒科成员中,衣壳蛋白VPl上保守的RGD序列具有与细胞受体结合的功能,是病毒感染细胞的关键[21]。将口蹄病毒(Foot-and-mouth disease virus,FMDV)的SGD序列替换为RGD序列之后,FMDV在细胞中的增殖效率明显增加[22]。本研究发现,传代前后的LY0801株及其他DHAV-1毒株的VPl基因中均存在SGD序列(图2),与报道的Akesu/O/58细胞适应株FMDV的细胞受体结合位点相同[23]。由于LY0801株DHAV-1在鸭胚传代过程中VP1基因反复变异和生物学特性不稳定,VP1中SGD序列的高度保守进一步表明其可能在病毒与细胞受体结合的过程中具有重要的生物学意义。
[1] Woolcock P R. Duck hepatitis[M] //Saif Y M,Barnes H J,Glisson J R,et al. Diseases of Poultry,eleventh ed. Iowa State Press,Ames,IA,2003,343-354.
[2] Kim M C,Kwon Y K,Joh S J,et a1. Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picomaviridae[J]. J Gen Virol,2006,87(Pt 11): 3307-3316.
[3] Tseng C H,Knowles N J,Tsai H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J]. Virus Res,2007,123(2): 190-203.
[4] Wang L,Pan M,Fu Y,et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes,2008,37(1): 52-59.
[5] Wang M,Zhang H,Zhou J H,et al. Analysis of codon usage in type1 and the new genotypes of duck hepatitis virus[J]. Biosystems,2011,106(1): 45-50.
[6] 袁率珍,范书才,李虹,等. 鸭肝炎病毒分子流行病学分析[J]. 中国预防兽医学报,2010,32(11): 849-853.
[7] Chen L L,Xu Q,Zhang R H,et al. Improved duplex RTPCR assay for differential diagnosis of mixed infection of duck hepatitis A virus type 1 and type 3 in ducklings[J]. Virol Methods,2013,192 (1-2):12-17
[8] Ding C,Zhang D. Molecular analysis of duck hepatitis virus type 1[J]. Virology,2007,361(1): 9-17.
[9] 聂奎,胡燕宾,曾兴艳,等. 鸭肝炎病毒基因的生物信息学分析及多聚蛋白的加工预测[J]. 中国预防兽医学报,2009,31(6): 481-484.
[10] Balamurugan V,Renji R,Saha S N. Protective immune response of the capsid precursor polypeptide (P1) of foot and mouth disease virus type‘O’produced in Pichia pastoris[J]. Virus Res,2003,92(2): 141-149.
[11] Feigelstock D A,Mateu M G,Valero M L,et al. Emerging foot-and-mouth disease virus variants with antigenically critical amino acid substitutions predicated by model studies using reference viruses[J]. Vaccine,1996,14(2): 97-102.
[12] 刘建,苏敬良,张克新,等. 新型鸭肝炎病毒流行病学调查及免疫防治试验[J].中国兽医杂志,2006,42(2): 3-6.
[13] 陈建红,张济培,司兴奎,等. 标准鸭肝炎Ⅰ型血清对鸭肝炎野毒株的免疫保护试验[J]. 中国兽医学报,2001,21(3): 231-235.
[14] 何冉娅,于森,张玉玲,等. 2007-200年华南地区鸭肝炎病毒流行病学调查及分离株的VP1 基因变异分析[J]. 中国动物传染病学报,2010,18(1): 7-15.
[15] Liu G Q,Wang F,Ni Z,et a1. Genetic diversity of the VP1 gene of duck hepatitis virus type I (DHV-I) isolates from southeast China is related to isolate attenuation[J]. Virus Res,2008,137 (1): 137-141.
[16] Woolcock P R,Crighton G W. Duck virus hepatitis: serial passage of attenuated virus in ducklings[J]. Vet Rec,1979,105(2): 30-32.
[17] 甘一迪,刘家森,姜赛,等. 3株鸭肝炎病毒I型结构基因VP1的克隆及序列分析[J]. 畜牧兽医学报,2009,40(6): 952-957.
[18] 黄良宗,刘鳗仪,王淑敏,等. 鸭肝炎病毒VP1蛋白B细胞抗原表位预测及变异分析[J]. 中国家禽,2011,33(20): 27-30.
[19] Gao J,Chen J,Si X,et al. Genetic Variation of the VP1 gene of the virulent duck hepatitis A virus type 1 (DHAV-1) isolates in Shandong province of China[J]. Virol Sin,2012,27(4): 248-253.
[20] Woolcock P R,Crighton G W. Duck virus hepatitis: the effect of attenuation on virus stability in ducklings[J]. Avian Pathol,1981,10(2): 113-119.
[21] Rossmann M G,Arnold E,Erickson J W,et al. Structure of a human common cold virus and functional relationship to other picornaviruses[J]. Nature,1985,317 (6033): 145-153.
[22] Rieder E,Henry T,Duque H,et al. Analysis of a footand-mouth disease virus type A24 isolate containing SGD receptor recognition site in vitro and its pathogenesis in cattle[J]. J Virol,2005,79(20): 12989-12998.
[23] 王宝琴,张永光,潘丽,等. 口蹄疫病毒Akesu/O/58株结构蛋白基因的克隆和细胞受体结合位点初探[J]. 中国兽医杂志,2008,44(12): 6-8.
GENETIC VARIATION OF VP1 GENE OF DUCK HEPATITIS A VIRUS TYPE 1 LY0801 STRAIN DURING REPEATED PASSAGES IN DUCK EMBRYOS
MA Ming-jie,GUO Cui-ping,JIAO Yu-xiang,LV Jia-hong,SUN Zhen,ZHANG Rui-hua,CHEN Jun-hao,XIE Zhi-jing,JIANG Shi-jin
(Shandong Province Key Laboratory of Animal Biotechnology and Disease Control and Prevention,College of Veterinary Medicine,Shandong Agricultural University,Taian 271018,China)
To survey the genetic variation of VP1 gene of Duck hepatitis A virus type I (DHAV-I),DHAV-1 LY0801 isolate was carried 30 serial passages in duck embryos. The VP1 gene of the fi rst to fi fth,tenth,fi fteenth,twentieth,twenty-fi fth and thirtieth passages was amplifi ed and sequenced respectively. With the dose of 108copies per embryo,each ten 9-day-old healthy duck embryos were inoculated with different passages of virus,and the mean death time of each group and the vial copies in duck embryo allantoic fl uid were detected. The results showed that there were 12 amino acid mutation sites in VP1 gene in different passages,which were R43M(K),T48A,T101S,L169F,T180I,S181L,R183Q,E184A(K),G187D,D193N,M213R and H219Y. The 12 amino acid mutations appeared in different passages simultaneously and repeated the mutations in the first 30 passages. In the passaging process,the mean death time of duck embryos was increasing with increasing passage times,but the virus proliferation in duck embryos did not show a steady growth trend.
Duck hepatitis A virus tyre 1 (DHAV-1); VP1; mutation; attenuation
S852.659.6
A
1674-6422(2014)05-0021-07
2014-03-26
山东省科技发展计划项目(2010GNC10914);山东省现代农业产业技术体系家禽创新团队(SDAIT-13-011-15)
马明杰,女,硕士研究生,预防兽医学专业
姜世金,E-mail:sjjiang@sdau.edu.cn
