I型糖尿病大鼠血浆胃动素与胃动力之间关系的研究
2014-04-13曹燕飞张咩庆陈宏达王陈芳杜静静
曹燕飞 张咩庆 陈宏达 王陈芳 杜静静
●论 著
I型糖尿病大鼠血浆胃动素与胃动力之间关系的研究
曹燕飞 张咩庆 陈宏达 王陈芳 杜静静
目的 探讨I型糖尿病大鼠血浆胃动素与胃动力之间的关系。 方法 将Wistar清洁级大鼠30只采用随机数字表法分为模型组(链脲佐菌素30mg/kg,腹腔注射),正常对照组(腹腔注射等量的0.9%氯化钠溶液)。美蓝灌胃实验测定胃排空率,ELISA法测定血浆胃动素浓度,8周后观察胃平滑肌组织病理变化。 结果 与正常对照组比较,模型组大鼠血浆胃动素浓度明显升高(P<0.05),胃排空率下降(P<0.01),光镜下胃平滑肌组织结构紊乱。 结论 I型糖尿病大鼠的胃动力并没有随血浆胃动素浓度升高而增强,甚至出现了一定程度的降低,可能与大鼠胃平滑肌组织病变及胃动素抵抗有关。
糖尿病胃轻瘫 胃动素 胃动力
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是糖尿病常见慢性并发症之一,是继发于糖尿病的以胃动力低下、胃排空延迟、胃节律紊乱为特点的临床综合征。国外资料显示,50%的糖尿病患者有消化不良症状,50%~76%的糖尿病患者有胃排空延迟[1]。DGP病理机制尚未完全阐明,它可能是自主神经功能障碍、胃肠激素分泌异常、高血糖、平滑肌损害以及微血管病变等因素的综合影响的结果[2]。本实验利用小剂量链脲佐菌素(STZ)诱导的I型糖尿病大鼠模型,探讨其血浆胃动素与胃动力变化的关系,旨在进一步阐明DGP的相关病理机制,为探索新的治疗方法提供客观实验依据。
1 材料和方法
1.1 动物3月龄雄性Wistar清洁级大鼠30只,体重230~240g,由浙江中医药大学实验动物中心提供。
1.2 试剂及造模材料0.9%氯化钠溶液由杭州民生药业有限公司提供,生产批号:21201204;10%中性甲醛溶液由上海化学试剂公司提供;STZ由美国Sigma公司提供:将STZ溶于0.1mmol/L的枸橼酸钠缓冲液(pH4.5)中,配制成浓度为2%的溶液。
1.3 仪器全自动生化仪器:Hitachi 7600-020Automatic analyzer,株式会社日立高新技术;离心机:Labogenscanspeed 1248R,丹麦Labogene公司;显微镜:Olympus BX51,日本奥林巴斯公司。
1.4 实验方法
1.4.1 糖尿病大鼠模型的建立 参考相关文献[3]设计糖尿病大鼠动物模型,将大鼠适应性喂养3d后,采用随机数字表法将30只大鼠分为2组,每组15只。模型组:大鼠按30mg/kg的剂量腹腔一次性注射2%STZ溶液,以持续1周空腹血糖≥16.7mmol/L为造模成功。正常对照组:大鼠腹腔注射等量的0.9%氯化钠溶液。造模后监测大鼠的精神状况和活动状况、进食量、饮水量以及尿量,每周测体重1次,取材前1d再测体重。造模后第3天及其后每周采尾血测空腹血糖,取材前再测空腹血糖1次。实验过程中自由进食饮水。
1.4.2 血浆胃动素浓度测定 造模成功后,采集腹主动脉血2ml,不抗凝,3 000r/min离心15min,收集血浆,用ELISA法测定血浆胃动素浓度。
1.4.3 胃动力学指标测定 8周后,禁食12h,于次日晨,将1mg/ml的美蓝溶液0.4ml灌胃,30min后,处死大鼠;取全胃,将胃内残留物用0.9%氯化钠溶液4ml冲洗并收集冲洗液,低速离心机3 500r/min,离心15min,取上清液,用722分光光度计在640nm波长检测吸光度值(OD)。大鼠胃排空情况用胃内色素的残留率表示,胃内色素残留率=测定管OD值/标准管OD值×100%。1.4.4 组织病理学检查 取各组大鼠胃壁组织1块(10mm×10mm×2mm),置于10%中性甲醛溶液中固定,经梯度乙醇脱水,二甲苯透明,浸蜡,石蜡包埋,制成厚度为5μm的切片,行HE染色,中性树胶固定。光镜下观察胃壁平滑肌组织病理变化。
1.5 统计学处理 采用SPSS 13.0统计软件,计量资料均以表示,组间比较采用t检验,采用Pearson法进行相关分析。上述步骤均采用单盲法,未告知研究员分组情况。
2 结果
2.1 一般情况 造模后模型组大鼠空腹血糖浓度持续>16.7mmol/L,并出现了多饮、多食及多尿的糖尿病典型症状,I型糖尿病造模成功。
2.2 造模后两组大鼠空腹血糖水平的比较 见表1。

表1 造模后两组大鼠空腹血糖水平的比较(mmol/L)
由表1可见,与正常对照组比较,Ⅰ型糖尿病模型组大鼠各个时点的平均空腹血糖浓度均明显升高(均P<0.01)。
2.3 造模后两组大鼠体重的比较 见表2。

表2 造模后两组大鼠体重的比较(g)
由表2可见,Ⅰ型糖尿病模型组大鼠造模1周后体重较正常对照组明显低(均P<0.01)。
2.4 两组大鼠胃肠动力学及血浆胃动素水平的比较 见表3。
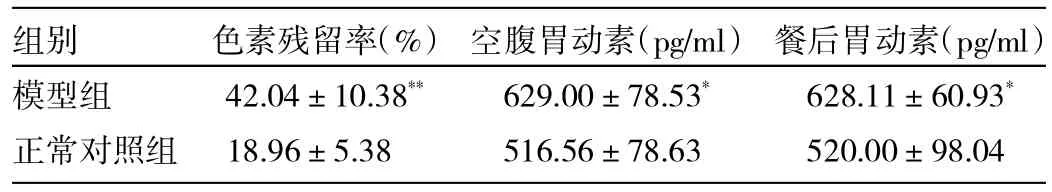
表3 两组大鼠胃肠动力学及血浆胃动素水平的比较
由表3可见,Ⅰ型糖尿病模型组大鼠的胃内色素残留率、空腹和餐后血浆胃动素水平均明显高于正常对照组(P<0.05或0.01)。
2.5 胃动力与空腹血糖、胃动素的相关分析 Pearson相关分析显示,Ⅰ型糖尿病模型组大鼠胃内色素残留率与空腹血糖浓度、血浆胃动素浓度均呈正相关(r= 0.826、0.793,均P<0.05)。
2.6 胃平滑肌组织病理变化各组大鼠胃平滑肌组织光镜下观察 与正常对照组相比,STZ诱导Ⅰ型糖尿病模型大鼠胃壁组织中的平滑肌细胞有不同程度的肌细胞排列紊乱,提示胃壁组织的平滑肌细胞病变,详见图1。
3 讨论
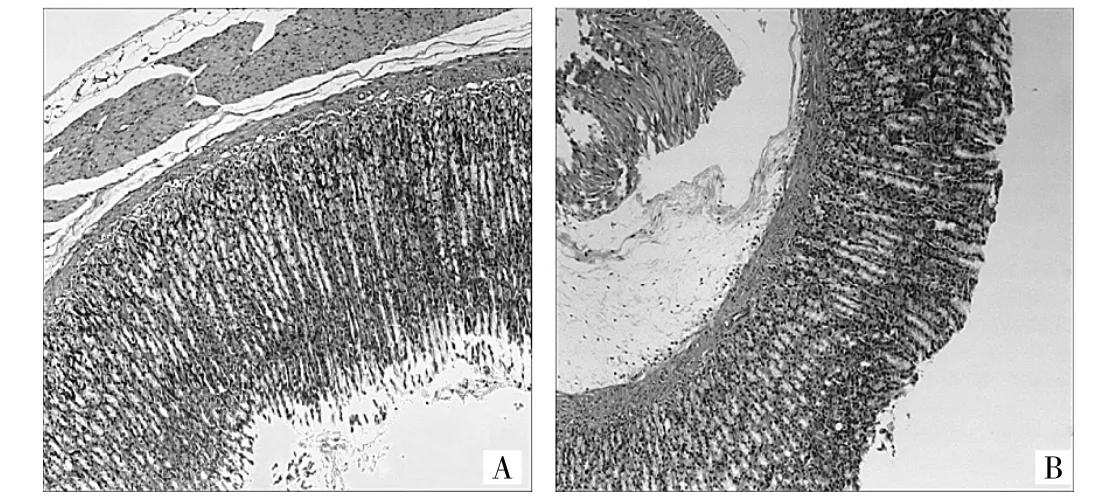
图1 光镜下观察各组大鼠胃壁平滑肌组织结构变化(A:正常对照组,B:模型组;HE染色,×100)
本实验模型组大鼠采用STZ腹腔内注射,通过特异性破坏模型组大鼠的胰岛β细胞,减少胰岛素分泌,诱发Ⅰ型糖尿病。实验期间模型组大鼠空腹血糖浓度持续>16.7mmol/L,平均体重明显低于正常对照组,并出现了多饮、多食及多尿的糖尿病典型症状,Ⅰ型糖尿病造模成功。本实验在造模8周后检测结果显示,与对照组相比,模型组大鼠胃内色素残留率增加,显示胃排空能力明显下降;本实验糖尿病大鼠存在胃轻瘫表现。
胃动素由Mo细胞分泌,分布于小肠,是22个氨基酸组成的多肽。它可以影响胃肠运动和胃肠电活动,对胃蛋白酶的分泌起促进作用,增加胃黏膜血流量但不增加胃酸分泌,使胃体、胃窦及幽门不同区域的肌细胞强烈收缩,并能诱发胃和小肠的移行性运动复合波MMCⅢ相[4],导致胃产生明显的收缩运动和小肠明显的分节运动,对胃排空起到一定的促进作用,同时对胃肠道内容物的清除也发挥了积极的作用。在既往的研究中,胃动素的释放量被认为与胃肠动力呈正比,即胃动素释放减少,胃肠蠕动减慢;胃动素释放减少,胃肠动力降低[5]。
而在本研究中,我们发现发生胃轻瘫的Ⅰ型糖尿病模型组大鼠与正常对照组比较,有更高的血浆胃动素水平,两组间差异有统计学意义。相关分析显示,模型组的胃内色素残留水平与胃动素水平存在正相关关系。一些针对Ⅱ型DGP患者的临床研究同样显示DGP患者的血浆胃动素水平较胃排空正常者高[6-7],与本动物实验的结果相一致。肠神经系统及平滑肌细胞都有胃动素受体的分布[8],提示胃动素的作用可能是通过神经通路和对平滑肌的直接作用共同完成的。有研究表明糖尿病模型大鼠的肠神经系统功能及形态结构均显示异常,肠神经系统的肾上腺能神经纤维肿胀、变性或神经缺失,还有小肠肌间神经丛胆碱能神经递质的缺失和胆碱酯酶活性增加[9]。同时在体外高糖浓度下的细胞培养到对糖尿病大鼠的体内实验中,很多学者发现,糖尿病可致不同部位细胞凋亡[10-11]。本研究发现在第8周STZ诱导糖尿病模型大鼠胃壁组织中的平滑肌细胞均有明显的空泡变性,伴有不同程度的肌细胞排列紊乱,提示胃壁组织的平滑肌细胞病变。这可能导致胃动素对平滑肌的直接作用的减弱,使胃动素代偿性释放增加。
本研究显示Ⅰ型糖尿病模型组大鼠的血糖水平与胃内色素残留水平呈正相关。高血糖可影响胃电起步点,使胃电节律紊乱,胃窦收缩减弱,频率减少,增加孤立性幽门收缩波;减慢正常人及糖尿病患者的胃排空[12]。胃排空延迟所致的胃潴留,胃壁持续扩张和松弛,加之胃内容物中脂肪和蛋白质的刺激,也可使胃动素释放增加[13]。
综上所述,Ⅰ型糖尿病大鼠的胃动力并没有随血浆胃动素浓度升高而增强,甚至出现了一定程度的降低。有研究称应用胃动素受体激动剂可改善DGP患者的临床症状[14],我们推测可能有胃动素抵抗的发生。我们需要进一步的研究以阐明其中的机制。
[1]Camilleri M.Advances in diabetic gastroparesis[J].Reviews in Gastroenterological Disorders,2002,2(2):47-56.
[2]KE Mei-yun,LAN Yu.Disorders of gastrointestinal motility of diabetes mellitus and possible mechanisms[J].Chinese Journal of Endocrinology and Metabolism,2003,19:164-165.
[3]邵伟娟,陶凌云,赵茜茹,等.不同剂量STZ诱导小鼠糖尿病模型及生殖能力的研究[J].上海交通大学学报,2007,25(6):141-143.
[4]李景南,钱家鸣.胃肠激素与消化系疾病[J].中华消化杂志,2005,25(4): 253.
[5]Esposito S,Valente G,Zavallone A,et al.Histological scorefor cells with irregular nuclear contours for the diagnosis of reflux esophagitis in children[J].Hum Pathol,2004,35:96.
[5]王青青,张爱珍.2型糖尿病胃轻瘫与胃肠激素的相关性[J].中华内分泌代谢杂志,2004,20(4):324-325.
[6]胡素银,方逢年,胡少龙,等.糖尿病性胃轻瘫患者血浆胃动素的变化[J].浙江医学,1999,21(9):550.
[7]Feighner S D,Tan C P,McKee K K,et al.Receptor for motilinidentified in the human gastrointestinal system[J].Science,1999,284 (5423):2184-2188.
[8]刘梅,董蕾,朱文艺.大鼠杏仁核胃动素受体分布及其作用研究[J].第一军医大学学报,2005,25(9):1100-1105.
[9]Kawagishi T,Nishizawa Y,Okuno Y,et al.Effect of cisapride on gastric emptying of indigestible solids and plasma motilin concentration in diabetic autonomic neuropathy[J].Am J Gastroenterol 1993,88:933-938.
[10]Cai L,Kang Y J.Cell death and diabetic cardiomyopathy[J].Cardiovasc Toxicol,2003,3(3):219-228.
[11]史洪涛,房殿春,龙庆林.糖尿病大鼠胃平滑肌细胞凋亡及相关基因蛋白表达的意义[J].中国临床康复,2005,9(3):114-117.[12]Petrakis I E.Induced-hyperglycemia attenuates erythromycininduced acceleration of hypertonic liquid-phase gastric emptying in type-I diabetic patients[J].Dig Dis,1999,17(4):241-247.
[13]罗金燕.胃排空功能的研究[J].中华内科杂志,1991,30(6):340-342.
[14]Yun-Dan JIA,Chang-Qin LIU,Ming TANG,et al.Expression of motilin in the hypothalamus and the effect of central erythromycin on gastric motility in diabetic rats[J].Neuroscience Bulletin,2007,23(2):75-82.
Relationship between motilin and gastric motility in diabetic rats
Objective To investigate the relationship between motilin and gastric motility in type I diabetic rats.Methods Thirty Wistar rats were randomly divided into model group and control group.Type I diabetes was induced by intraperitoneal injection of streptozotocin(STZ)30mg/kg in model rats,and rats in control group received same volume of normal saline.Gastric emptying rate was determined by methylene blue gavage method.Plasma motilin concentration was determined by ELISA method.Eight weeks later,gastric smooth muscle tissue structure changes were observed. Results Compare with control group,the plasma motilin concentration was significantly higher and the gastric emptying rate was significantly lower in model group(both P<0.05).The morphological study showed the structural disorder of gastric smooth muscle tissue.Conclusion The plasma motilin concentration increases and gastric motility is reduced in type I diabetic rats,which may be associated with pathological changes of gastric smooth muscle and motilin resistance.
Pathogenesis of diabetic Gastroparesis Gastric motilin gastric motility
2014-08-12)
(本文编辑:沈昱平)
浙江省中医药科学研究基金计划(2012ZA068)
310005 杭州,浙江中医药大学附属第三医院消化内科(曹燕飞、张咩庆、陈宏达、王陈芳);浙江中医药大学附属第二医院急诊科(杜静静)
张咩庆,E-mail:zhangMG5569@sina.com
