视神经脊髓炎患者血浆尿酸水平的研究
2014-04-13杜强丁美萍
杜强 丁美萍
视神经脊髓炎患者血浆尿酸水平的研究
杜强 丁美萍
视神经脊髓炎(NMO)是一种中枢神经系统原发性脱髓鞘性疾病,既往被认为是多发性硬化(MS)的一个亚型,目前已被认可是一种独立疾病。近年关于MS动物模型和患者的研究证实,在疾病急性期存在机体抗氧化能力的明显减低以及中枢神经系统氧化应激损伤,这可能是MS发病的始动病因[1-3]。嘌呤代谢的终产物尿酸(UA)是机体最重要的内源性抗氧化剂之一,研究发现其在MS急性发作期患者中的水平较健康人群减低[4-9],有研究提示NMO患者中也可能存在相似情况。对此,我们作了进一步研究,检测了本科收治的NMO急性期患者空腹血浆UA水平,以探寻NMO与血浆UA的关系。
1 对象和方法
1.1 对象 将2005-01—2013-01浙江大学医学院附属第二医院(下称浙医二院)收治的3组患者纳入研究对象:NMO急性发作期患者(NMO组)60例,男15例,女45例,年龄18~66(43.72±12.50)岁;病程1~360(52.41±79.05)个月;均按照Wingerchuk 2006诊断标准确诊NMO[10]。MS急性发作期患者(MS组)91例,男28例,女63例,年龄15~74(40.09±12.77)个岁;病程1~168(63.11±40.7)个月;均按照McDonald 2005诊断标准确诊MS[11]。以上两组均包含首次发作和已有既往发作史者,入组时均处于各自诊断标准所定义的急性发作期。健康对照组来自浙医二院国际保健中心体检的健康人员,共104例,其中男50例,女54例,年龄22~79(43.22±13.78)岁。3组均已排除合并代谢综合征、痛风等对血浆UA水平产生明显影响的疾病。各组人员均为浙江省常住或已在浙江省居住生活1年以上的常住居民。其膳食结构可参照浙江省城乡居民膳食结构的相关研究。NMO、MS组因疾病发作具有不可预测性,入院前饮食状况无法做特殊控制,也无法获得发病前近期血浆UA数据;健康对照组组按照我院体检要求,体检前素食48h。
1.2 标本采集与UA检测 NMO组与MS组均在入院后第2天的清晨(空腹8h以上)采集静脉血,健康对照组在体检当日清晨(空腹8h以上)采集静脉血。UA测定采用酶定量分析法进行。
1.3 统计学处理 采用SPSS V15.0统计软件。计量资料以表示;比较采用方差分析。3组UA水平与疾病病程的关系采用散点图及Pearson相关分析。为了消除性别对血浆UA水平的影响,各组再分为男性亚组及女性亚组,以年龄为协变量,对各组的UA水平做协方差分析。
2 结果
2.1 各研究组间血浆UA水平的比较 NMO组与MS组血浆UA水平 [(228.53±71.10)、(240.76±86.14)μmol/ L)均低于健康对照组[(320.13±76.44)μmol/L],差异均有统计学意义(P<0.01);NMO组[(228.53±71.10)μmol/L]低于MS组(240.76±86.14μmol/L),但差异无统计学意义(P>0.05)。
2.2 3组不同性别亚组血浆UA水平的比较 见表1。
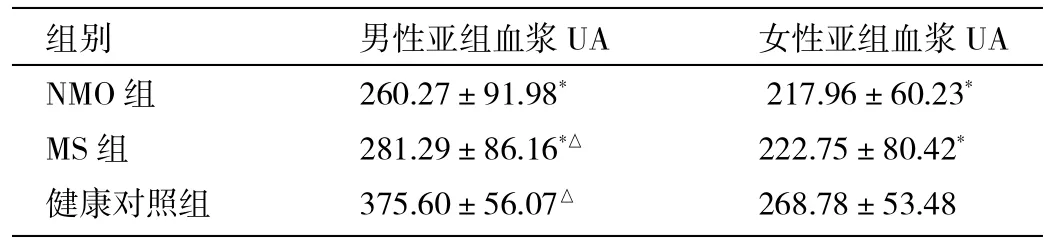
表1 3组不同性别亚组血浆UA水平的比较(μmol/L)
由表1可见,NMO组和MS组无论是男性还是女性,血浆UA水平仍明显低于健康对照组,差异有统计学意义。NMO组与MS组比较,NMO组的男性和女性亚组的UA水平仍低于MS组的相应亚组,但差异无统计学意义(均P>0.05)。3组血浆UA水平,女性亚组均低于男性亚组,其中NMO组两者差异无统计学意义(P>0.05),而MS组和健康对照组两者差异均具有统计学意义。
2.3 NMO组、MS组血浆UA水平与疾病病程的关系 见图1、2。
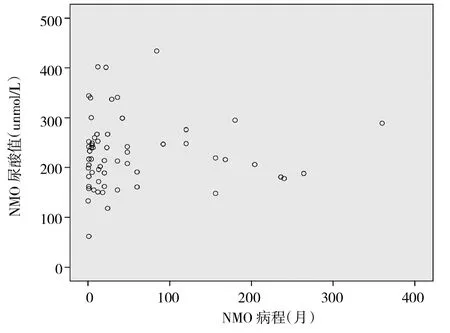
图1 NMO患者血浆UA水平与疾病病程的关系
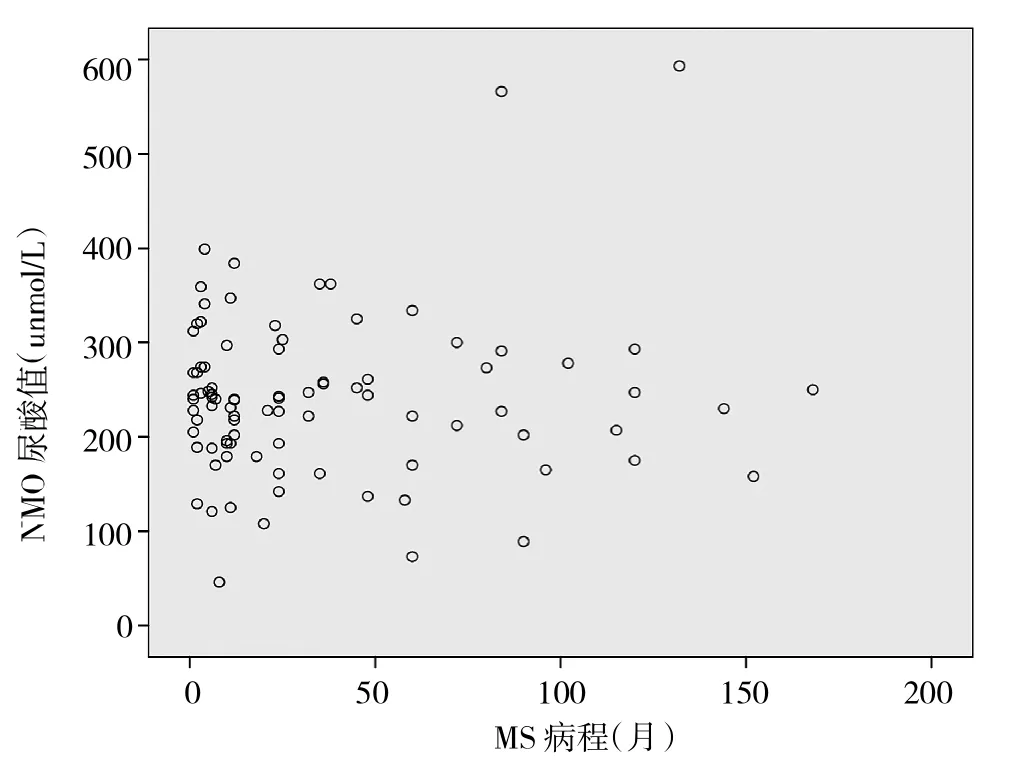
图2 MS患者血浆UA水平与疾病病程的关系
由图1、2可见,两组患者疾病总病程与血浆UA水平均无明显相关关系(r=0.016、0.072,均P>0.05)。
3 讨论
UA是体内天然的抗氧化物质之一,其主要抑制过氧化亚硝酸自由基(ONOO)所介导的脂质过氧化、DNA双链断裂、半胱氨酸及酪氨酸的硝基化等,减少相应的细胞凋亡、坏死及组织损伤。MS动物模型(实验性自身免疫性脑脊髓炎,EAE)的病理学、病理生理学研究已经证实,在EAE中枢神经系统病变部位存在ONOO增多及其所致的氧化应激损害,并是其病理生理过程的主要效应环节。故理论上UA可以减轻EAE、MS、NMO的氧化应激损伤,改善病情。Hooper[12]已证实UA可以有效抑制EAE的临床发病,减轻临床症状,甚至获得缓解。病理学检查表明UA可以保护EAE的血脑屏障功能,减少中枢神经系统病变部位炎症细胞的浸润程度,抑制氧化应激。
现有的关于UA与MS关系的临床研究多数认为MS患者急性发作期血浆UA水平较健康人群明显降低,而关于NMO患者血浆UA水平的研究则较少。MS的临床分型、病程、发作或缓解分期、残疾状态扩展评分(EDSS)评价的病情严重程度与血浆UA水平的关系的研究综合认为:MS的复发缓解型较其他临床类型具有更低的血浆UA水平(均发作期检测);病程长短与血浆UA水平无明确关系;MS疾病缓解期血浆UA水平与健康对照人群差异无统计学意义;少数研究提示EDSS评分似与MS患者血浆UA水平之间有负相关关系;在各种亚组分析中女性一般较男性具有更低的血浆UA水平;MS急性期MRI表现与血浆UA水平无明显关联[4-9,13-16]。本研究的结果NMO组、MS组血浆UA水平均低于健康对照组,差异有统计学意义。提示NMO与MS相似,在急性发作期存在血浆UA的显著减少,符合其中枢神经系统脱髓鞘性炎症反应本质,提示NMO病理生理过程中亦存在较为强烈的ONOO氧化损伤作用。临床上,NMO患者往往较MS患者具有更严重的症状体征以及后遗神经功能损害,且其脑脊液细胞数、蛋白含量一般较MS高,提示其炎症反应和氧化应激损伤可能较MS更重。本研究结果显示NMO组较MS组具有更低的UA水平,支持其炎症反应与氧化应激损伤较MS更重的判断,但因差异无统计学意义,故无法定论。本研究显示NMO、MS急性发作期血浆UA水平与疾病病程之间明显相关性,结合前述文献的结论,提示低UA水平主要与脱髓鞘疾病急性发作期病理生理过程相关,而在疾病缓解期则无此改变,故血浆UA水平降低可能可以与症状体征、影像学病灶活动等因素一样,作为脱髓鞘疾病急性活动的独立标记物之一。在本研究的性别亚组分析中,各研究组的女性组血浆UA水平均低于相应男性组,除NMO组外,差异均有统计学意义,提示性别对血浆UA水平具有重大影响,并可能与中枢神经系统脱髓鞘疾病发病率女性明显高于男性直接相关。
目前对于NMO、MS急性发作期血浆UA水平下降的成因尚无公认结论,主要有两种解释:(1)血浆UA水平降低是原发变化。血浆UA水平的降低导致机体对ONOO清除能力下降,进而对氧化应激的抵御能力下降,容易产生由氧化损伤所致的血脑屏障功能破坏、炎症细胞中枢神经系统浸润、中枢神经系统炎症反应,进而容易罹患NMO、MS,或导致其再次急性发作。(2)NMO、MS为原发病变,自身免疫性炎症导致氧化应激损伤、中枢神经系统中ONOO增多,同时导致血脑屏障通透性增加,使得UA继发性地大量透过血脑屏障进入中枢神经系统中的病变部位,并与ONOO发生反应,这种继发性消耗机制导致血浆中UA水平降低。有学者研究MS急性发作期患者的血浆、脑脊液尿囊素(UA的氧化代谢产物)水平,未发现增高,提示血浆UA水平下降应该不是由于ONOO大量消耗UA、将其氧化代谢为尿囊素所致,从而支持第1种解释[5]。以此类推,NMO急性发作期血浆UA水平下降同样是疾病原发性、病因性变化的可能性较大。
在中枢神经系统脱髓鞘疾病的治疗领域,现有EAE模型研究已证实UA对EAE的发病、进展均有明显的抑制作用,并有较高的治愈率[12,17]。但如果让患者口服UA制剂,UA会因肠道细菌的分解难以进入血浆,故UA用于临床治疗的研究较少。少数学者报道应用肌酐(次黄嘌呤核苷,UA的前体物质)口服,可以有效提升MS急性发作期患者的血浆UA水平,对诱导发作缓解、缓解期患者的缓解期维持有促进作用,甚至使部分患者的MRI病灶消失[18]。但因样本量小,尚难以得出确定性结论。另有研究报道MS患者接受激素或正规免疫调节治疗(干扰素为主)后血浆UA水平高于未接受治疗者[19],提示血浆UA水平提升可能是现有疗法的起效机制之一,或UA可能可以作为中枢神经系统脱髓鞘疾病治疗疗效评价的客观指标之一。因此,期待更多关于NMO与血浆UA水平的前瞻性研究,为中枢神经系统脱髓鞘疾病的治疗提供一个新的方向。
[1]Hooper D C,Bagasra O,Marini J C,et al.Prevention of experimental allergic encephalomyelitis by targeting nitric oxide and peroxynitrite:implications for the treatment of multiple sclerosis[J].Proc Natl Acad Sci USA,1997,94(6):2528-2533.
[2]Smith K J,Kapoor R,Felts P A.Demyelination:the role of reactive oxygen and nitrogen species[J].Brain Pathol,1999,9(1):69-92.
[4]Peng F H,Zhang B,Zhong X F,et al.Serum uric acid levels of patients with multiple sclerosis and other neurological diseases[J].Multiple Sclerosis,2008,14(2):188-196.
[5]Stefan K,Bernd C,Bernhard F.No evidence of increased oxidative degradation of urate to allantoin in the CSF and serum of patients with multiple sclerosis[J].J Neurol,2005,252(5):611-612.
[6]Jop P,Geeta S M,Dorothea J,et al.Serum uric acid levels and leukocyte nitric oxide production in multiple sclerosis patients outside relapses[J].Journal of the Neurological Sciences,2005,231(1-2):41-44.
[7]Min J H,Waters P,Vincent A,et al.Reduced serum uric acid levels in neuromyelitis optica:serum uric acid levels are reduced during relapses in NMO[J].Acta Neurol Scand,2012,126(4):287-291.
[8]Fereshteh A,Mohammadali B,Maryam A,et al.Serum uric acid level in patients with relapsing-remitting multiple sclerosis[J].Journal of Clinical Neuroscience,2013,20(5):676-678.
[9]Guerrero AL1,Gutiérrez F,Iglesias F,et al.Serum uric acid levels in multiple sclerosis patients inversely correlate with disability[J].Neurol Sci,2011,32(2):347-350.
[10]Wingerchuk D M,Lennon V A,Pittock S J,et al.Revised diagnostic criteria for neuromyelitis optica[J].Neurology,2006,66(10):1485-1489.
[11]Polman C H,Reingold S C,Edan G,et al.Diagnostic criteria for multiple sclerosis:2005 revisions to the"McDonald Criteria"[J].Ann Neurol,2005,58(6):840-846.
[12]Hooper D C,Scott G S,Zborek A,et al.Uric acid,a peroxynitrite scavenger,inhibits CNS inflammation,blood-CNS barrier permeability changes,and tissue damage in a mouse model of multiple sclerosis[J].The FASEB Journal,2000,14(5):691-698.
[13]Peng F,Yang Y,Liu J,et al.Low antioxidant status of serum uric acid,bilirubin and albumin in patients with neuromyelitis optica [J].European Journal of Neurology,2012,19(2):277-283.
[14]Fuhua P,Xiufeng Z,Xuhui D,et al.Serum uric acid levels and neuromyelitis optica[J].J Neurol,2010,257(6):1021-1026.
[15]Rentzos M,Nikolaou C,Anagnostouli M,et al.Serum uric acid and multiple sclerosis[J].Clinical Neurology and Neurosurgery, 2006,108(6):527-531.
[16]Toncev G,Milicic B,Toncev S,et al.Serum uric acid levels in multiple sclerosis patients correlate with activity of disease and blood-brain barrier dysfunction[J].European Journal of Neurology,2002,9(3):221-226.
[17]Kean R B,Spitsin S V,Mikheeva T,et al.The peroxynitrite scavenger uric acid prevents inflammatory cell invasion into the central nervous system in experimental allergic encephalomyelitis through maintenance of blood-central nervous system barrier integrity[J].J Immunol,2000,165(11):6511-6518.
[18]Spitsin S,Hooper D C,Leist T,et al.Inactivation of peroxynitrite in multiple sclerosis patients after oral administration of inosine may suggest possible approaches to therapy of the disease[J].Mult Scler,2001,7(5):313-319.
[19]Mart n-Polo J,Laherrn E,et al.Variation of serum uric acid levels in multiple sclerosis during relapses and immunomodulatory treatment[J].European Journal of Neurology,2008,15(4):394-397.
2013-06-14)
(本文编辑:杨丽)
310051 杭州,浙江大学医学院附属第二医院滨江院区(杭州市滨江医院)神经内科(杜强),浙江大学医学院附属第二医院神经内科(丁美萍)
丁美萍,E-mail:dingmeiping@tom.com
