增强MRA对肝脏上皮样血管平滑肌脂肪瘤诊断价值的探讨
2014-04-13陈燕琼肖文波顾亚萍彭志毅
陈燕琼 肖文波 顾亚萍 彭志毅
增强MRA对肝脏上皮样血管平滑肌脂肪瘤诊断价值的探讨
陈燕琼 肖文波 顾亚萍 彭志毅
肝脏血管平滑肌脂肪瘤(angiomyolipoma,AML)是少见的良性肿瘤。对于含大量脂肪成分的典型AML,CT或MR诊断较为明确。少脂肪成分或呈上皮样AML在CT平扫时难以明确脂肪成分,甚至双回波MR T1WI上亦难以检查出脂肪成分,而三期增强检查又可表现为快进快出的肿块,因此与其它富血供病灶甚至肝细胞肝癌的鉴别诊断较为困难。笔者通过观察增强磁共振血管成像(magnetic resonance angiography,MRA)表现,并结合CT动态增强扫描,分析4例患者5处肝脏上皮型AML病灶的血流动力学特征,以期能够对AML和其它肝脏富血供肿瘤的鉴别诊断提供新的思路,现报道如下。
1 资料和方法
1.1 一般资料 2009-07—2012-10在我院经手术病理证实的4例患者,共5处肝脏上皮样AML病灶,其中男1例,女3例,年龄37~45岁,平均42岁;均无肝硬化或病毒性肝炎病史,无结节性硬化症表现。4例患者中2例因上腹部不适就诊发现病灶,2例常规体检行超声检查发现病灶。右肝3处病灶,左肝2处病灶,其中1例患者左右肝内各发现1处病灶;生化检查中甲胎蛋白均在正常范围。4例患者均进行了肝脏部分切除术。
1.2 方法 所有患者均行16层螺旋CT检查(日本东芝公司,Aquilion型),团注100~120ml对比剂后,行动脉期、门静脉期和延迟期三期动态对比增强扫描(重建间隔5mm)。为进一步了解肿瘤的血流动力学特征,患者均在术前进行MRA检查,但未行T1加权in phase和out of phase序列扫描来判断病灶内是否存在CT难以检测出的少量脂肪。MRA运用1.5T超导磁共振扫描仪(美国GE Medical System,Version Infinity ExiteⅡ型)和8通道体部相控阵线圈,冠状位对比增强3D-MRA运用快速梯度重聚回波序列,扫描参数为:TR/TE:10/最小值,翻转角:45,矩阵:384×192,层厚:3.0 mm。经静脉团注钆喷酸葡胺15ml(中国广州康臣药业有限公司,国药准字:H10950272,15ml/瓶),软件触发信号采集(美国GE Medical System),MRA包括三期连续扫描。运用工作站软件(美国GE公司,version ADW4.2)行最大信号强度投影(maximum intensity projection,MIP)重建。将获得的血管影像作适当的旋转以清晰显示异常血管。
2 结果
2.1 CT平扫+增强检查结果 所有病灶呈圆形或椭圆形,直径2.3~14.0cm。腹部超声检查所有病灶均为实性,表现为不均匀等低回声肿块,含丰富的血流信号。CT平扫均显示为边界清晰的肿块,未见脂肪成分。动态对比增强CT扫描显示,病灶呈快进快出增强方式,均在动脉期表现为不均匀明显强化,相对于周围正常肝实质呈明显高密度灶,在门静脉期及延迟期表现为等低密度(图1A、2B、2C)。三期动态对比增强扫描发现,所有病灶均显示了肿瘤内或肿瘤周围的血管断面影,或条状走形血管影,管腔粗细不均匀,走形不规则,部分管腔呈瘤样扩张,但在延迟扫描没有出现肿瘤周围假包膜样环形强化。
2.2 MRA检查结果 经静脉注射对比剂后,在冠状位动脉期、门静脉期或延迟期的原始图像中,肿瘤内或肿瘤边缘存在多条形态异常或明显扩张的血管样结构,这些血管样结构走形不规则。MIP重建图像清晰显示了这些血管在肿瘤内部或边缘走形,管腔粗细不均匀,但管壁完整,这些畸形血管汇入肝静脉分支或直接流向肝静脉并最终汇入下腔静脉(图1B、2C、2D)。无论在动脉期、门静脉期或延迟期均未见显示汇入门静脉或门静脉分支。直径>5.0cm的3处病灶肿块内增粗的异常血管为扩张的肝静脉分支,其它病灶在肿瘤的表面也显示了多条异常引流静脉,部分汇入肝静脉。
2.3 病理结果 切除的肿瘤边界清晰,直径3.0~14.0cm,肿块柔软伴灶性出血(图1C)。组织学上,肿瘤含多边形上皮细胞和梭形细胞、极少量的脂肪和厚壁血管(图1D)。在免疫组化方面,所有肿瘤细胞HMB-45表达阳性,部分肿瘤细胞SMA表达阳性,但CK和Heppar1均表达阴性,组织病理学诊断这些肿瘤为上皮样AML。

图1 女性,39岁。AML患者[A:横断位CT扫描动脉期显示肿块不均匀强化,横断位CT扫描门静脉期显示等密度肿块和肿块内粗大的异常肿瘤血管(箭头所示);B:MRA MIP重建显示肿块内粗大的异常肿瘤血管引流入肝静脉(箭头所示);C:手术切除的肿瘤边界清晰,直径5.5cm,肿块柔软伴灶性出血;D:镜下,肿瘤充斥着大量多边形上皮细胞,但没有脂肪成分,病灶中央有一厚壁血管]
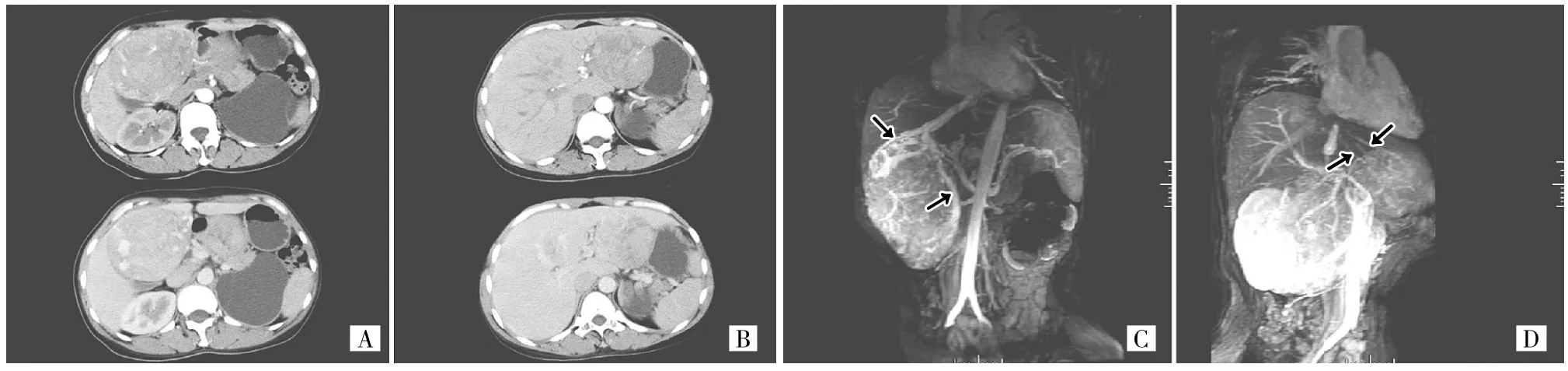
图2 女性,45岁。肝脏左、右叶AML[A:肝右叶病灶直径7.2cm;B:肝左叶病灶直径4.0cm,横断位CT增强扫描显示位于肝右、左叶病灶动脉期不均匀强化,相对于周围正常肝实质呈低密度;在门静脉期肿块内可见粗大血管;C:MRA MIP重建显示肝脏右叶AML病灶,肿块内及表面多发增粗的血管引流(箭头所示)汇入肝静脉;D:MRA MIP重建显示肝脏左叶AML病灶,见肿块表面多发血管(箭头所示)向下腔静脉方向引流]
3 讨论
AML最常见于肾脏,肾外AML最常见于肝脏。组织学上,典型的AML包括畸形的血管、大量成熟的脂肪细胞和平滑肌细胞,而上皮样AML几乎仅有大量的上皮细胞和明显的异常血管,脂肪细胞极少或没有[1];因其含有较多的肿瘤血管成分,强化方式多样,因此CT和超声检查难以在术前正确诊断。MRI反相位T1加权扰相梯度回波技术已广泛应用于检出肝脏病灶中的脂肪成分或评价肝脏内弥漫的脂肪浸润,但运用这项技术诊断AML方面仅有少量病例报道[2],并且报道亦指出当脂肪成分极少或少量脂肪与其它组织成分混合时,用此技术来显示脂肪信号的丢失仍有限度。本组患者虽未行反相位T1加权扰相梯度回波序列,但术后病理检查证实这些病灶只含极少量的散在脂肪细胞或没有脂肪成分,因此不能确定运用此项技术可以在术前检测到少量脂肪细胞的存在。
本组肝脏上皮型AML患者超声检查表现为不均匀等低回声肿块,其表现不具有特异性。近年来一些研究阐述了动态对比增强CT和MRI扫描对AML病灶的诊断意义[3-4],即动态对比增强CT/MR扫描表现为富血供病灶,动脉期明显强化,在门静脉期和延迟期依据肿瘤内血管成分多少呈相对等或低密度/信号灶。因此这些病灶在强化方式上难以与肝细胞肝癌相鉴别。本组患者5处AML病灶在CT平扫均未能发现脂肪,三期动态增强扫描亦符合上述表现。虽然患者没有乙肝或肝硬化病史,甲胎蛋白阴性,但是肝细胞肝癌不能完全排除。同时需要鉴别诊断包括动脉期均有明显强化并且呈持续强化的肝脏其它富血供肿瘤,如肝脏局灶性增生(FNH)、肝脏海绵状血管瘤等。
对于肝脏肿瘤的影像鉴别诊断,肿瘤的血流动力学评估也非常重要[5]。有文献报道肝脏AML的DSA显示肿瘤早期染色,供血血管增粗,呈卷发状或旋涡状,以上表现反映肿瘤血供丰富的特点,但是血管造影不能将AML与恶性肿瘤相鉴别,对AML诊断敏感但不具有特异性[4]。因此,评价肝脏AML的血流动力学特征也许有助于肝脏少脂肪成分或上皮样AML的准确诊断。Yasuhito等[6]探讨AML内部血管结构,发现早期静脉回流类似于肿瘤内动静脉瘘形成所致,且肝静脉引流有助于肝脏AML的诊断。组织学上无脂肪或不含脂肪成分的AML肿瘤内存在大量薄壁和厚壁血管,在横断位三期动态增强CT扫描中,本组患者均可见血管样结构,但是横断位CT图像不能非常清晰地显示这些血管样结构和肝静脉引流。至今尚无文献探讨MRA在AML与其它肝脏肿瘤鉴别诊断中的作用,而MIP重建MRA图像提供了观察肝脏AML血管结构的独特视角。本组患者均清晰显示了肿瘤血管引流入肝静脉,并且3处直径>5.0cm的病灶显示了肿瘤的引流静脉就是异常增粗的肝静脉及肝静脉侧支形成。可见,MRA MIP图像所显示的这些异常血管的表现和CT扫描所见相吻合,并且进一步清楚显示这些异常血管的走形及引流途径。
本组患者中,三期对比增强CT扫描和MRA的3D GRE原始图像中,无一例显示肝脏海绵状血管瘤具有的随时间推移呈渐进性填充的血管湖,也无在动脉早期显示与FNH类似的供血动脉由病灶中央向周围辐射状分布。因此,肝脏海绵状血管瘤和FNH也可被排除[7]。部分学者对肝细胞肝癌的引流血管作了详细研究。肝细胞肝癌的血管通常引流入门静脉,引流入肝静脉的只有1.8%[8-9]。在肝细胞肝癌病例中,门静脉内常有癌栓形成而受累,但是本组患者没有显示血管腔内侵犯,这些征象也有助于准确诊断肝脏AML。
总之,动态对比增强CT和MRA的MIP重建图像相结合有助于准确诊断肝脏AML,MIP重建图像提供了肝脏AML血管结构的更好的评价方法。
[1]Xu P J,Shan Y,Yan F H,et al.Epithelioid angiomyolipoma of the liver:cross-sectional imaging findings of 10 immunohistochemically-verified cases[J].World J Gastroenterol,2009,15(36):4576-4581.
[2]Zhao Y,Ouyang H,Wang X,et al.MRI manifestations of liver epithelioid and nonepithelioid angiomyolipoma[J].Journal of Magnetic Resonance Imaging,2014,39:1502-1508.
[3]Dai C L,Li P X,Li Y M,et al.Multi-slice computed tomography manifestations of hepatic epithelioid angiomyolipoma[J].World J Gastroenterol,2014,20(12):3364-3368.
[4]Lin J,Ji Y.CT and MRI diagnosis of hepatic epithelioid hemangioendothelioma[J].Hepatobiliary Pancreat Dis Int,2010,9(2):154-158.
[5]Wang S Y,Kuai X P,Meng X X,et al.Comparison of MRI features for the differentiation of hepatic angiomyolipoma from fat-containing hepatocellular carcinoma[J].Abdom Imaging,2014,39(2):323-333.
[6]Yasuhito I,Hidenori O,Hiroaki O,et al.Early venous return in hepatic angiomyolipoma due to an intratumoral structure resembling an arteriovenous fistula[J].Hepatol Res,2014,44(6):700-706.
[7]Liu Q Y,Zhang W D,Lai D M,et al.Hepatic focal nodular hyperplasia in children:imaging features on multi-slice computed tomography[J].World J Gastroenterol,2012,18(47):7048-7055.
[8]Jeon T Y,Kim S H,Lim H K,et al.Assessment of triple-phase CT findings for the differentiation of fat-deficient hepatic angiomyolipoma from hepatocellular carcinoma in non-cirrhotic liver[J].Eur J Radiol,2010,73(3):601-606.
[9]Arkadopoulos N,Yiallourou A I,Palialexis C,et al.Inferior vena cava obstruction and collateral circulation as unusual manifestations of hepatobiliary cystadenocarcinoma[J].Hepatobiliary Pancreat Dis Int,2013,12(3):329-331.
2013-11-21)
(本文编辑:严玮雯)
浙江省教育厅项目(Y200907521)
310003 杭州,浙江大学医学院附属第一医院放射科
彭志毅,E-mail:Pengzhiyi2010@163.com
