芫花-甘草配伍对雌性小鼠肝损伤的实验研究
2014-04-12王松原魏玉辉张国强武新安
王松原, 魏玉辉, 张国强, 武新安*
(1.兰州大学第一医院药剂科, 甘肃 兰州 730000; 2.兰州大学药学院, 甘肃 兰州 730000)
芫花-甘草配伍对雌性小鼠肝损伤的实验研究
王松原1,2, 魏玉辉1, 张国强1, 武新安1*
(1.兰州大学第一医院药剂科, 甘肃 兰州 730000; 2.兰州大学药学院, 甘肃 兰州 730000)
目的 观察不同比例的甘草、 芫花合用后对小鼠肝细胞膜转运体 Na+-牛磺酸钠共转运体 ( Na+/taurocholate cotransporting polypeptide, Ntcp) 表达的影响, 并探讨芫花-甘草配伍后所致肝损伤的可能机制。 方法 昆明种雌性小 鼠35 只, 随机分为 5 组, 分别灌胃给予生理盐水、 芫花水煎液、 甘草水煎液、 芫花-甘草 (1 ∶1) 混合煎煮药液、 芫花-甘草 (1 ∶3) 混合煎煮药液。 于给药 7 d 后, 取小鼠肝脏组织, 用 Western bloting法考察肝细胞膜 Ntcp 的表达, 用酶循环法检测肝细胞内总胆酸盐的水平, 用苏木精-伊红染色法 ( hematoxylin-eosin staining, HE法) 研究肝脏组织病理学变化, 将所得数据通过统计软件计算相关度。 结果 芫花-甘草配伍组肝细胞膜上 Ntcp 表达量与单位质量肝组织内胆汁酸盐 ( Total bile acid, TBA) 显著上升 ( P<0.05) 并伴有肝损害;Ntcp 表达量与单位质量肝组织内 TBA的水平呈显著正相关 (r=0.963), 与肝脏病理损害程度正相关 ( r=0.947)。 结论 芫花-甘草配伍后可显著升高小鼠肝细胞膜 Ntcp 表达, 引起 TBA肝内蓄积, 可能是导致雌性小鼠肝损害的原因之一。
配伍禁忌; 芫花; 甘草; 免疫印迹;Ntcp
传统医学将两味中药合用后产生毒性或使原有毒性增加的现象, 称为 “相反” 作用[1]。 “十八反” 是中药十八对配伍禁忌的总称, 源自 《神农本草经》 并被历代重要本草引用。“十八反” 常见的毒性之一是肝毒性, 而胆汁酸盐在肝内蓄积是药物导致肝毒性的常见形式[2]。 钠离子 /牛磺胆酸 共 转 运 蛋 白 ( Na+/taurocholate Cotransporting Polypeptide, Ntcp) 表达于肝细 胞 膜 上, 负 责 将 胆 汁 酸盐从血液转入细胞,其表达或功能变化均可影响胆汁酸盐的转运。
中药配伍禁忌在临床上倍受重视,但出于某些特定的治疗用途,从古至今一直有将相反药物配伍使用的方剂。芫花配伍甘草属于十八反之一,有报道指出该配伍迄今临床上仍短期大剂量用于堕胎等[3]。 研究证实甘草与芫花合用后对大鼠心、肝、肾脏组织有不同程度损害,以其所致的药物性肝损伤尤为常见[4]。 为此, 本实验拟通过研究芫花-甘草配伍给药后对小鼠肝脏 Ntcp 表达的影响, 从转运体角度阐明其肝损害机制。
1 仪器与材料
1.1 仪器 OLYMPUSAU400 全自动生化分析仪 (日本 OLYMPUS 光学株 式 会 社) ; 离 心 机 ( Allegra 64R Centrifuge BECKMAN COULTER);DYCZ-24DN型电泳仪 (北京六一仪器厂);DYCZ-40D转膜仪 ( 北京六一仪器厂); 低温高速离心机 ( 美国 Thermo公司) ;PVDF转移膜 ( GE Healthcare, 0.45 μm);X线胶片 (型号:XBT-1, 日本 Kodak 公司) ; 电泳凝胶 成 像 分 析 系 统 Image Quant350 ( GE Healthcare);LT-224S 电子天平 ( Sartorios BS400S) ; 微量进样器(宁波市镇海三爱仪器厂); 水平摇床 ( 型号 WD-9405B,北京六一实验仪器厂)。
1.2 试剂 芫花产自四川省德阳市, 甘草产自宁夏灵武市美康甘草基地,由甘肃省食品药品监督检验所宋平顺教授鉴定, 分别为瑞香科植物芫花 Daphne genkwa Sied.et Zucc.的干燥花蕾和豆科植物甘草 Clycyrrhiza uralensis Fisch.的干燥根及根茎,标本收藏于兰州大学第一医院药剂科实验室样品室。
PVDF膜 ( 美国 GE Healthcare公司, 0.45 μm) ;Rabbit polyclonal to SLC10A1 ( 美 国 Abcam 公 司, 批 号ab85611) ; β-actin 抗体 ( 武汉 博 士 的 生 物 工 程 有限 公 司,批号 BA2305); 二抗山羊抗兔 IgG/辣根酶标记 (北京中杉金桥生物技术有限公司, 批号 98609);PMSF(上海碧云天生物技术有限公司, 产品编号 ST506-2);RIPA裂解液(上海碧云天生物技术有限公司, 产品编号 P0013B); 定影液,显影液购自天津市南开区成信医用辅助材料厂。
2 试验方法
2.1 供试品制备 根据陈艳琰等的研究[5], 提取方法采用: 甘草称定质量后加入 15 倍量的蒸馏水, 浸泡 90 min 后煎煮, 以煮沸后 60 min 作为提取时间, 煮好药液冷却后用布氏漏斗过滤, 再将提取液用蒸发皿浓缩至1 mL(相当于原生药 0.375 g), 即为甘草水煎液。 芫花水煎液制备同上,质量浓度也为 0.375 g/m L。 芫花-甘草合煎液为生药按 1 ∶1和1∶3称定质量后混合, 其余制备方法同上, 药物总生药量为 0.375 g/m L。 即为小鼠 1 ∶1 灌胃水煎液和小鼠 1 ∶3灌胃水煎液。4℃储藏备用。
2.2 实验动物的分组及给药 雌性昆明种小鼠 35 只, 体质量 20 ~22 g, 购于兰州大学动物实验中心, 合格证号SCXK (甘) 2004-0006。 根据于大猛等的研究芫花-甘草临床常用剂量为 1 ∶1, 另根据陈艳琰等的研究芫花-甘草 1 ∶3时合煎液毒 性 成分总溶 出 率 最高[3,5]。 同时根 据 生 药总量不变原则。小鼠随机分成5组:对照组、芫花组、甘草组、芫花-甘草 1 ∶1 合用组和芫花-甘草 1 ∶3 合用组, 每组 7只。各组分别灌胃给予生理盐水、芫花水煎液、甘草水煎液、 小鼠 1 ∶1 灌胃水煎液和小鼠 1 ∶3 灌胃水煎液 15 g/(kg·d)。 于灌胃 7 d 后处死, 取其肝脏组织。
2.3 病理检查 小鼠肝脏置于 10%甲醛溶液固定 24 h 后,经乙醇脱水、二甲苯透明、 石蜡包埋、 切片、 HE染色、 光学树脂封片,于光学显微镜下观察肝脏组织病理形态学变化。
2.4 蛋白免疫印迹 取小鼠肝脏 0.04 g, 液氮研磨后加入RIPA裂解液提取蛋白。 将处理好样品用 10%SDS 聚丙烯酰胺凝胶电泳分离, 电转移至 PVDF膜上。 含 5%脱脂奶粉的TBST缓冲液封闭 1 h, 分别加入 Ntcp (1 ∶3 000) , β-actin(1 ∶3 000) 一抗, 4℃孵育过夜, 分别加入二抗山羊抗兔IgG (1 ∶3 000), 室温摇床上孵育 90 min, ECL化学发光法发光显迹,经化学方法显影定影。
化 学 发 光 显 色 的 western blotting结 果 经 GE Image Quant350 电泳凝胶成像分析系统扫描后, 用 ImageJ 1.34 版本进行光密度分析,密度分析结果经内参蛋白校正,考察目标蛋白相对含有量的变化。
2.5 肝组织胆汁酸盐 (TBA) 检测 取肝组织 100mg, 剪碎, 加入 1 mL 75%乙醇溶液, 用组织匀浆器匀浆, 肝匀浆液 50 ℃孵育 2 h 后, 6 000 ×g 离心 10 min, 取上清 0.05 mL, 备用。 按照胆汁酸酶循环法检测试剂盒操作标准测定样品 TBA水平。
2.6 统 计 学 处 理 利 用 SPSS 19.0 for Windows XP统 计 软件, 计量资料采用表示。 对小鼠肝脏病理分级组间比较采用 Ridit分析, 其余同一指标组间比较采用 t检验; 两指标间关系采用 Spearrman 秩相关分析, 检验水准α=0.05。
3 结果
3.1 肝脏转运体 Ntcp 的表达 肝细胞膜转运体 Ntcp 的表达见图 1。 与对照组相比, 芫花和甘草合用组 Ntcp 的 表达均有明显升高 (P<0.05), 其中芫花-甘草 (1 ∶1) 合用组显著上升 (P<0.01) 。 单给芫花和甘草对 Ntcp 的表达无显著影响 (P>0.1)。
3.2 肝组织病理检查 各组小鼠灌胃给药后肝组织病理变化见图 2。 对照组 ( 图 2A) 肝组织结构清晰, 肝细胞形态正常; 芫花组 (图2B) 部分肝细胞羽毛状变性, 坏死及肝窦扩张; 甘草组 ( 图 2C) 少量肝细胞水肿; 芫 花-甘草(1 ∶1) 合用组 ( 图 2D) 肝细胞弥漫水肿, 气 球样变 及颗粒样变,散在点灶状肝细胞坏死,炎症细胞浸润,散在肝细胞嗜酸变。 芫花-甘草 1 ∶3 合用组 (图 2E) 肝细胞弥漫水肿,气球样变,被膜下肝细胞弥漫羽毛状变性,散在肝细胞嗜酸变,散在肝细胞坏死,炎症细胞浸润。
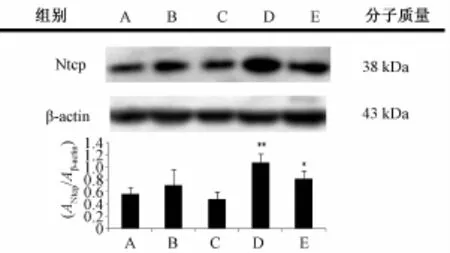
图 1 肝细胞膜转运体 Ntcp的表达 (n=7)
参考王明宇的方法[6], 根据实验各组肝组织变性情况的不同, 分为4级, “-” 肝细胞形态和组织正常, “+”肝细胞水肿,未见肝细胞坏死,“++”少许肝细胞坏死,炎细胞浸润。 “+++” 为点灶状肝细胞坏死,炎细胞浸润,细胞嗜酸变。
根据各组小鼠肝组织变性情况进行半定量分析,结果表明,对照组肝脏结构基本正常;单用甘草组对肝细胞无明显影响; 单用芫花组对肝细胞有损伤; 芫花-甘草 (1 ∶1) 合用后对细胞损伤明显增加; 芫花-甘草 (1 ∶3) 合用后比(1 ∶1) 合用对细胞危害相对减轻。 经 Ridit分析, 各组间病理损害程度有显著的差异 (P<0.05), 见表 1。
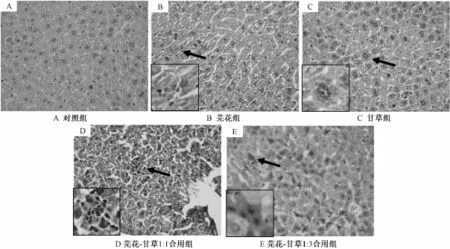
图 2 各组小鼠灌胃给药 7 d后肝组织病理变化图 ( ×400 HE)
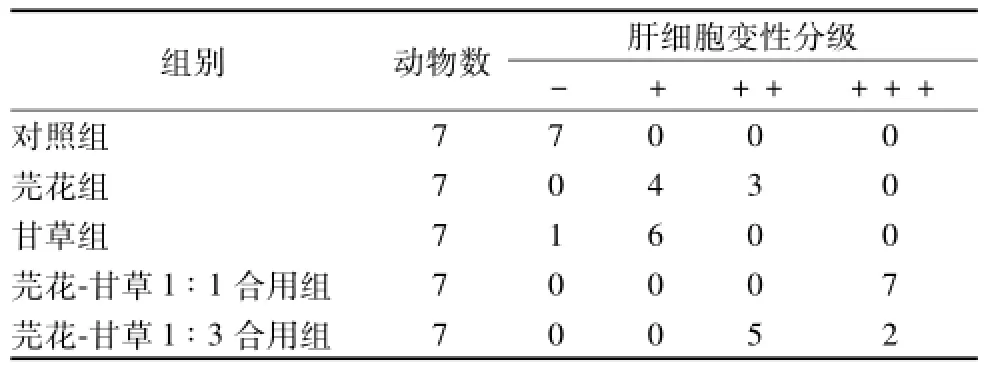
表1 小鼠肝脏组织变性半定量分析结果
3.3 肝组织 TBA水平检测 各组肝细胞 TBA积累量见图3。 与对照组相比, 除甘草组轻微下降外 (P>0.1), 各组均有上升。 其中芫花组与芫花-甘草 (1 ∶1) 合用组有显著上升 (P<0.05)。 芫花-甘草 (1 ∶3) 合用组也有轻微上升,但因为个体差异过大,而与对照组没有显著性差异。结果表明甘草能够轻度降低 TBA在肝细胞内的蓄积, 而芫花则相反, 可以增加肝细胞内 TBA的水平。 甘草和芫花合用后, 肝细胞内胆汁酸水平大幅上升, 造成严重的 TBA蓄积。 初步分析认为: 芫花-甘草 (1 ∶1) 合用后, 与其他各组相比, Ntcp 上升与 TBA蓄积现象明显加重。 病理检查结果也证明, TBA蓄积严重的小鼠其肝损害也较重 (见表2)。 由于甘草降低 Ntcp 和 TBA的肝保护作用, 芫花-甘草(1 ∶3) 合用时, 肝损害较 (1 ∶1) 组轻。 如芫花-甘草(1 ∶1) 合用组肝细胞水肿及细胞坏死遍布全肝, 芫花-甘草 (1 ∶3) 组仅限于血管周围; 芫花-甘草 (1 ∶1) 组胆小管增生较芫花-甘草 1 ∶3 组明显加重。
3.4 相关分析 Ntcp 值 为 曝光所得 Ntcp 蛋白 光 密 度值经内参蛋白矫正后的样品平均值 (见表 2)。 TBA值为单位质量肝脏组织内 TBA水平。 经相关分析结果显示, 在双侧置信度为 0.05 时, Ntcp 与 TBA为显著正相关 ( r=0.963,P=0.037), 与 病 理 损 害 程度正 相 关 ( r=0.947, P= 0.053), 病理分级与 TBA无显著相关性 (r=0.827, P=0.173)。 这说明小鼠肝脏内 Ntcp 的上升与 TBA的蓄积以及肝脏的病理损害存在直接联系。
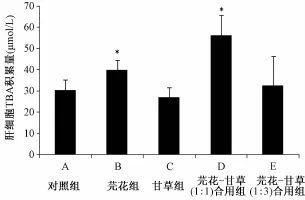
图3 肝细胞 TBA积累量
表 2 不同病理 分 级下小鼠 N tcp值 与 TBA (, n=7)
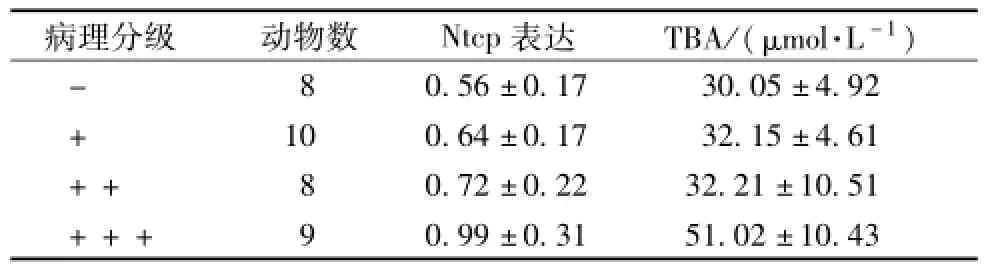
表 2 不同病理 分 级下小鼠 N tcp值 与 TBA (, n=7)
病 理分级 动 物数 Ntcp 表 达 TBA/( μmol·L-1)-8 0.56 ±0.17 30.05 ±4.92 + 10 0.64 ±0.17 32.15 ±4.61 ++ 8 0.72 ±0.22 32.21 ±10.51 +++ 9 0.99 ±0.31 51.02 ±10.43
4 讨论
研究结果表明,单独给予小鼠芫花或甘草水煎剂后,与对照组相比, 芫花对小鼠肝脏 Ntcp 表达有诱导作用, 甘草则为抑制作用, 但均未见明显的肝损伤。 给予芫花-甘草不同比例 (1 ∶1、 1 ∶3) 合煎剂后均可造成明显的肝损伤,其中以芫花甘草1∶1组最为严重。
Ntcp 转运体表达于肝细胞膜上, 负责将 TBA从血液摄入肝细胞。 TBA是胆汁的主要成分之一, 在肝脏中大部分以有机阴 离子形式 存 在, 对 肝细胞具 有 一定毒性[7-10]。 随着肝细胞内 TBA水平的增加, 肝细胞会逐渐发生病理变化直至凋亡[11-13]。 本实验中, 甘草-芫花配伍用药后, 随芫花比例升高, Ntcp 值与 TBA值同步升高, 致使肝损害程度增加。 当芫花甘草比例为 1 ∶1 时, 肝脏 Ntcp 表达升高最为显著 (0.99 ±0.31), 肝 细 胞 内 TBA的 蓄 积 也最 为 严 重(51.02 ±10.43 ) μmol/L。 由此可见, 芫 花-甘草配伍 后,随芫花比例的升高, 肝脏 Ntcp 的表达随之升高, 从而导致肝细胞内 TBA的过量蓄积, 可能是造成小鼠肝损伤的主要原因之一。
芫花-甘草配伍影响小鼠肝细胞 Ntcp 表达的具体机制尚不清楚。 有报道指出, 当肝细胞内 TBA升高或肝脏出现病理损害时,肝细胞核内的法尼酯衍生物 x受体将被激活,通过其信号通路影响下游基因转录与翻译, 抑制 Ntcp 表达以促进 TBA转运[14]。 但是, 这一现象在本实验中并不明显。 芫花-甘草配伍是否通过干扰该信号通路来影响 Ntcp 表达,有必要对其调控机制进行更深入的研究。此外,肝细胞中负责胆酸盐外排的 BSEP转运体的变化尚待进一步研究。
[1] 曹永生, 刘向红,陈爱萍, 等.相反中药的临床应用及研究概况[J].中成药, 2001, 23(11):847-849.
[2] 任 可, 徐 灿,金震东, 等.熊去氧胆酸治疗胆汁淤积性肝病研究进展 [ J].临床肝胆 病杂志, 2002, 18 (4 ): 199-201.
[3] 于大猛, 瞿 融.芫花甘草同方配伍研究概述与基层医院应用现状[J].中国实验方剂学杂志, 2011, 17 (21): 296-298.
[4] 衡晴晴, 徐 立.中药十八反 “藻戟遂芫俱战草” 的毒理学研究进展[J].中国实验方剂学杂志, 2013, 19(11): 348-352.
[5] 陈艳琰, 钱大玮,尚尔鑫, 等.基于化学成分相互作用探讨芫花与甘草配伍禁忌的机制[ J].药学学报, 2012, 47(8):1043-1048.
[6] 王明宇, 刘 强,车庆明, 等.灵芝三萜类化合物对3种小鼠肝损伤模型的影响[J].药学学报, 2000, 35(5): 326-329.
[7] 张国强, 周 燕,魏玉辉, 等.茵栀黄颗粒对胆管结扎大鼠肝细胞膜转运体 Mrp2, Ntcp 及 Bsep 表达的影响[ J].中成药, 2012, 34(9):1644-1648.
[ 8 ] Trauner M, Boyer JL.Bile salt transporters:molecular characterization, function, and regulation[ J] .Physiol Rev, 2003, 83(2):633-671.
[ 9 ] Wei Y, Zhao L.Passive lung-targeted drug delivery systems via intravenous administration[ J] .Pharm Dev Technol, 2013(10) : 1-8.
[10] 熊筱娟, 肖小华, 徐丽英.乌索酸对小鼠急性免疫性肝损伤的影响[J].中成药, 2005, 27(11):1352-1354.
[11] 陈夏娟, 徐 立, 余 果, 等.海藻, 芫花反甘草的研究进展[J].中草药, 2012, 43(5):1024-1027.
[12] 胡瑞德.病理学[ M].北京: 人民卫生出版社, 2000: 285-370.
[13] Li D, Sun J, Sun H, et al.Bile salt induces apoptosis of hepatocytes:themechanism of hepatic function injury during obstructive jaun dice[ J] .Chin JSurg, 1998, 36(10) :62.
[14] Landrier JF, Eloranta JJ, Vavricka SR, etal.The nuclear receptor for bile acids, FXR, transactivates human organic solute transporter-αand-βgenes[ J] .Am J Physiol Castrointest Liver Physiol, 2006, 290(3) :G476-G485.
R285.5
:B
1001-1528(2014)12-2605-04
10.3969/j.issn.1001-1528.2014.12.037
2013-09-16
王松原 (1987—), 女, 硕士研究生, 研究方向: 临床药学。 Tel:18293154230, E-mail:w.songyuan@gmail.com
*通信作者: 武新安 (1962—), 男, 教授, 博士生导师, 研究方向: 药物间的相互作用与转运体的关系。 Tel: (0931) 8616392, E-mail:xinanwu6511@163.com
