液固压缩技术运用于难溶性中药的前景展望
2014-04-12李小芳罗丽佳冉茂莲向志芸
罗 丹, 李小芳, 罗丽佳, 罗 佳, 冉茂莲, 余 琳, 向志芸, 刘 肖
(1.成都中医药大学药学院, 四川 成都 611137; 2.中药材标准化教育部重点实验室 四川 成都 611137;3.中药资源系统研究与开发利用省部共建国家重点实验室培育基地, 四川 成都 611137)
[综 述]
液固压缩技术运用于难溶性中药的前景展望
罗 丹, 李小芳*, 罗丽佳, 罗 佳, 冉茂莲, 余 琳, 向志芸, 刘 肖
(1.成都中医药大学药学院, 四川 成都 611137; 2.中药材标准化教育部重点实验室 四川 成都 611137;3.中药资源系统研究与开发利用省部共建国家重点实验室培育基地, 四川 成都 611137)
中药制剂存在难溶性有效成分或有效部位的生物利用度低的问题,限制了其口服吸收。随着增溶新技术、新方法的不断涌现,针对生物药剂学分类系统Ⅱ类药物低溶解性、高渗透性的特点,液固压缩技术成为增溶的一种新颖和有潜力的方法。该技术是将药物溶解于液体赋形剂中,再与适当的载体和涂层材料转化成具有良好流动性和可压性的粉末。目前,国外对该技术的研究较多,国内较少,一般运用于改善难溶性化学药和生物制剂的溶解度和溶出度,在中药增溶领域运用很少。因此,液固压缩技术为提高中药难溶性药物的溶解度和溶出度提供了新的思路和方法。随着新辅料的开发和该技术自身的优势,为运用于中药增溶领域,指导液固压缩制剂的工业化大生产提供依据。
中药难溶性药物;液固压缩技术;溶出度;溶解度
中药制剂新技术、新方法,如固体分散技术、自乳化、环糊精包合技术、微囊化等均可提高中药难溶性药物的溶出度和生物利用度。但在实际应用中具有一定的局限性:如固体分散技术的稳定性问题,长时间储存易老化、析出结晶、药物溶出度降低;自乳化传递系统载体各组分为了产生有效的自乳化,只有特定组合才行,需要大量筛选处方且高浓度的表面活性剂会对胃肠道产生刺激性等[1]; 环糊精包合技术会限制客体分子大小,并且水中溶解度较低[2]。 不同种类的药物运用不同的制备技术都有其优势和局限。 针对生物药剂学分类系统 ( Biopharmaceutics classification system, BCS) Ⅱ类药物低溶解性、 高渗透性的特点,一种名为液固压缩技术的新技术将有更广阔的前景,并对符合 BCS Ⅱ类特性的中药有效成分或有效部位也将有探索性的应用价值。
液固压缩技术 ( Liquisolid technique) 即溶液粉末 化技术,是将水难溶性药物溶解在具有非挥发性液体赋形剂中,再与适宜的载体和涂层材料混合均匀使之转化成具有非黏性、良好流动性和可压性的粉末,其药物以固体难溶性药物或液体脂溶性药物的形式存在于液体赋形剂中[3]。 相对于高载药量难溶药物,将低载药量难溶药物作为模型药物更为理想。并且,药物一般以分子或无定形状态溶解在液体赋形剂中。相对于其他增溶新技术,液固压缩技术有其自身独特的优势:一般传统辅料即可,如微晶纤维素、淀粉、乳糖等;液压制剂的生产成本一般低于软胶囊,所用的仪器相对简单;液压缓释制剂相对于渗透泵片具有更恒定的溶出速率;液压速释制剂相对于普通制剂,药物在体内外的释放速率都有明显增加[4]。
1 液固压缩理论[5]
为了计算出最佳的液固压缩制剂的载体和涂层材料的用量, Spireas首先提出数学模型液固压缩系统。 其中, 有两个重要参数:R值和药液比, 其他还包括可流动性 (Φ)和可压缩性 (Ψ) 的液体保留势。 因载体材料 (Q) 和涂层材料 (q) 具有吸收一定液体的性质, 载体材料 (Q) 吸收非挥发溶剂 (W) 的最大量被定义为液体负载因子(Lf), 其为影响载药量的重要因素。 载体材料和涂层材料的质量比称为R值,即:

φCA为载体材料对非挥发性溶剂的最大保留势能, φCO为涂层材料对非挥发性溶剂的最大保留势能,液体负载因子(Lf) 又可用以下公式表示:

ΦCA和 ΦCO值为衡量, 属于辅料的特有性质, 可通过测定载体材料和涂层材料的滑动角确定,R值为实验参数,带入公式 (3) 求得 Lf, 再将实验所需的溶剂质量 ( W)和实验中的 R值分别带入公式 (1)、 (2) 即可求得最佳载体和涂层材料量。
2 辅料的选择
2.1 液体赋形剂 选用的液体赋形剂一般为非挥发性、 无毒溶剂。为了提高药物在液体赋形剂中的溶解度而达到速释的效果, 常使用 1,2-丙二醇、 聚乙二醇 400 ( PEG400)和聚山梨酯 -80 ( Tween-80) 等辅料[6]。 为了使药物在液体赋形剂中达到缓释的效果, 常使用 Tween-80 作为液体赋形剂。
2.2 载体 选用的载体主要为多孔材料, 可提供足够的吸附性能[7]。 根据不同的释药机制, 可分为速释载体和缓释载体。 速释载 体有不 同级别的微 晶纤维素 ( 如 PH-101、PH-102 和 PH-200)、 淀粉、 乳糖等, 缓释载体一般为丙烯酸树脂类 ( 如 Eudragit RL和 Eudragit RS) 。 基于载体 对液体的负载能力以及与液体系统混合后形成的粉末的良好流动性和可压性, 可对载体进行筛选[8]。
2.3 涂层材料 为了将湿的混合物包覆成具有良好流动性、可压性的干燥粉末,涂层材料一般选用细而多孔、吸附性强的辅料。一般无定形的微粉硅胶是比较理想的涂层材料[9]。
2.4 添加剂 添加剂可以改善因载体材料和涂层材料增加片重的情况,提高载药量,并且某些添加剂可以显著增大药物的释放,例如一些低黏度聚合物:羟丙基甲基纤维素(HMPCE3 LV), 聚乙烯吡咯烷 ( PVP K25), 聚乙二醇(PEG6000) 等, 均能一定地提高药物的溶出速率。 为了延长药物的释放,不同规格的聚合物可以使用,即丙烯酸树脂 RS 和 RL、 瓜尔豆胶、 黄原胶、 羟丙基甲基纤维素( HPMC K4M) 等[9-11]。 马志超等[6]认为液固压缩片的缓释处方中添加一定量的 HPMC E4M可明显提高药物释放度 (P<0.05)。
3 液固压缩制剂的制备
液固压缩制剂的制备:筛选合适的液体赋形剂,将药物溶于其中, 再确定药物溶液的质量 (W); 选择合适的载体和涂层材料,通过液固压缩数学模型计算出载体和涂层材料的比值 (R), 算出载体和涂层材料的最优用量; 用载体材料吸收液体系统制成湿颗粒,最后再加入吸湿性强的涂层材料使湿颗粒转化成表面干燥,具有良好流动性和可压性的干粉。可根据制备的需要在干粉中加入崩解剂、矫味剂和泡腾剂等,最后按照传统压片工艺压制成片剂、或装胶囊即可[3](见图 1)。 近年来, 国外对固液压缩技术运用到难溶药物增溶方面的研究较多, 制成如辛伐他汀[11]、卡马西平[12]、 呋塞米[13]等 液固压缩 片, 但 无 相关产品上市,而国内研究较少,将该技术运用到中药增溶方面更是稀缺。
3.1 液固压缩制剂处方的筛选 一般对液固压缩制剂中的辅料和药液比、R值两个参数进行筛选,同时以休止角、卡尔指数和豪斯纳比以及溶出度为考察指标,优选出最佳的制剂处方。 如 Rania等[14]将丙二醇 ( PG) 作为液体赋形剂、 微晶纤维素 PH-102 为载体材料、 微粉硅胶为涂层材料, 考察药液比和 R值两个变量, 法莫替丁在 PG中以10%、 20%、 30%的量作为药液比, 微晶纤维素 PH-102 与微粉硅胶的比值从 5 到 50, 考察不同法莫替丁液固压缩处方的溶出度,结果所有测试的法莫替丁液压片比普通片剂表现出更高的溶出度, 选定的最佳配方在前 10 m in 药物释放达 78.36%, 高于普通片剂 39% 的 释 放 量。 Mazen El-Hammadi等[15]采用液固压缩技术降低 pH值的变化对氯雷他定溶出度的影响, 从丙二醇、 吐温 80 和聚乙二醇 400 中筛选液体赋形剂,发现氯雷他定在丙二醇中溶解度最大。将丙二醇作为液体赋形剂, R值为 20, 考察质量分数为5%、 10%、 20%3 个药液比对药物释放的影响, 筛选最佳处方。结果液固压缩片的溶出度显著高于市售的普通制剂并且受pH值变化的影响很小。
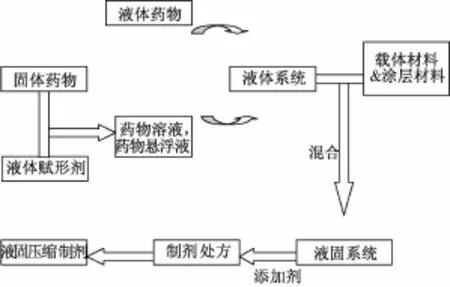
图1 液固压缩制剂制备工艺流程图
3.2 速释液压片的制备 Patel等[16]以格列吡 嗪为模 型药物, 二氧化硅和微晶纤维素 PH102 作为载体和涂层材料,聚乙二醇 400 作为液体赋形剂。 将药物以溶液或悬浮液加入聚乙二醇 400 中, 对粉体的结构和加入的液体量对最后混合物的流动性和可压性影响进行了研究,此外还考察了不同涂层材料和药物浓度对药物溶解状态的影响。结果制得的格列吡嗪比普通制剂有更显著的体外释放度,当格列吡嗪溶解在聚乙二醇 400 中时, 有最大的释放。 格列吡嗪液压片的高溶解速率显示液固压缩技术能提高其口服生物利用度。 Rikisha等[17]为 了 提 高 厄 贝 沙 坦 的 溶 解 度, 利 用液固压缩技术将其制成液压片,对采用不同比例载体 (微晶纤维素 PH102)、 涂层材料 (CAB-O-SILM5)、 液体赋形剂 (PEG400) 的液压片的硬度、 脆度和崩解时限进行评估, 根据美国药典 (USP) 方法决定其溶出曲线并和直压片对比,确定液固体系统可接受的流动性和可压缩性。结果, 在 60min 内, 所有液固体片剂的配方表现出超过 90%的释放度,得出结论,液固压缩技术可有效提高格列吡嗪的溶解度和溶出速率。
3.3 缓释液压片的制备 Javadzadeh 等[18]根据盐酸普萘洛尔仅有3 h的消除半衰期的性质,将其制备成缓释液压片,以达到控制其释放速度的目的。优选出具有最佳溶解度的聚山梨酯 80 作为 液 体赋形剂, Eudragit RL和 Eudragit RS作为载体材料, 硅胶作为涂层材料, 并在两个 pH值 (1.2和 6.8) 对药物浓度的影响、 负载系数、 热处理和盐酸普萘洛尔液压粉末释放曲线进行了考察。结果,相对于普通缓释片剂,盐酸普萘洛尔缓释液压片表现出更大的延迟性能,并且还显示,湿法制粒在盐酸普萘洛尔液体压缩的释放速率上有显著的影响。动力学研究显示,大部分的液固体制剂遵循零级释放模式。 Nokhodchia等[19]制备茶碱缓释液压片, 采用丙二醇、 聚山梨酯 20、 聚山梨酯 80、 PEG 200、 PEG 600 等液体赋形剂, 以 Eudragit RL或 Eudragit RS为载体, 硅土做涂层材料, 并对不同用量的 HPMC对缓释速率的影响进行考察,结果丙二醇等助溶剂对释药速率有一定的调节作用。同时与普通缓释片对比,液固压缩技术制得的缓释片反过来可增强 HPMC的缓释作用, 体外释药实验显示茶碱液固压缩缓释片为零级释药。
4 增溶机理[20]
根据 “ Noyes-Whitney” 方程 和 “ 扩 散 层溶 模 型 ” 溶出理论,可对液固压缩技术的增溶机理进行探索性的解释。药物的溶出度 (DR)
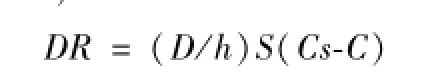
溶出介质包围在药物粒子周围形成停滞的扩散层,h为扩散层的厚度,D为药物分子穿过扩散层的扩散系数,S为药物溶出有效表面积, C为药物在溶出介质中的浓度, Cs为药物在溶出介质中的溶解度。因在所有的溶出度实验中,处方都是在一个恒定转速和相同的溶出介质中测定,我们可以合理的假定扩散层厚度h和药物分子的扩散系数D几乎保持相同,这时,溶出度不仅和药物在梯度扩散层中的浓度成正比, 还和药物溶出有效表面积成正比[21-24]。
4.1 增加药物溶出有效表面积 如果在液固系统里的药物完全溶解在液体赋形剂中,药物粉体处于一种溶解的、分子分散状态。因此,药物释放时接触的表面积远远大于普通直压片, 继而药物溶出度显著提高。 Emmadi等[25]将美洛昔康制备成速释液压片,对其药物的存在形态进行了考察,发现美洛昔康以分子状态均匀分散在辅料中,增加溶解度的主要原因为药物溶出时增大的表面积。
4.2 增加药物的溶解度 除了第一种提高药物释放的机制,增加药物的溶解度也是一种具有潜力的增溶途径。液固系统中,药物溶解度可能在微环境中得到提高。事实上,为了增加药物在整个溶出介质中的溶解度,将药物溶解在相对少量的液体赋形剂中是远远不够的。然而,当把助溶剂同时也作为液体赋形剂使用时,在液固系统的药物粒子和溶出介质之间的接触面这种微环境中,助溶剂就足够增加药物的溶解度[14]。 Kasture等[26]根据兰索拉唑在肠 道内的溶解速率为口服吸收率的主要限速因素的特点,采用固液压缩技术将兰索拉唑制备成液压片,在模拟肠道的体外释放度实验中显示,兰索拉唑的溶解度增加,药物的释放曲线显著提高。
4.3 增加药物润湿性 当液体赋形剂作为表面活性剂使用时,其低的表面张力提高了药物粒子的润湿性,使水分借助毛细管作用迅速深入到片剂的内部,致使片剂快速崩解[27]。 通过对接触角和崩解时限的测定, 固压缩系统的润湿性已经被证实。不同的液体赋形剂、载体材料和涂层材料被用于制定这些药物的传递系统。 Karmarkar等[28]采用液固压缩技术制备非诺贝特液压片,考察其溶出曲线发现:非诺贝特液压片的润湿性和药物释放表面积的增加为其增溶机制。
5 评价方法
5.1 相容性研究 差示扫描量热法 (DSC) 和傅里叶变换红外光谱 (FTIR) 被用来研究药物和液体赋形剂之间的物理化学相互作用,揭示制剂的相容性。
5.2 药物粒子形态的测定 X射线衍射和 DSC被用来研究药物和液体赋形剂之间任何复杂的形成和在制造过程中任何晶型的变化, 而扫描电子显微镜 (SEM) 可以显示在制造过程中的液固系统中药物存在的形态。
5.3 压缩前评估 为了获得均一和具有良好重现性的片剂填充物,药物制剂的产品中粉末的流动性是至关重要的,否则,在高剂量下流动性将发生变化。为了使液固系统具有良好的流动性和可压性,该系统将被压制成片,并对其进行评估,一般用休止角、卡尔指数和豪斯纳比作为评价指标。
5.4 压缩后评估 压缩后将从片剂的均一性、 硬度、 重量差异、碎脆度、崩解时限、体外溶出度实验等方面进行再评估。 Santosh 等[29]通过对堆密度、 卡 尔 指 数、 豪 斯 纳 比和休止角的测定,将制备的厄贝沙坦液固系统进行流动性的评估。 DSC和 XRD的结果都表明厄贝沙坦制备成液固系统后的结晶损失。结果显示,与直压片和普通市售片相比,液固系统具有更高的溶出度。
6 在中药制剂中的前景展望
目前,难溶性药物的数量还很多,尤其是天然药物中的有效成分多为难溶性成分,药剂学领域的一些方法和技术只能在一定程度和范围内改善其溶解度,只有在药物设计阶段通过结合化学方法和手段进行结构改造与结构修饰,才能大大提高新化学实体 (NCE) 成为新药的可能。 在中药有效成分筛选过程中,很多体外药理活性很高的成分难溶,要制成适宜的溶液剂或生物利用度高的固体制剂,必须设法增加其溶出度[7], 如有效成分: 穿心莲内酯[30]、 葛根素[31]、 姜黄素[32]等, 有 效 部位: 玳玳果 黄 酮[33]、 水飞蓟素[34]、 葛根总 黄 酮[35]等。 因此, 液固 压 缩 技 术为提高中药难溶性成分的溶解度提供了一种新思路和发展方向。
另一方面,中药因成分复杂给提取分离带来很大的困难,得到的有效成分和有效部位的剂量可能较大。将液固压缩技术运用到中药增溶的技术难点在于载体材料所能负载的液体量受限,高剂量的中药提取物会增加整个制剂重量。但随着新型辅料的发展和技术的日益成熟,这一问题可以逐渐得以解决。目前,改善制剂重量、提高载药量的方法有两种, 都是通过增加液体负载因子 (Lf) 来完成[3]:一种是采用具有高比表面积特性的载体和涂层材料增大Lf值, 辅料的比表面积越大, Lf值就越高, 新型辅料硅酸铝镁具有此特性,当其作为载体材料时,可有效节省辅料,减少制剂重量。另一种是在液体赋形剂中加入不同的添加剂来增大 Lf值, 如 PVP、 HPMC、 PEG3500、 MCC等均可一定程度减少制剂量。
因此,将液固压缩技术运用到增加中药难溶性成分的溶出度上具有一定的理论可行性,并且由于其自身有生产成本低、仪器要求不高、采用传统辅料等优势,给实际大生产应用及新技术的推广提供了可能。但将液固压缩技术运用到中药增溶方面还需要大量的实验研究和数据支持,用液固压缩理论指导中药的增溶研究还需要进一步的验证和考察,将理论和实践相结合还有很长的路要走。
[1] 冯耀荣, 程巧鸳,李范珠.自乳化药物传递系统的研究进展[J].国际药学研究杂志, 2007, 34(4):280-284.
[2] 毛彩霓, 何伟, 程合丽.中药制剂工艺中新技术应用进展[ J] .食品与药品 A, 2006, 8(2) :9-13.
[3] 李丽然, 王成港,郭 红, 液固压缩技术在药剂学中的应用[ J] .现代药物与临床床, 2012, 27(3) :283-286.
[ 4 ] Sambasiva R A, Naga Aparna T.Liquisolid technology:An overview[ J] .Int J Res Pharm Biomed Sci, 2011, 2(2):401.
[ 5 ] Kavitha K, Kotha Lova Raju N S, Ganesh N S, et al.Effect of dissolution rate by liquisolid compact approach:An overview[J] .Der Pharm Lett, 2011, 3(1) :71-83.
[6] 马志超,胡雄伟,宋洪涛.液固压缩技术在药物制剂中的应用进展[J].解放军药学学报, 2012, 28(1):81-82.
[7] 赵霞,孙会敏.自乳化释药系统与液固压缩技术联合开发难溶性药物新剂型的进展[J].药物分析杂志, 2012, 32(9):1697-1703.
[ 8 ] Javadzadeh Y, Musaalrezaei L, Nokhodchi A.Liquisolid technique as a new approach to sustain propranololhydrochloride release from tabletmatrices[ J] .Int JPharm, 2008, 362 (1 ) : 102-108.
[ 9 ] Saadia Tayel A, Iman Soliman I, Dina L., Improvement of dissolution properties of Carbamazepine through app lication of the liquisolid tablet technique[ J] .Eur J Pharm Biopharm,2008, 69(1):342-347.
[10] Javadzadeh Y, Jafari-Navimipour B, Nokhodchi A.Liquisolid technique for dissolution rate enhancement of a high dosewaterinsoluble drug( carbamazepine) [ J] .Int J Pharm, 341(1/2) :26-34.
[11] Kudikala S, Reddy G J.Formulation and evaluation of Simvastatin liquisolid tablets[ J] .Der Pharm Lett, 2011, 3 ( 2 ): 419-426.
[12] Javadzadeh Y, Musaalrezaei L, Nokhodchi A.Liquisolid technique as a new approach to sustain propranolol hydrochloride release from tabletmatrices[J] .Int JPharm, 2008, 362(1/2) :102-108.
[13] Akinlade B, Elkordy A A, Essa E A, et al.Liquisolid systems to improve the dissolution of furosemide[ J] .Sci Pharm,2010, 78(2):325-344.
[14] Rania F H., Mohammed K A.Enhancement of famotidine dissolution rate through liquisolid tablets formulation:in vitro and in vivo evaluation[ J] .Eur JPharm Biopharm, 2008, 69(3) : 993-1003.
[15] Mazen H E, Nisrine A.Investigating the use of liquisolid compacts technique tominimize the influence ofpH variationson loratadine release[ J].AAPS Pharm Sci Tech, 2012, 13 ( 1 ) : 53-58.
[16] Patel V P, Patel N M.Dissolution enhancementof glipizide using Liquisolid tablet technology[ J] .Indian Drug, 2008, 45(4) :318-323.
[17] Rikisha B, Anuradha P, Hetal D, et al.Formulation and evalution of irbesartan liquisolid tablets[ J].Int J Pharm Sci Rev Res, 2011, 9(2):32-37.
[18] Javadzadeh Y, Musaalrezaei L, Nokhodchi A.Liquisolid technique as a new approach to sustain propranolol hydrochloride release from tabletmatrices[ J] .Int JPharm, 2008, 362(1/2) : 102-108.
[19] Nokhodchia A, Aliakbara R, Desaia S, et al.Liquisolid compacts:The effect of cosolventand HPMC on theophylline release[ J].Biointerfaces, 2010, 79(1) :262-269.
[20] Vijay kumar N, Ramarao T, Jayaveera K N.Liquisolid compacts:A novelapproach to enhance bioavailability of poorly soluble drugs[ J] .Int JPharm Biol Sci, 2011, 1(3) :89-102.
[21] Nokhodchi A.The effect of type and concentration of vehicles on the dissolution rate of a poorly soluble drug( indomethacin)from liquisolid compacts[ J] .J Pharm Pharm Sci, 2005, 8(1):18-25.
[22] Javadzadeh Y, Siahi-Shadbad M R, Barzegar-Jalali M, et al. Enhancement of dissolution rate of piroxicam using liquisolid compacts[ J] .IL farmaco, 2005, 60(4):361-365.
[23] Spireas S, Sadu S, Grover R.In vitro release evaluation of hydrocortisone liquisolid tablets[ J] .J Pharm Sci, 1998, 87(7):867-872.
[24] Spireas S, Sadu S.Enhancement of prednisolone dissolution properties using liquisolid compacts[ J].Int J Pharm, 1998,166(2):177-188.
[25] Emmadi S, Sanka K, Potu A R, et al.Formulation and pharmacodynamic evaluation of meloxicam liquisolid compacts[ J] . Lat Am JPharm, 2010, 29(8) :1303-1310.
[26] Kasture SV, Gondkar SB, Darekar A B, et al.Enhancement of dissolution rate of lansoprazole using liquisolid tablet technique[ J] .Int JPharm, 2011, 3(2) :27-31.
[27] 赵许杰, 闫雪生, 徐新刚, 等.液固压缩技术速释 α-细辛脑的机制探讨[J].中国实验方剂学杂志, 2013, 19(14): 56-58.
[28] Karmarkar A B, Gonjar ID, Hosmani A H, et al.Dissolution rate enhancementof fenofibrate using liquisolid tablet technique[J].Lat Am JPharm, 2009, 28(2):219-225.
[29] Santosh P, Aparna C, Srinivas P, etal.Enhancement of dissolution of irbesartan using liquisolid technology[ J].Int JPharm Technol, 2012, 4(1) :3811-3824.
[30] 何国林, 王羚郦, 李庆国.穿心莲内酯固体分散体的制备[J].云南中医中药杂志, 2013, 34(6):53-55.
[31] 谢 捷, 杜君琛, 朱兴一, 等.磺丁基醚-β-环糊精对葛根素的增溶作用及其包合物的研制[J].中成药, 2012, 34(3):454-458.
[32] 韩 刚 , 王传胜, 张 永, 等.固体分散体提高姜黄素溶出度的研究[J].中国中药杂志, 2007, 32(7):637-638.
[33] 邱红鑫, 陈 丹, 吴晓青.玳玳果黄酮滴丸的溶出度及速释机 制 [ J].中 国 医 院 药 学 杂 志, 2011, 31 (18 ): 1495-1499.
[34] 张永丽, 郑清娉, 张卫华.益肝灵分散片的质量标准研究[J].中国实验方剂学杂志, 2009, 15(10):20-23.
[35] 蔡 垠, 贾晓斌 , 成旭东.制备工艺与葛根黄酮微丸性状、溶出 度 的 关 系 考 察 [ J]. 中 成 药, 2008,, 30 ( 6 ): 842-844.
R943
:A
1001-1528(2014)12-2587-05
10.3969/j.issn.1001-1528.2014.12.032
2013-11-12
四川省教育厅项目 (13ZB0315)
罗 丹 (1989—), 女, 硕士生, 研究方向: 中药新剂型及新技术。 Tel:13438024307, E-mail:929145900@qq.com
*通信作者: 李小芳 (1964 —) , 教授, 博士生 导师, 研 究方 向: 中药 新剂 型及新 技术。 Tel:13808195110 , E-mail:lixiaofang918@ 163.com
