1626W/O/O湿法纺丝制备去甲斑蝥素钠聚 L-乳酸纤维
2014-04-11李艳芹张亚秋
李艳芹, 王 浩, 刘 影, 张亚秋*
(1.辽宁医学院医学实验中心, 辽宁 锦州 121000; 2.辽宁医学院药学院, 辽宁 锦州 121000)
1626W/O/O湿法纺丝制备去甲斑蝥素钠聚 L-乳酸纤维
李艳芹1, 王 浩2, 刘 影2, 张亚秋2*
(1.辽宁医学院医学实验中心, 辽宁 锦州 121000; 2.辽宁医学院药学院, 辽宁 锦州 121000)
目的 考察 W/O乳液, 即 W/O/O体系下聚 L-乳酸湿法纺丝所得纤维对去甲基斑蝥素的包裹以及药物缓释的能力。 方法 以探头超声乳化法制备水相载去甲基斑蝥素钠的聚 L-乳酸二氯甲烷 W/O乳液, 在药物水溶液/聚 L-乳酸有机溶液体积比为 1 ∶9, 2 ∶8, 3 ∶7 条件下乳化后滴入异丙醇中快速磁力搅拌萃取二氯甲烷使纤维析出并缠绕, 光学显微镜观察纤维的内外形态并采用直径分布计算软件考察纤维直径的大小及分布, 广角 X-射线衍射法观察纤维表面药物结晶状况,差示热分析法考察纤维中药物与高分子材料的作用,采用磁力搅拌溶出法和高效液相色谱法考察纤维中药物的释放行为并进行 Highchi方程拟合。 结果 甲基紫染色后光学显微镜下发现, W/O/O纺丝体系下可以制备得到具有内芯为蜂窝状结构的纤维, 纤维直径平均值为 200 μm, 包裹在其中的去甲基斑蝥素钠具有缓释性且呈现 Higuchi方程行为。 纤维中载药量高时其释药速率也高, 蛋白酶 K加速药物的释放速率。 结论 W/O/O纺丝体系可以作为包裹在水中溶解度好,但是在某些高分子溶液中不溶药物的一种方法,为研究其他类型作用剧烈药物的缓释载体提供了参考。
去甲基斑蝥酸钠; 纤维; 湿法纺丝; W/O乳液; Higuchi释放
中药是有待人们继续研究开发的宝库,可以为当今仍未解决的疾病提供很多治疗思路,鞘翅目芫青科昆虫斑蝥Mylabris phalerata pallas的干燥成虫便是其 中一种。 李时珍的巨著 《本草纲目》 中称其性味辛、 寒, 有大毒, 能治疮疽、疥癣、瘰疬、疖毒等,有破血逐瘀、攻毒散结的功效[1], 现代研究表明其主要成分为斑蝥素 (图 1 a1), 对治疗肿瘤、皮肤病、白癜风及顽癣有一定疗效。斑蝥素毒性和刺激性较大, 将其 2 和 2'位甲基去掉后得到去甲斑蝥素(图 1 a2), 毒副作用明显减小, 但是仍存在水溶性差, 不能静脉注射[2]。 进一步研究制备了其水溶性好的钠盐 ( disodium norcantharidin, NC-Na, 图 1a)[3], 斑蝥 素钠的抗肿瘤谱比较广,除能够抑制小鼠腹水肝癌外,还能抑制小鼠肉瘤 S180, 宫颈癌 U14 等, 并且对病毒性肝炎亦有较好抑制作用,但是该药仍然存在血管和其他组织的刺激性问题,并且其 t1/2较短, 为 3.4 h, 所以有必要研究其 长效缓释尤其是原位 释 药 的 剂 型[4-10]。 去甲 斑 蝥 素的 特 点 虽 然水 溶,但是在许多有机溶剂中如卤代脂肪烃、脂肪醇中等溶解度差, 这启发可将其通过 W/O乳液方法将其包裹在某种药物释放体系中并通过载药材料的特性和组装结构对药物进行控制释放。 有人采用 W/O/W 乳液液中干燥法制备水溶性药物的中空微球,结果发现药物有释放较缓慢和不完全释放的现象, 可能是由于微球外壁过厚, 聚乙烯醇/成球高分子形成坚硬外壳等因素所致[10]。

图 1 斑蝥素 (a1), 去甲基斑蝥素 (a2) 和去甲基斑蝥酸钠 (a) 的化学结构图
纺丝是近十年研究较多的一种制备载药体系的技术,乳液静电纺丝法十分适合将水溶性但不溶于有机溶剂的药物包裹在 “ 芯 /核” 结 构 高 分子 纤 维 中[11-12], 但是 静 电 纺丝得到的纤维直径较细一般在 500 nm以下, 中空纤维的“壳” 层亦较薄, 一般在 200 nm以下, 导致药物突释甚至较快渗漏,湿法制备载药纺丝为解决这个问题提供了一个思路[13]。 湿法纺丝所得纤维较粗, 壳层亦较粗, 所以, 本实验首先制备内相为溶解 NC-Na的水溶液, 外相为水不溶高分子的 CH2Cl2的 W/O乳液之后将其注入另一种脂肪醇有机溶剂中萃取 CH2Cl2, 使高分子析出并形成内层载药的纤维。 实验中采用了生理相容且可降解的聚 L-乳酸 ( poly L-lactic acid, PLLA) 为成纤维和载药材料, 以 期能够成为在肝癌,肝腹水术后治疗中可以通过微创植入进行给药的理想剂型[8]。
1 仪器与材料
集热式水浴恒温磁力搅拌器 (浙江乐清县乐成仪器厂,DF-101B型); 型磁力搅拌恒温水浴 (上海黄海药检仪器有限公司, RYJ-6A型); 超声波细胞粉碎机 ( 上海新芝生物技术研究所, JY96-Ⅱ 型); 光 学显微镜 ( Olympus, CX31,分析软件 Anymicro DSSTMYT-5M Digital Shoot System); 广角X-射线衍射仪 (日本 Rigaku 公司, UltimaIV型) , 差示热分析仪 ( 美 国 Perkin Elmer公 司, Pyris Diamond 型) ; 高 效 液相色谱仪 (大连依利特分析仪器有限公司, UV-230+紫外-可见检测器, P-230 高压恒流泵, EC2000 色谱处理工作站,EAST全自动交流稳压器, 广东易事特电源股份有限公司);色谱柱 (Hypersil ODS, 4.6 mm×200 mm, 4.5 μm); Model100 柱 温 箱 ( CBL Photoelectron Technology) ; DHG-9240A型电热恒温鼓风干燥箱 (上海精宏实验设备有限公司); 纤维素微孔滤膜 ( Millipore, 0.8 μm) 。
去甲基斑蝥素钠 (沈阳药科大学有机化学教研室惠赠并成二钠盐[14], 纯度 >98%); 聚 L-乳酸 (Mw=20 万, 中国科学院长春应用化学研究所生物高分子材料组陈学思研究员惠赠); 二氯甲烷 (分析纯, 天津永晟精细化工有限公司); 正丁醇 (分析纯, 天津天力化学试剂有限公司); 异丙醇 (分析纯, 天津东丽区天大化学试剂厂); 甲醇 (色谱纯, 天津东丽区天大化学试剂厂); 去离子水 (1810-B型石英自动双重纯水蒸馏器, 江苏金坛宏华仪器厂)。
2 方法与结果
2.1 W/O乳液湿纺法制备含有 NC-Na的 PLLA纤维 纺丝步骤和原理如文献 [12-13], 在本实验中要首先采用探头超声法制备 W/O乳液, 纺丝装置如图 2。 将 NC-Na溶解在纯水中制备得到的饱和药物溶液作为水相, 将 PLLA溶解在二氯甲烷中作为油相,实验中采用的超声仪工作原理为在金属探头末端小孔中向外喷射高速气流并产生震荡。超声条件为功率为 500 w, 超声时间为 1 s, 间隔时间为 1 s, 每个样品超声50次。 一般制备乳液需要采用表面活性剂作为乳化剂, 但在本例中, NC-Na分子具有亲脂的带氧桥的环己烷结构,同时两个取代甲酸钠基团呈现强亲水性,这样整个分子具有两亲结构,实验中发现当采用金属探头对NC-Na水溶液/PLLACH2Cl2溶液进行高频率超声后会得到均匀的在 30min 内稳定的 W/O乳剂, 故没有在体系中引入其他表面活性剂,制备后体系内只有载体高分子和药物[15]。
在冰浴状态下, 内径约 10 cm的烧杯中内置异丙醇 200 mL, 磁力搅拌速度为 50 r/min, 搅拌子圆柱形, 直径为 0.6 cm, 长度为 2 cm, 将待纺乳液置于 30 mL注射器中, 注射器针尖置于异丙醇液面下 1 cm后挤出, 金属针头内径为 1 mm, 挤出速度为 50 μL/min。 这时会在烧杯中旋转的搅拌子上缠绕上一团白色较细的连续丝状物体,用金属镊子剥下后置于滤纸上将有机溶剂吸干,放置于真空干燥箱中50℃干燥至恒重后即得。 本实验原理为纤维中的 CH2Cl2向异丙醇中扩散, 异丙醇同时向乳液丝中扩散, PLLA逐渐析出成 “壳” 并将药物水溶液包裹在纤维中, 整个体系亦可以看成 W/O/O制备体系。 发现当载药水相与高分子有机溶液相的体积比为1∶9和2∶8时所得乳液黏度适当且可以纺出较细的丝, 当为3∶7时所得乳液黏度很大不容易从较细的金属针头中挤出,当从较粗的针头中挤出时也不容易拉出细丝。 分别将所得两种载药纤维命名为 F1/9 和 F2/8。
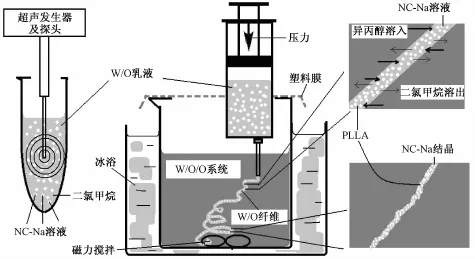
图 2 W/O/O纺丝法制备载 NC-Na 的 PLLA纤维的原理
2.2 NC-Na/PLLA纤维的表征
2.2.1 NC-Na纤维的形态及直径测量 光学显微镜下由W/O乳液纺丝所得纤维在光学显微镜下颜色较淡切边界不清晰, 但发现其可以用 10% ( w/v) 甲基紫染色且颜色经久不褪,所得图像边界清晰如图3所示,并且放大倍数后发现纤维内部有空泡状结构出现。纤维的形态采用图形定量分析软件对纤维的直径进行测量,并计算其平均直径和直径分布如表1所示。
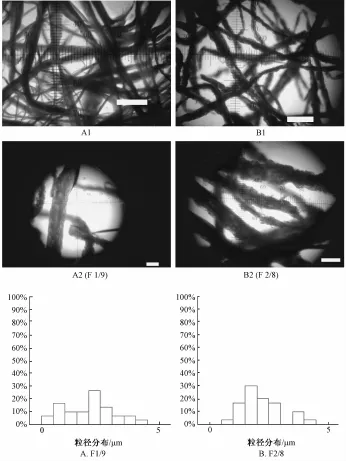
图3 所得纤维的光学显微镜下的整体及局部形态(A1, A2: F1/9, B1, B2: F2/8) 及纤维直径分布图, 白条长度代表 10 μm

表1 纤维的直径数据 (单位: μm)
2.2.2 NC-Na纤维中的 X-射线衍射图谱 检验纤维表面结晶状态, 可以此推断纤维上是否有 NC-Na析出, 以广角 X-射线衍射对纤维毡进行扫描[12], 其可以给出药物结晶的特征峰和纤维的衍射峰。如果药物没有包裹,包裹不完全或者在储存期间从纤维中析出,那么扫描结果上就会出现药物的特征结晶峰;如果药物较好的包裹或与高分子较好的结合,并成无定形状态则扫描图谱上仅会有衍射强度较弱的 “馒头” 峰出现。 当测试样品为药物晶体粉末时, 将粉末均匀铺在石英凹槽中,当测试样品为纤维时,将纤维团成线团状后轻压成薄片并用专用橡皮泥固定在石英凹槽上。室温下测试, 5°~85°扫描, 扫描速率 5°/m in, 结果见图 4。衍射图谱显示 NC-Na纯药粉末的结晶峰型在 5°~10°范围内有明显的高衍射强度的分叉峰, 此外在 10°~40°范围内也有很多特征峰, 当采用 W/O/O法进行纺丝将药物进行包裹后,相应的特征衍射峰发生了变形和衍射强度降低的现象,体现在 5°~10°范围内的分叉峰变成了单峰, 且衍射强度变低,随着载药量与高分子材料比的降低其衍射强度亦随之降低。 在 10°~40°范围内的很多特征峰也消失了, 仅留下若干小峰。 由于我们采用的 NC-Na的饱和溶液, 在第 1 步乳化和第2步溶剂萃取的过程中药物可能会在纤维表面有一定的存在,综合以上说明,采用此工艺纤维对药物有包裹作用, 但是纤维表面或许存在药物与 PLLA材料共同固化后产生的的晶态物质。

图 4 NC-Na 原 料 药 粉 末, Fiber1/9 和 Fiber2/8 的广角 X-射线衍射图谱
2.2.3 NC-Na纤维的热学曲线 实验中采用差热分析来测出聚合物材料的玻璃化转变温度 T g和载药纤维的热学性质,通过考察药物包裹在聚合物中后的量热曲线可以推测或评价药物在聚合物材 料中的存在 状态[12]。 称 量约 10 mg待测纤维小团,氮气流保护下进行升温,温度量程从0~300 ℃, 升温速率为 5 ℃ /min。 两种 NC-Na与 PLLA质量比不同的载药纤维毡的差示热分析和热重图谱如图5所示,发现 PLLA的玻璃化温度在 50 ~60 ℃之间, 而载药后的纤维的吸热峰有不同程度的向低温偏移, NC-Na的熔点在 329℃左右, 但载药后的纤维在 260 ~270 ℃之间有吸热峰出现, 提示 NC-Na与 PLLA结合后熔点降低, 说明药物与高分子有相当程度的结合。

图 5 NC-Na 原料药粉末, PLLA原料, Fiber1/9 和 Fiber 2/8 差示热分析图谱
2.3 NC-Na/PLLA纤维中药物释放行为
2.3.1 NC-Na的 HPLC测定方法[16]色谱柱为 Dikma Diamonsil C18(4.6 mm×200 mm, 5 μm, Dikma公司) , 流动相为甲醇-0.1 mol/L KH2PO4溶液 ( 体积比 20 ∶80, 0.1%三乙胺, H3PO4调 pH3.0), 检测波长 210 nm, 体积流量 1.0 m L/m in, 柱温 35 ℃, 进样量 10 μL[14]。
2.3.2 纤维中 NC-Na释放曲线的绘制 称取纤维 25 mg,浸入 10mL释放介质中, 磁力搅拌转速 100 r/min, 温度 37℃。 释放介质组成: 将 KH2PO413.6 g和 NaOH 3.16 g溶解在去离子水中并定容至2 000 mL, 得 pH7.4 的磷酸盐缓冲溶液, 模拟生理体液的 pH, 由于 NC-Na分子中带有羧基,其在 pH偏碱的溶液中可以解离从而使得药物增加药物在释放介质中顺利溶解。在预定的时间点取出全部释放介质进行 HPLC测定。 并在释放介质中添加 10 m L新的相应释放介质。计算各时间点的药物释放百分率并以其对时间做图NC-Na释放百分率计算公式为:

总体上, 包裹在纤维中的 NC-Na呈现的缓慢释放的特点,得药物释放曲线如图6所示,这是由药物在高分子纤维中缓慢扩散和聚乳酸缓慢降解的特点决定的,并发现其中药物释放可以 根 据 Higuchi方程 α=Kt1/2进行模 拟[17-18],具体数据见表2。 此外, 药物突释行为及大小可以作为药物在纤维中包裹状态的一项参考依据。 以 5 min 后药物的释放量作为突释的指标, 发现 F1/9 药物突释在 33%左右, F2/8药物突释在 41%左右, 说明 W/O/O法对药物包裹后, 在纤维表面可能存在或与高分子结合一定量的 NC-Na, 广角X-射线衍射的结果佐证了这一结果。 PLLA纤维中 NC-Na量的提高加快了药物本身的释放速率,因为其释放后提供的亲水性的孔道使得剩余药物更容易从纤维内部转移至外部,并且有利于水分子对酯键的攻击水解,也有利于蛋白酶K对纤维进行亲和并深入纤维内部对酯键进行降解,进而导致释放介质含蛋白酶 K时药物的更快释放。 F1/9 中 NC-Na的的突释和释放速率均小于 F2/8 中, 说明纤维对酶降解敏感,尤其在释放前期的时候。药物与高分子材料有一定的结合后在酶降解的情况下其释放速率会有较明显差异,释放后期纤维内部及表面上的孔洞已经足够多足够大,剩余NC-Na释放顺利, 所以释放率差距逐渐变小。 另外, 蛋白酶K加速材料的降解,进而加速纤维中包裹药物的释放[12,18] 。

图 6 纤维中 NC-Na 释放百分率曲线

表 2 NC-Na 释放曲线的 Higuchi拟合
拟合结果发现, 每一种纤维的 NC-Na释放动力学均可分为两个阶段拟合符合 Higuchi方程的形式, 提示释放遵循扩散机理。提示药物从纤维内部向外部的扩散路径较长,导致有效药物释速率逐渐减慢的情况,进而导致后阶段的释放速率变慢;另一个可能原因为药物释放后的没被或被部分降解的 PLLA片段会逐步从无定形态向结晶型变化而使药物从纤维内部向外部的释放受阻,因为小分子在非结晶态的高分子中的扩散速率大于在结晶态的高分子中扩散的速率,导致释放速率越来越慢。必须说明的是,该方程为在非降解材料基质中小分子化合物的扩散行为规律,本实验中小分子化合物从可降解高分子基质中释放还明显受到降解溶蚀这一因素的影响,所以本实验的K值是一个表观数值。
3 讨论
3.1 去甲斑蝥素在水中的溶解度较差, 而其钠盐在水中溶解度极好,可作静脉注射给药。病灶位置植入型生物可降解高分子材料释药体系中亦应该包裹后者,以期在释药时呈溶解状态。 由于 NC-Na易溶于水, 但是不溶于二氯甲烷,异丙醇等有机溶剂, 而二氯甲烷可以溶解 PLLA, 异丙醇不能溶解 PLLA, 所以采用 NC-Na水溶液/PLLA二氯甲烷体系制备 W/O乳, 再用异丙醇进行去二氯甲烷操作, 实际上是W/O/O体系。 尤其是, 本实验在较大功率超声的前提下,首次利用药物本身对乳液的稳定化作用制备得到乳液[15],即在剂型中除载体材料和药物外未添加任何其他乳化剂,这为高效、 经济的剂型开发提供了一条新思路[18]。
3.2 实验室中常见的纺丝方法制备所得纤维直径可从 500 nm至 1 mm之间变化, 虽然亦可以通过静电纺 W/O乳液法制备 “芯/壳” 结构纤维来包裹 NC-Na这样的药物, 但是由于该法所得纤维在 100 μm以下, 导致水相体积有限而载药量低,且仍有突释和不完全释放同时存在的问题,湿法纺丝时由于纤维直径较大,可以在纤维中引入蜂窝状结构而较大程度上增加水溶性药物的载药空间。本实验中,纤维中 NC-Na突释量较大, 但剩余药物呈现缓释行为, 尽管NC-Na与 PLLA有着较好的结合, 但由于纤维内部呈现疏松多孔结构,所以释放曲线呈现细小结晶态药物在高分子中分散后所得体系释放特点, 即 Higuchi释放形式。
3.3 所得纤维柔软易折, 在肝癌手术过后, 可将该纤维作为微创手术局部植入药物释放载体,并且其释放出来后为溶解的离子药物状态,而不同于一些文献报道的纤维中包裹良好, 但释放之后为不溶解状态的情况[19], 实际上后者是不符合药剂学要求的,有可能达不到预期的药理效果,此实验亦为其他类同 NC-Na性质的药物的包裹和可控释放提供参考。
[1] 刘 健,高建辉,刘晓秋.斑蝥素及其衍生物的研究进展[J].中药材, 2003, 26(6): 453-455.
[ 2 ] 李 柏, 凌昌全.去甲斑蝥素基础及临床应用进展[J].中草药, 2002, 33(2): 184-185
[ 3 ] 梁 枫, 王明艳.斑蝥酸钠的研究进展[J].江西中医学院学报, 2006, 18(1): 67-68.
[ 4 ] 魏春敏, 王本杰, 马 娅, 等.3H-去甲斑蝥素小鼠体内药代动力学与 组织 分布 [ J].药学学报, 2007, 42 (5):516-519.
[5] 汤华清,毕 容,刘小河,斑蝥及斑蝥制剂的临床应用现状[ J], 中国民族民间医药, 2010, 17(21) : 54-55.
[6] 王少兵,去甲斑蝥素和去甲斑蝥酸钠从聚合物基质中的释药行为比较[J].中国当代医药, 2010, 17(29): 127-128.
[7] 姜义娜,于香安,焦海胜, 等.斑蝥素脂质体凝胶剂的研制与质量评价[J], 中国医院药学杂志, 2004, 24(4):199-202.
[ 8 ] 凌昌全, 陈 坚, 陈 哲, 等.去甲斑蝥素-泊洛沙姆 407缓释剂瘤内注射治疗肝癌的临床研究[J].第二军医大学学报, 2000, 21(11): 1074-1076.
[9] 程宇慧,廖工铁,侯世祥, 等.去甲斑蝥酸钠白蛋白微球的研究[J].药学学报, 1993, 28(5): 384-388.
[10] 郭胜荣.药用高分子材料[M].北京: 人民卫生出版社,2009: 141-148
[11] Xu Xiuling, Chen Xuesi, Ma Pingan, et al.The release behavior of doxorubicin hydrochloride from medicated fibers prepared by emulsion-electrospinning[ J].European J Pharm Biopharm,2008, 70(1): 165-170.
[12] 王 浩, 宋宏锐, 邓英杰, 等.聚 α-羟基辛酸对 W/O乳液电纺聚乳酸纤维毡中阿霉素释放的影响[J].合成化学,2010, 18(3): 273-279.
[13] Gao Hao, Gu Yueqing, Ping Qineng, The implantable 5-fluorouracil-loaded poly( L-lactic acid ) fibers prepared by wetspinning from suspension [ J] .J Control Release, 2007, 118(3): 325-332.
[14] 郭舜民, 齐一萍, 林 绥, 等.斑蝥酸钠的合成[ J].海峡药学, 2009, 21(1): 88-89.
[15] 梁文平.乳状液科学与技术基础[M].北京: 科学出版社, 2001.
[16] 李春民, 赵桂森, 王唯红.HPLC法测定去甲斑蝥酸钠注射液含量及有关物质[ J].药物分析杂志, 2007, 27(6):893-895.
[17] 崔福德.药剂学[M].7 版.北京: 中国医药科技出版社,2011: 424-426.
[18] 王 浩, 丁怀伟, 温 梦, 等.W/O乳液电纺制备 L-肉毒碱/聚乙二醇-b-聚 ε-己内酯纤维及其表征[J].沈阳药科大学学报, 2013, 30(1): 1-7.
[19] Zeng Jing, Xu Xiuling, Chen Xuesi, et al.Biodegradable electrospun fibers for drug delivery[ J] .JControl Release, 2003, 92(3): 227-231.
R944
: B
: 1001-1528(2014)03-0626-05
10.3969/j.issn.1001-1528.2014.03.042
2013-02-12
辽宁医学院科研基金资助项目 (LYHX2012043); 辽宁医学院博士教师科研启动金的资助项目 (Y2012B012)
李艳芹 (1963—), 女, 高级实验师, 从事生物组织及医学材料的表征工作。 Tel: 18104069139
*通信作者: 张亚秋 (1963—), 女, 高级实验师, 从事药物新剂型开发的工作。 Tel: 13500469266
