复叶耳蕨总黄酮对大鼠骨髓间充质干细胞的增殖和成骨分化的影响
2014-04-11梁广胜殷嫦嫦邬亚华李辉敏刘玉亮魏强强
梁广胜, 殷嫦嫦, 殷 明, 邬亚华, 李辉敏, 刘玉亮,3, 魏强强,3
(1.九江学院医学部分析检测实验室, 江西 九江 332000; 2.南昌大学第二附属医院骨一科, 江西 南昌330006;3.南昌大学研究生院医学部, 江西 南昌 330006)
复叶耳蕨总黄酮对大鼠骨髓间充质干细胞的增殖和成骨分化的影响
梁广胜1,2,3, 殷嫦嫦1*, 殷 明2, 邬亚华1, 李辉敏1, 刘玉亮2,3, 魏强强2,3
(1.九江学院医学部分析检测实验室, 江西 九江 332000; 2.南昌大学第二附属医院骨一科, 江西 南昌330006;3.南昌大学研究生院医学部, 江西 南昌 330006)
目的 研究复叶耳蕨总黄酮对大鼠骨髓间充质干细胞向成骨分化的影响。方法 采用全骨髓差速贴壁法体外分离、 纯化和培养大鼠骨髓间充质干细胞; 取 P3代细胞, 分实验组和对照组, 用流式细胞仪测定细胞表面标志物鉴定细胞, 采用 MTT法检测细胞生长曲线。 显微镜下观察两组的细胞形态和组织化学染色的钙化结节; 速率法测定碱性磷酸酶 (ALP) 活性和 RT-PCR检测骨髓间充质干细胞诱导分化过程中骨桥蛋白和 I型胶原的 mRNA表达来鉴定成骨作用。 结果 体外培养的细胞表达表面标志; 复叶耳蕨总黄酮对骨髓间充质干细胞内 ALP活性增高并形成明显钙结节; PCR结果显示复叶耳蕨总黄酮上调骨桥蛋白和 I型胶原的 mRNA表达。 结论 20 μg/mL复叶耳蕨总黄酮可促进大鼠骨髓间充质干细胞定向分化为成骨样细胞。
复叶耳蕨总黄酮;骨髓间充质干细胞;增殖;碱性磷酸酶;成骨分化
江西百姓采用民间秘方复叶耳蕨治疗黄疸性肝炎有长久的历史,但有不少孕妇在用该草药治疗肝炎的过程出现流产,故引起研究者的注意,进行了系列研究。研究结果表明复叶耳蕨具有抗生育、加强子宫收缩等类激素作用,发挥药理作用的主要成分是黄酮类化合物[1]。 进一步研究发现, 复叶耳蕨总黄酮中含有众多类黄酮、香豆素类化合物、蒽醌类和其他化合物[2]。 有研究报道, 黄酮类化合物在脂质过氧化、 DPPH自由基清除、羟基自由基清除及 H2O2清除方面表现出剂量依赖性的抗氧化能力和调节氧化应激信号通路进而调节成骨分化及成骨细胞的功 能[3-4]。 因此推测, 复叶耳蕨 总黄酮可能具有较强的促进骨髓间充质干细胞 (BMSCs)成骨分化作用。本实验研究复叶耳蕨总黄酮对大鼠BMSCs的增殖和成骨分化的影响。
1 材料和方法
1.1 实验材料、试剂与仪器
1.1.1 动物 4 周龄健康清洁级 SD大鼠 5 只, 雌雄不限, 体质量约 40 g, 购自湖南斯莱克景达实验动 物 有 限 公 司,合 格 许 可 证 号: HNA SLKJ20122049。
1.1.2 受试物 药材于 2012 年 10 月采自江西庐山的秀峰,经九江森林植物标本馆馆长谭策铭鉴定为刺头复 叶 耳 蕨 Arachniodes exilis( Hance) Ching的根茎, 标本 (No.AEC1210)存放于九江学院基础医学院生化教研室实验室。复叶耳蕨总黄酮的提取由九江学院基础医学院药学系李辉敏副教授提取。 提取方法为采用超声波辅助的 75%乙醇浸提,用旋转蒸发将乙醇提取液浓缩,后用聚酰胺对其进行纯化;再经过冷冻干燥得复叶耳蕨总黄酮的干燥品 (用芦丁作对照品, 采用 HLPC法测得所提取的复叶耳蕨总黄酮含有芦丁样结构的化合物为75%)。复叶耳蕨总黄酮呈粉末状、 黄棕色至红棕色, 木化成品[3]。 称取 10mg复叶耳蕨总黄酮溶于100 μL的 DMSO, 取 10 μL上 述 溶 液 混 入 于9 990 μL完全培养基中, 配制成 100 μg/mL的复叶耳蕨总黄酮贮存液,然后再配制成不同质量浓度的受试物即配制含药的完全培养基,这些培养基用于相应实验组的细胞学实验。
1.1.3 试剂与仪器 DMEM/F12 ( Hyclone公司,澳大利亚)、 Fetal Bovine Serum (GIBCO公司, 美国)、 碱性磷酸酶 (ALP) [ Assay Kit Based on IFCC ( 2007 ) ] 、 MTT粉 ( Solarbio公 司, 中 国 )、0.25%胰蛋白酶 (含 EDTA)、 PBS 粉剂、 细胞裂解液 (北京普利莱基因技术有限公司)、 校准品及质控血清 (中生北控股份有限公司产品)。 6 孔培养板 (CORNING公司, 美国)、 TS100-F倒置相差显微镜 (Nikon 公司, 日本)、 超级恒温水浴 HH-601 (常州国华电器有限公司)、L-3180 型半自动生化分析仪 (上海科华实验系统有限公司)、 CO2恒温水浴箱 (SIM公司)、 超净台 (苏州净化设备有限公司)、 Model680 型酶标仪 ( BIO-RAD公司,美国)、 血球计算板 (上海求精生化试剂仪器有限公司)、 超速离心机 (Sigma公司)、 二甲基亚砜(DMSO Sigma公司)、 流式细胞仪 (美国 B—D公司 Ver3.0)、 茜素红粉 (西陇化工股份有限公司)、硝酸银 (上海三爱思试剂有限公司)、硫代硫酸钠(天津市风船化工试剂科技有限公司)、中性红(天津市科密欧化学试剂有限公司)。
1.2 实验方法
1.2.1 SD大鼠 BMSCs体外分离、纯化及培养
无菌条件下获取大鼠双侧股骨、胫骨并去两侧骨骺端, 用 PBS 缓冲液反复冲洗骨髓腔, 收集骨髓细胞于离心管中, 1 000 r/min 梯度离心 5 min, 弃上清, 加入含 10%FBS 的 DMEM/F12 培养基充分吹打均匀,重复离心 1 次, 弃上清, 加入含 10%FBS的 DMEM/F12 培养基重悬细胞沉淀, 调整细胞密度为 1 ×106个/mL, 接种于 25 cm2的培养瓶中,置于37 ℃、5%CO2相对饱和湿度的培养箱中孵育。 48 h后首次换液, 弃掉未贴壁细胞, 以后每2~3 d换液1次, 纯化骨髓间充质干细胞。 细胞达80% ~90%的融合, 胰蛋白酶消化传代。 倒置显微镜下观察原代及传代细胞的生长状况及形态特征,流式细胞仪分析细胞表面的标志物 CD44 和 CD90鉴定骨髓间充质干细胞。
1.2.2 细胞生长曲线的测定 (MTT比色法) 取生长良好且融合达 80% ~90%的 P3代细胞, 常规消化 离心, 弃上清, 调整 细 胞 密 度 为 1 ×104个/mL, 按每孔 200 μL接种于 96 孔板, 设立 5 个实验复孔和空白对照组, 置于37℃恒温培养箱中孵育。 每2 d更换培养基, 分别在第 1 天 ~第 11天共11 个时间点各取 1 个 96 孔板行 MTT检测:每孔加入 5%MTT溶液 20 μL孵育 4 h,然后吸弃上清液, 每孔加入二甲基亚砜 (DMSO) 150 μL,充分摇匀震荡 10 min 待结晶物充分溶解后, 应用酶标仪490 nm波长检测各孔的吸光度值 (A值),记录结果, 并绘制成大鼠 BMSCs的生长曲线 (X轴-时间, Y轴-吸光度)。
1.2.3 复叶耳蕨总黄酮对 BMSCs增殖的影响 取P3代细胞, 以 2 000 个/mL接种于 96 孔培养板,在37 ℃、 5%相对饱和湿度的 CO2培养箱中培养。24 h后吸去原培养基, 加入含不同质量浓度的复叶耳蕨总黄酮培养基 200 μL进行培养,对照组加入等量的普通培养基培养。 分别在 12、 24、 48、72 h 向每孔加入10 μL的 CCK液体, 孵育2 h, 用酶标仪测定 450 nm处的吸光度并绘制成图表。
1.2.4 复叶耳蕨总黄酮对 BMSCs成骨分化的影响取 P3代 BMSCs消化后按 2 ×105个/mL接种至24 孔板, 24 h 后吸去原完全培养基,按下面分组,每两组一板进行诱导分化: 对照组为每孔加 DMSO(0.1%) +DMEM/F-12 培 养 液; 实 验 组 为 含 20 μg/mL复叶耳蕨总黄酮 (0.1%DMSO) 的培养基。 共诱导7 d,每 3 d换液 1次。 倒置相差显微镜观察细胞形态变化并拍照,并用于以下检测。
1.2.5 检测 ALP酶活性 采用 IFCC推荐的磷酸对硝基苯酚法测定 (速率法),操作步骤按说明书, 记录检测样品每分钟吸光度变化值 (ΔA/ min), 计算样品中碱性磷酸酶活力 ( U/L), 并绘制成表格进行比较。
1.2.6 钙化结节染色 成骨诱导培养第 7 天采用Alizarin Red S ( ARS) 染色法和 Von Kossa染色法进行钙化结节的组织化学染色, 并在 10 ×10 倍显微镜 下 观 察。 Alizarin Red S 法:PBS 冲 洗 3 次,95%乙醇固定 10 min,三蒸水冲洗 3 次;加 2%茜素红后, 置于 37 ℃孵育 30min; 三蒸水冲洗 3 次,干燥、封 片。 钙 结 节 成 红 色。Von Kossa染 色:PBS 冲洗 3 次, 95%乙醇固定 5 min, 三蒸水漂洗 3次, 加5%硝酸银溶液, 紫外照射 1.5 h, 漂洗 3遍,加5%硫代硫酸钠中和残留硝酸银, 漂洗 3遍, 1% 中性 红 复 染 10 min, 漂 洗 3 遍, 干 燥,封片。
1.2.7 RT-PCR检测 常规种板 (24 孔板), 分 2组: 加药组 (20 μg/mL复叶耳蕨总黄酮) 和对照组 (加等量完全培养基), 每组设4 个复孔, 培养24 h 后按照康为世纪 RNA提取和逆转录说明书进行操作, 以逆转后的 cDNA为模版扩增检测骨桥蛋白 (OPN)和 I型胶原 ( Coll-Ⅰ)mRNA的表达,扩增后制胶跑电泳拍照, 目标基因 OPN、 Coll-Ⅰ、内参 GAPDH的引物见表1。

表 1 RT-PCR的引物序列Tab.1 Primer sequence of real time RT-PCR
1.2.8 统 计 学 分 析 所 有 数据 均 采 用 SPSS 19.0软件的 onewayANOVA方差分析统计分析, 结果以平均数 ±标准差 ()表示, 并两两样本间率的比较采用 χ2检验, 检验水准 α=0.05, P<0.05 为差异有统计学意义, P<0.01 为具有高度统计学意义。
2 结果
2.1 大鼠 BMSCs形态学特征 第 3 天首次换液可见分散的悬浮细胞,以折光性强的圆形细胞为主( 图1A) ; 6 ~10 d 后, 贴 壁 细 胞 明显 增 多, 出 现成纤维样细胞外观,呈长梭形 ( 图 1B和图 1C);14 d 左右细 胞可达 80% ~90%的融合, 细 胞 排 列具有明显的方向性, 呈漩涡状 (图 1D)。 多次传代后,细胞仍呈现梭形细胞群,呈漩涡状平行生长(图1E)。
2.2 大鼠 BMSCs流式细胞仪鉴定 流式细胞仪检测结果显示 CD44 表达阳性, CD90 阴性, BMSCs均一性好, 纯度达90%以上。 鉴定结果见图 2。
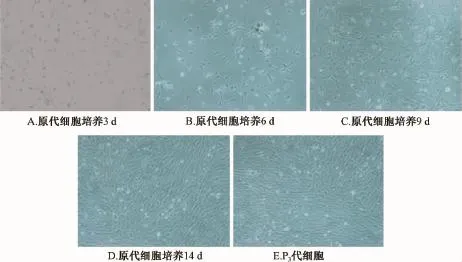
图 1 大鼠骨髓间充质干细胞的形态观察 ( ×100)Fig.1 Cellular m orphology observation ( ×100)

图2 小鼠骨髓间充质干细胞的表面抗原分子表达情况Fig.2 Surface an tigens of rat bonemarrow mesenchymal stem cells
2.3 细胞增殖测定 (MTT比色法) 在酶标仪上选择 490 nm波长检测各孔吸光值, 以时间 (t) 为横轴, 吸光度 (A) 为纵轴绘制 P3代细胞生长整个过程中细胞数目的动态变化 (图 3)。 BMSCs在接种的1~3 d内增殖相对缓慢, 处于潜伏期。 在第4天~第9天生长曲线近似成线性曲线,表明这段时间内细胞成对数生长,处于指数对数生长期,第10天以后曲线相对变缓, 细胞增殖速率减慢,处于平台期。

图3 骨髓间充质干细胞的生长曲线Fig.3 G row th curve of rat bonemarrow mesenchymal stem cells
2.4 复叶耳蕨总黄酮对 BMSCs增殖的影响 与对照组比较, 20 μg/mL复叶耳蕨总黄酮 对大鼠的BMSCs增殖具有轻度促进作用。 随着复叶耳蕨总黄酮质量浓度的增加,促细胞增殖活性降低,高于40 μg/m L则表现为明显的抑制增殖作用且呈剂量依赖性地降低大鼠 BMSCs的增殖能力, 见图4。
2.5 ALP活性检测 各组成骨分化过程中 ALP活性检测结果显示: 实验组的第 6 天 ALP活性明显高于第 3 天 (P<0.05), 而3 d 和6 d 后的实验组ALP活性明显高于相应的对照组 (P<0.05)。 见表2。

图4 复叶耳蕨总黄酮对骨髓间充质干细胞生长的影响Fig.4 Effect of grow th curve of total flavonoids from Arachniodes exilis on rat bonemar row mesenchymal stem cells
表2 碱性磷酸酶活性测定 (, n=5)Tab.2 Determ ination of alkaline phosphatase activity

表2 碱性磷酸酶活性测定 (, n=5)Tab.2 Determ ination of alkaline phosphatase activity
注: 与对照组相比,**P<0.01
(, n=5)组 别 吸光度 (A)3 d 6 d对 照组0.115 0 ±0.002 2 0.228 6 ±0.004 9实 验组 0.304 4 ±0.002 3** 0.434 4 ±0.004 0**
2.6 钙结节染色 ARS 染色: 复叶耳蕨总黄酮诱导组细胞胞浆中可见橘红色矿化结节形成,茜素红染色阳性,而对照组则为阴性。细胞聚集的地方钙结节明显增多。 Von Kossa染色 : 复叶耳蕨总黄酮诱导组加入硝酸银后, 在紫外线下染色 90 min 后可见黑色颗粒,光镜下可见粗大的黑色结节,且周围有粉红色细胞结构。 见图5。
2.7 RT-PCR检测结果 大鼠经诱导 6 d 后结果:
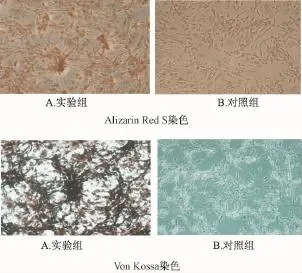
图5 两种染色法鉴定钙结节Fig.5 Identification of two kinds of calcium nodules staining
与对照组相比, 实验组的 OPN和 Coll-Ⅰ转录水平明显增强 (P<0.05 或 P<0.01)。 说明复叶耳蕨总黄酮可以促进 BMSCs高表达 OPN和 Coll-Ⅰ, 利于成骨分化进程。 见图6。

图6 PCR电泳图和 PCR灰度扫描定量结果Fig.6 PCR electrophoresis and quantitative results of PCR grayscale scanning
3 讨论
BMSCs具有众多优点而被认为是临床上较理想的治疗性细胞,如提取简单方便、来源充足、携带免疫调节机制和抗炎机制、避免免疫排斥反应、高度自我 更 新 能 力 和 多 向 分 化 潜 能 等[5-6]。 特 定 的作用因素促进 BMSCs分化为成骨细胞,有助于促进骨折愈合和骨质疏松症的防治[7], 因此寻找促进 BMSCs分化为成骨细胞的物质对于干细胞治疗在临床的应用具有重要的意义。 获得纯化 BMSCs是干细胞治疗关键步骤,本实验采用全骨髓贴壁法分离、 纯化 BMSCs, 通过细胞形态及流式细胞仪鉴定细胞表面标记物分析所得的 BMSCs为高度纯化的细胞, 细胞增殖实验证明 BMSCs生长良好,这些结果为下一步实验奠定基础。
黄酮类化合物对细胞作用具有双向性,即在不同的剂量下可呈现促增殖或抑制增殖作用,因此选择一个适合实验目的药物剂量是诱导 BMSCs分化成骨细胞实验关键环节,通过细胞增殖生长实验,发现低质量浓度复叶耳蕨总黄酮促进 BMSCs的增殖,高质量浓度复叶耳蕨总黄酮具有抑制其增殖。与对照组相比, 20 μg/mL复叶耳蕨总黄酮组的 A值在不同时间均略高于对照组,说明复叶耳蕨总黄酮能轻度促进细胞增殖,然而复叶耳蕨总黄酮质量浓度高于 40 μg/mL时, 能明显抑制 BMSCs的增殖,且随复叶耳蕨总黄酮的质量浓度增高,其抑制作用越强。 增殖与分化是 BMSCs的两个重要的生物学特性,两者之间存在相互关联的关系,过度增殖势必抑制分化,但抑制细胞的增殖亦影响细胞生物学活性, 因此, 本实验选择对 BMSCs有轻度促进增殖作用的质量浓度 (20 μg/mL) 复叶耳蕨总黄酮作为实验剂量即为实验组。
目前,ALP活性、 OPN和 Coll-Ⅰ的表达及矿化结节的检测是鉴定 BMSCs成功分化为成骨细胞的主要标志[8-9]。 ALP可分解有机 质中磷 酸, 增加局部无机磷酸盐浓度,促进矿化,是成骨细胞分化和功能成熟的前期标志[10],其活性越高, 说明前期成骨细胞向成熟成骨细胞的分化越明显。本实验用 20 μg/m L复叶耳蕨总黄酮干预后的第 3 天和第6 天, ALP活性明显增大,另外, 实验组的 ALP活性均比对照组高,且在第3天时两组的差异性更显著 (P<0.01), 实验组的 ALP活性比对照组高 2倍以上, 这说明复叶耳蕨总黄酮能明显促进 BMSCs生成 ALP或增强 ALP的活性。 OPN和 Coll-Ⅰ是分化成熟成骨细胞分泌的特异性蛋白,可作为成骨细 胞 分 化 的 中 期 指 标[11-12]。 RT-PCR 实 验 还 发现, 在诱导的第 6 天, 实验组的 OPN和 Coll-Ⅰ的mRNA比对照组的表达量明显增加。 另外, 矿化结节的形成是成骨细胞分化成熟的重要标志。实验中, 在诱导的第 7 天, 采用了 Alizarin Red S 染色和 Von Kossa染色两种染色方法分别对两组进行矿化结节染色定性鉴定,两种染色方法显示实验组矿化结节染色阳性,表明实验组培养的细胞具有成骨功能,并且复叶耳蕨总黄酮组的矿化结节阳性率明显高于对照组。以上结果表明:复叶耳蕨总黄酮对BMSCs向成骨细胞分化具有明显的促进作用。
本实验通过研究和探讨复叶耳蕨总黄酮对大鼠BMSCs向成骨分化的影响发现, 复叶耳蕨总黄酮可明显促进 BMSCs向成骨分化作用; 其作用是通过增强细胞内 ALP活性、促进钙结节形成、 上调骨桥蛋白和Ⅰ型胶原的表达,进而促进成骨分化进程。本研究为后续进一步研究复叶耳蕨总黄酮促成骨的机制奠定一定的基础。
[1] 姚果原,谭爱理,汪又奇,等.复叶耳蕨抗生育实验研究[J].中药通报, 1985, 10(9): 424-425.
[2] 李辉敏,吴家忠.复叶耳蕨根中化学成分的初步分析.九江医学, 2009, 24(1): 43-44, 48.
[3] 周道年.复叶耳蕨和金星蕨化学成分及生物活性的研究[D].武汉: 华中科技大学, 2009.
[ 4 ] Lean JM, Davies JT, Fuller K, et al.A crucial role for thiol antioxidants in estrogen-deficiency bone loss[ J].JClin Invest,2003, 112(6): 915-923.
[ 5 ] Granero-Molto F, Weis JA, Longobardi L, et al.Role ofmesenchymal stem cells in regenerative medicine: application to bone and cartilage repair[ J] .Expert Opin Biol Ther, 2008, 8(3): 255-268.
[ 6 ] Ryan JM, Barry F P, Murphy JM, et al.Mesenchymal stem cellsavoid allogeneic rejection[ J] .J Inflamm ( Lond) , 2005,2(1): 8.
[ 7 ] Rodriguez JP, Astudillo P, Rios S, et al.Involvement of adipogenic potential ofhuman bonemarrow mesenchymal stem cells(MSCs) in osteoporosis[ J] .Curr Stem Cell Res Ther, 2008, 3(3): 208-218.
[ 8 ] Aubin J E.Advances in the osteoblast lineage[ J].Biochem Cell Biol, 1998, 76 (6 ): 899-910.
[ 9 ] Sun Y Q, Ashhurst D E.Osteogenic growth peptide enhances the rate of fracture healing in rabbits[ J].Cell Biol Int, 1998,22(4): 313-319.
[10 ] Howlett CR, Cave J, W illiamson M, et al.Mineralization in in vitro culturesof rabbitmarrow stromal cells[ J] .Clin Orthop Relat Res, 1986, (213) : 251-263.
[11 ] Brown JP, Delmas PD, Malaval L, etal.Serum bone gla-protein: a specificmarker for bone formation in postmenopausal osteoporosis[ J] .Lancet, 1984, 1(8386) : 1091-1093.
[12 ] Mizuno M, Kuboki Y.Osteoblast-related gene expression of bonemarrow cells during the osteoblastic differentiation induced by type I collagen[ J] .JBiochem, 2001, 129(1): 133-138.
Effect of total flavonoids from Arachniodes exilis on proliferation and osteogenic differentiation of rat bonemarrow mesenchymal stem cells
LIANG Guang-sheng1,2,3, YIN Chang-chang1*, YIN Ming2, WU Ya-hua1, LIHui-min1,LIU Yu-liang2,3, WEIQiang-qiang2,3
(1.Analysis and Test Laboratory of Jiujiang University, Jiujiang 332000, China; 2.First Department of Orthopedics, The Second Hospital Affiliated to Nanchang University, Nanchang 330006, China; 3.Graduate School of Medicine Nanchang University, Nanchang 330006, China)
AIM To study the effect of total flavonoids from Arachniodes exilis on proliferation and osteogenic differentiation of rat bone marrow mesenchymal stem cells( BMSCs) .METHODS Rat BMSCs, isolated from rats bonemarrow in vitro by whole bonemarrow adherentmethod,was purified and cultured.Identification of thesurface marker of BMSCs and determination of their growth curve were completed by MTT.They were divided into experimental( total flavonoids from Arachniodes exilis) and control groups, and osteogenesis was identified bymicroscopic cellmorphology, the activity of alkaline phosphatase, the formation of calcified nodules by staining, and the expression ofosteopontin and collagen 1 were tested by RT-PCR.RESULTS Cells cultured in vitro expressed the surfacemarkers of BMSCs.The total flavonoids from Arachniodes exilis improved the activity of ALP, promoted the formation of calcium nodule, and increased the expression of osteopontin and Icollagen shown by PCR results. CONCLUSION 20 μg/mL total flavonoids from Arachnidesexilis can promote ratbonemarrowmesenchymal stem cells to differentiate into bone cells.
total flavonoids from Arachniodes exilis; bone marrow mesenchymal stem cells; proliferation;ALP; osteogenesis
R285.5
: A
: 1001-1528(2014)03-0456-06
10.3969/j.issn.1001-1528.2014.03.004
2013-06-11
采用常规实验室可用的药理研究模型系统研究复叶耳厥抑制 HIV-1 复制的有效成分 (81160536)
梁 广 胜 ( 1986—) , 男, 硕 士 生, 医 师, 研 究 方 向: 脊 柱 和 骨 关 节 疾 病, 骨 科 疾 病。 Tel: 13698416062, E-mail: lgs-19860322@163.com
*通信作者: 殷 嫦 嫦, 女, 博 士, 硕 士 生 导 师, 教 授, 研 究 方 向: 生 物 化 学 与 临 床 生 物 化 学。 Tel: 13607920508, E-mail: yinchangchang112@163.com
