二至丸有效部位群促进T淋巴细胞免疫活性的实验研究
2014-04-11代文飞
姚 干, 王 允, 刘 毅, 陶 勇, 代文飞, 王 皓, 刘 恒
(重庆邮电大学生物信息学院, 重庆 400065)
[药 理]
二至丸有效部位群促进T淋巴细胞免疫活性的实验研究
姚 干, 王 允, 刘 毅, 陶 勇, 代文飞, 王 皓, 刘 恒
(重庆邮电大学生物信息学院, 重庆 400065)
目的 考察二至丸有效部位群 (女贞子总皂苷、 女贞子多糖、 墨旱莲总黄酮) 促进小鼠T淋巴细胞免疫活性作用的机制。 方法 环磷酰胺致小鼠免疫力低下, 灌胃给药, 制备含药血清、 细胞悬液和脾总RNA, 中性红法测定腹腔巨噬细胞的吞噬能力, MTT法测定脾淋巴细胞的增殖能力, 胸腺细胞增殖法和 ELISA法测定腹腔巨噬细胞分泌 IL-1的水平、 脾淋巴细胞分泌 IL-2、 IL-12 的水平, RT-PCR法检测 IL-1、 IL-2 和 IL-12 mRNA的表达。 结果 免疫力低下小鼠腹腔巨噬细胞的吞噬能力、 脾淋巴细胞的增殖能 力, 以及 IL-1、 IL-2 和 IL-12 的水平, 均较正常小 鼠明显下降,三种细胞因子的表达也受到抑制,经该方治疗后,上述检测指标均有不同程度的提高。结论 该方对免疫失衡机体的保护作用与其改善 T淋巴细胞因子的活性水平及其 mRNA的表达水平有关。
二至丸有效部位群;免疫力低下;小鼠;T淋巴细胞
二至丸有效部位群由女贞子总皂苷、女贞子多糖、墨旱莲总黄酮3种有效部位组成,具有明显的保肝和增强免疫作 用[1-3]。 本研究主要考察 该组方促进T淋巴细胞免疫活性作用的机制。
1 实验材料
1.1 药品 女贞子、 墨旱莲药材, 购自重庆康济医药有限公司,经鉴定,分别符合 《中国药典》2010 年版一部女贞子、 墨旱莲项下规定。 女贞子总皂苷 (总皂苷质量分数 64.35%)、女贞子多糖(多糖质量分数 78.32%)、 墨旱莲总黄酮 (总黄酮质量分数 67.86%)[4-5], 本实验室制备。 二至丸有效部位群含女贞子总皂苷、女贞子多糖和墨旱莲总黄酮, 剂量配比为 13 ∶83 ∶4[6], 临用前用蒸馏水制成质量浓度为 22.15 mg/mL的药液, 必要时少量 Tween-80 助溶。 环磷酰胺粉针剂 ( 江苏恒瑞医药股份有限公司, 批号 110901, 200 mg/支), 盐酸左旋咪唑片 (山东省莒南制药厂, 批号 110601,25 mg/片), 临用前用蒸馏水制成质量浓度分别为4.0、 18.75 mg/mL的药液。
1.2 试剂 RPMI-1640 培养液 ( Gibco) , 无酚红RPMI-1640 培养液 (Sigma),配制时加青霉素 1 × 105IU/L、链霉素 100 mg/L,过滤, 使用时加体积分数为15%的胎牛血清 (FBS, 超级, 杭州四季青生物 工 程 材 料 研 究 所)。 ConA ( 刀 豆 蛋 白 A)(Flu-ka), 用培养液配成 4 mg/mL, 0.22 μm孔滤膜过滤, 分装, -20 ℃冻存, 临用前稀释。 MTT( 噻 唑 蓝) ( Sigma), 使 用 前 用 PBS 配 制 成5 mg/mL,过 滤, 4 ℃ 避光保 存。 LPS ( 脂多糖)(Sigma), 用培养液配成 1 mg/mL,0.22 μm微孔滤膜过滤, 分装, -20 ℃冻存,临用前稀释。 抗小鼠 CD3 抗体 (Sigma)。 IL-12 ELISA检测试剂盒( R&DSystemsEuropeLtd, Abingdon, Oxon, UK);TRIZOL总 RNA提取试剂 ( Gibco BRL);RT-PCR试剂 ( Promega);引 物 ( 上海 生 物 工 程 服 务 公司); 其 他 试 剂 ( TaKaRa); 硫 代 羟 基 乙 酸 钠(thioglycollate, TG) ( 北京生物制品所) ; 其余试剂均为市售分析纯。
1.3 仪器 Napco-5100 型 CO2培养箱,美国。恒温水浴摇床, Yamato, 日本。 PCR扩增仪、 分光光度计、 凝 胶 成 像 分 析 仪、 550 型 酶 标 仪, Bio-Rad, 美国。
1.4 动物 KM 种小鼠,6 ~8 周龄, 体质量(20 ±2) g, 重庆市中药研究院实验动物研究室(许可证号: 310101001)。
2 方法与结果
2.1 含药血清和脾组织制备[7]取小鼠 50 只, 随机分为 5 组, 每组 10 只, 雌雄各半。 各组按 20 m L/kg灌胃给药, 连续 6 d。 其中, 正常对照组、模型组给予生理盐水,阳性对照组给予盐酸左旋咪唑 0.375 g/kg, 正常给药组、 治疗给药组给予二至丸有效部位群 0.443 g/kg。 模型组、 阳性对照组、治疗给药组于实验第 4 天腹腔注射环磷酰胺 0.5 m L/只 (0.040 g/kg)。 末次给药后 1 h, 深度麻醉: (1) 心脏无菌采血, 3 000 r/min 离心 10 min,同组血清混合, 56 ℃ 水浴 30 min, EP管分装,-70 ℃冻存, 临用前 4 ℃冻融; (2) 随行无菌取脾,切成小块,液氮罐中保存。
2.2 细胞悬液的制备[8]小鼠腹腔注射 3%TG溶液 (2 mL/只), 72 h 后脱颈椎处死, 无菌条件下,腹腔注射 PBS 5 mL, 收集腹腔洗液, 同时取脾和胸腺。 常规方法制备细胞悬液, PBS 液洗涤, 离心, 用 RPMI-1640-10%FBS 培养液 调 整细胞密度为 2 ×106个/mL, 台盼蓝排除法检查细胞存活率大于95%。
2.3 二至丸有效部位群对小鼠腹腔巨噬细胞(PMΦ) 吞噬功能的影响 取 96 孔细胞 培养板,每孔加入 PMΦ悬液 50 μL、含药血清 20 μL和培养液120 μL, 各组设 8 个复孔。 37 ℃、 5%CO2培养箱中培养 24 h, 弃孔内培养基, 加 0.075%中性红溶液 100 μL/孔, 培养 1 h, 弃上清液, 预 温 的PBS 液洗 3 次, 加入细胞溶解液 (0.1 mol/L乙酸-无水乙醇) 100 μL/孔, 室温放置, 过夜。 次日,取上清液于 酶 标 板 中, 酶 标 仪 540 nm处 测 定 OD值。 采用 SPSS 11.0 统计软件包相应方法进行数据处理。 组 间 显 著 性 分 析 选 用 One-Way ANOVA→Dunnett法, 实验数据用表示, 结果见表1。

表1 二至丸有效部位群对小鼠 PMΦ吞噬功能的影响(OD值, n=8)Tab.1 Effect of effective fractions from Erzhi Pills on phagocytosis of peritoneal macrophage of m ice(OD, n=8)
从表1可以看出, 正常给药组小鼠 PMΦ的吞噬功能明显提高,与正常对照组比较,有显著性差异 (P<0.05); 模型组小鼠 PMΦ的吞噬功能明显降低, 与正常对照组比较, 有极显著性差异 (P<0.01); 阳性对照组、 治疗给药组小鼠 PMΦ的吞噬功能明显提高,与模型组比较,有显著性差异(P<0.05)。
2.4 二至丸有效部位群对小鼠 PMΦ 诱生 IL-1 的影响[9]取 24 孔细胞培养板, 每孔加入 PMΦ 悬液 1 mL, 各组设3 个复孔。 37 ℃、 5%CO2培养箱培养, 30 min 轻摇 1 次, 使未黏附细胞黏附, 3 h后,用培养液洗2次,除去未黏附细胞,换以含药血清-培养液,使含药血清终体积分数分别为20%、40%和 80% (V/V) /孔, 继续培养 48 h,3 000 r/min 离心, 收集上清液, 备用。 取 96 孔细胞培养板, 每孔加入小鼠胸腺细胞悬液 100 μL,再加 ConA溶液 (终质量浓度为 30 μg/m L), 最后上清液的倍比 (1 ∶5、 1 ∶10 和 1 ∶20) 稀释液(100 μL/孔), 对照孔用培养液代替上清液, 各组设 3 个复孔。 将培养板置 37 ℃、 5%CO2培养箱中, 培养 48 h 后, 加入 MTT 10 μL/孔 (10 mg/mL)培养 8 h, 弃上清, 加入 DMSO 100 μL/孔, MTT结晶充分溶解后,酶标仪 570 nm处测定 OD值。 数据处理同 “2.3” 项下方法, 结果见表 2。

表 2 二至丸有效部位群对小鼠 PMΦ诱生 IL-1 的影响 (OD值, n=3)Tab.2 Effect of effective fractions from Erzhi Pills on IL-1 p roduction by peritonealmacrophage ofm ice( OD, n=3)
从表2可以看出,正常给药组各稀释比例上清液中 IL-1 的水 平明显提高, 与正常对照组比较,有显著性差异 (P<0.05); 模型组各稀释比例上清液中 IL-1 的水平明显降低, 与正常对照组比较,有显著性或极显著性差异 (P<0.05, P<0.01);治疗给药组 20%上清液 1 ∶10、 40%上清液各比例、 80%上清液 1 ∶5 和 1 ∶10 中 IL-1 的水平明显提高,与模型组比较,有显著性或极显著性差异(P<0.05, P<0.01)。
2.5 二至丸有效部位群对小鼠脾淋巴细胞 (LP)增殖活性的影响 取96孔细胞培养板,每孔加入脾 LP悬液 50 μL、 含药血清 20 μL和培养液 120 μL, 混匀后预孵 1 h, 加入 ConA或 LPS10 μL(终质量浓度为 5 μg/m L) (对照组用 PBS 10 μL), 各组设8 个复孔。 37 ℃、5%CO2培养箱中培养 48 h后, 加入 MTT 10 μL/孔 (10 mg/m L) 培养 8 h,弃上清液, 加入 DMSO 100 μL/孔, MTT结晶充分溶解后, 酶标仪 570 nm处测定 OD值。 数据处理同 “2.3” 项下方法, 结果见表 3。
从表 3 可以看出,正常给药组 ConA或 LPS 诱导的小鼠脾 LP的增殖活性明显提高, 与正常对照组比较, 有显著性差异 (P<0.05); 模型组 ConA或 LPS 诱导的小鼠脾 LP的增殖活性明显降低, 与正常对照组比较, 有极显著性差异 (P<0.01);阳性对照组、治疗给药组 ConA或 LPS 诱导的小鼠脾 LP的增殖活性明显提高,与模型组比较, 有极显著性差异 (P<0.01)。

表3 二至丸有效部位群对小鼠脾 LP增殖活性的影响(OD值, n=8)Tab.3 Effect of effective fractions from Erzhi Pills on sp lenic lym phocyte proliferation of m ice ( OD,n=8)
2.6 二至丸有效部位群对小鼠脾 LP诱生 IL-2 的影响[10]取 24 孔细胞培养板, 每孔加入脾 LP悬液 1 m L, 各组设3 个复孔。 37 ℃、 5%CO2培养箱培养, 30 min 轻摇一次, 使未黏附细胞黏附, 3 h后,用培养液洗2次,除去未黏附细胞,换以含药血清-培养液 (1 mL/孔), 继续培养 48 h, 3 000r/min离心, 收集上清液, 备用。 取 96 孔细胞培养板, 每孔加入小鼠胸腺细胞悬液 100 μL, 再加ConA溶液 (终质量浓度为 30 μg/mL), 最后加 IL-2 上清液 (100 μL/孔),对照孔用培养液代替 IL-2上清液, 各组设8 个复孔。 将培养板置37 ℃、 5% CO2培养箱中, 培养 48 h 后, 加入 MTT 10 μL/孔(10 mg/mL) 培养 8 h,弃上清, 加入 DMSO 100 μL/孔,MTT结晶充分溶解后,酶标仪 570 nm处测定 OD值。 数据处理同 “2.3” 项下方法, 结果见表4。

表 4 二至丸有效部位 群对小鼠脾 LP诱 生 IL-2 的影响(OD值, n=8)Tab.4 E ffect of effective fractions from Erzhi Pills on IL-2 p roduction by sp lenic lym phocyte of m ice( OD,n=8)
从表 4 可以看出, 正常给药组上清中 IL-2 的水平明显降低,与正常对照组比较,有显著性差异(P<0.05);阳性对照组、 治疗给药组上清中 IL-2的水平明显提高, 与模型组比较,有显著性 (P<0.05)。
2.7 二至丸有效部位群组方对小鼠脾淋巴细胞 IL-12 诱生的影响[11]取 24 孔细胞培养板,每孔加入脾 LP悬 液 950 μL, 各 组 设 3 个复 孔。预孵 1 h,加入 50 μL ConA或 LPS (100 μg/mL) 或 抗 小 鼠CD3 抗体 (1.25 μg/mL) 刺激脾 LP( 对照组用 10 μL PBS) , 37 ℃、 5%CO2培 养 箱 培 养, 30 min 轻摇一次, 使未黏附细胞黏附,3 h后, 用培养液洗2 次, 除 去 未黏附细胞, 换 以 含 药 血 清-培 养 液,继续培 养 48 h, 3 000 r/min 离 心 , 收 集 上 清 液 ,用培养液按 1 ∶5 比例稀释后, 备用。 取 96 孔细胞培养板, 每孔加入50 μL上清液稀释液和 50 μL生物素化的抗 IL-12 抗体, 同时设空白对照、 阴性对照 ( 均 加 培 养 液 ) 和 阳 性 对 照 ( 加 IL-12 标 准品) , 各组设 8 个复孔。室温孵育 2 h, 洗板 3 次。加入链霉亲和素-辣根过氧化物酶溶液 100 μL( 空白对照 用 PBS 代 替 ) , 室 温 孵 育 30 min, 洗 板 3次, 加入四甲基联苯胺 (TMB) 底物溶液。 酶标仪 450 nm处测定 OD值, 根据标准曲线计算 IL-12的水平。 数据处理同 “2.3” 项下方法, 结果见表5。

表 5 二至丸有效部位群对小鼠脾 LP诱生 IL-12 的影响(ng/L, n=8)Tab.5 Effect of effective fractions from Erzhi Pills on IL-12 production by sp lenic lym phocyte of m ice(ng/L, n=8)
从表 5 可以看出,正常给药组上清液中 IL-12的水平明显提高, 其中, 以经抗 CD3 抗体刺激后的效应较为明显,与正常对照组比较,有显著性差异 (P<0.05); 模型组上清液中 IL-12 的水平明显降低, 其中, 以经 ConA、 抗 CD3 抗体刺激后的效应较为明显,与正常对照组比较,有显著性或极显著性差异 (P<0.05, P<0.01);阳性对照组、治疗给药组上清液中 IL-12 的水平明显提高, 其中,治疗给药组以经 ConA、 抗 CD3 抗体刺激后的效应较为明显,与模型组比较, 有显著性差异 (P<0.05)。
2.8 二至丸有效部位群对小鼠脾脏 IL-1、 IL-2 和IL-12 mRNA 表 达 的 影 响[11-12]取 脾 组 织 小 块 约100 mg, 在液氮预冷的研钵中研磨成粉末状, 加RNAiso Plus, 匀浆液离心, 上清液用三氯甲烷振荡, 离心, 上清液加异丙醇, 离心, 沉淀加 75%乙醇离心, 沉淀通风干燥, RNase-free dd H2O溶解, 即得脾总 RNA。 引物序列见表 6, RNA纯度鉴定、 RT-PCR分别按对应的试剂盒说明书操作。逆转录反应体 系 42 ℃反应 60 min, 99 ℃ 加 热 5 min, 冰浴 10 min。 PCR反应在基因扩增仪上进行,不同的基因扩增时运用不同的循环数 ( IL-1、 IL-2、 IL-12 依 次 为 28、 28、 30 个 循 环) 及 T m 值(退火温度,IL-1、 IL-2、 IL-12 依次为 62、 64、 60℃), 每批模板均同时进行 β-actinmRNA扩增作为内对照。 凝胶电泳、 扫描, 用细胞因子吸光度/βactin 吸光度之比表示各细胞因子 mRNA的量。 数据处理同 “2.3”项下方法, 结果见表7。

表6 目的基因的引物序列Tab.6 Primer sequence of the target gene
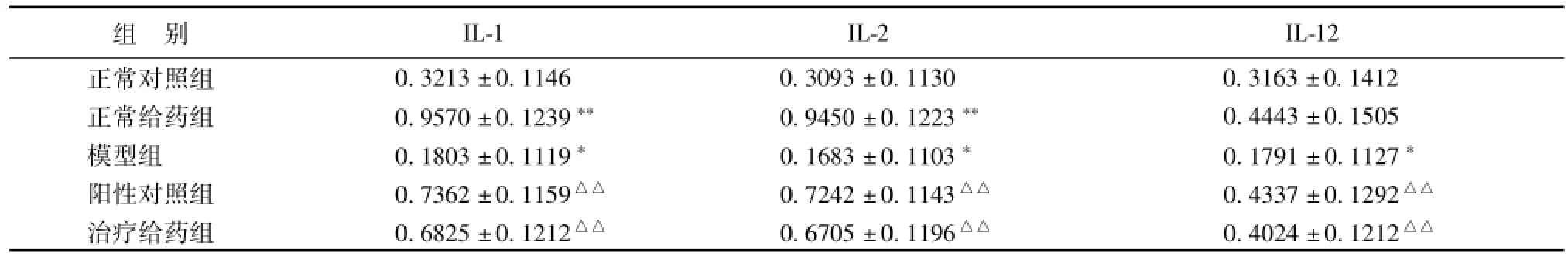
表 7 二至丸有效部位群对小鼠脾脏 IL-1、 IL-2 和 IL-12 mRNA表达的影响 ( n=8)Tab.7 Effect of effective fractions from Erzhi Pills on expressions of IL-1, IL-2 and IL-12m RNA in sp leen ofm ice( n=8)
从表 7 可以看出:正常给药组小鼠脾脏 IL-1、IL-2 和 IL-12 mRNA表达的水平明显提高, 其中,以促进 IL-1、 IL-2 mRNA表达的作用较为明显, 与正常对照组比较, 有极显著性差异 (P<0.01);模型组小鼠脾脏 IL-1、 IL-2 和 IL-12 mRNA表达的水平明显降低,与正常对照组比较,有显著性差异(P<0.05); 阳性对照组、 治疗给药组小鼠脾脏IL-1、 IL-2 和 IL-12 mRNA表达 的水平明显提高,与模型组比较, 有极显著性差异 (P<0.01)。
3 讨论
机体免疫功能状况与细胞免疫关系密切,细胞免疫的识别和效应阶段由 T细胞特异性识别介导[13-14]。 IL-2 活性水平可以直接反映 T细胞功能,IL-1 是 T细胞活化和 IL-2 产生的重要刺激因子,IL-12 既是活化 Th1 和 NK细胞的关键因子, 又是 T细胞和 NK细胞分 泌 γ-INF的强烈刺激因 子[15-16],对这些影响T细胞功能的关键分子进行分析,有助于阐明药物的免疫作用机理。
本研究发现,小鼠皮下注射环磷酰胺后,其腹腔巨噬细胞的吞噬能力、脾淋巴细胞的增殖能力、关键细胞因子 (IL-1、 IL-2、IL-12) 的活性水平及其 mRNA的表达水平均明显降低。 采用二至丸有效部位群治疗后,上述各项指标都有明显改善,说明该方可以较好地恢复免疫力低下机体的免疫功能,对免疫失衡机体的保护作用与改善T淋巴细胞关键因子的活性水平及其 mRNA的表达水平有关。研究成果对阐明二至丸免疫调节作用的分子机理具有重要的意义,为其二次开发提供实验依据。
[1] 姚 干,何宗玉.二至丸对小鼠淋巴细胞和巨噬细胞作用的活性组分构件研究[J].时珍国医国药, 2006, 17(10):1921-1923.
[2] 姚 干,蔡应繁,江怀仲,等.二至丸有效部位群组方对小鼠实验性肝损伤的保护作用[J].中成药, 2009, 31(3): 461-463.
[3] 姚 干,蔡应繁,江怀仲,等.二至丸有效部位群组方对环磷酰胺致免疫力低下小鼠的保护作用[J].中成药,2008, 30(12): 1836-1837.
[4] 姚 干,何宗玉,闫光凡,等.大孔吸附树脂纯化女贞子中齐墩果酸和熊果酸的研究[J].中草药, 2007, 38(10):1498-1501.
[5] 霍丽丽,姚 干,龙 永,等.大孔吸附树脂法富集纯化女贞子总皂苷的工艺研究[J].中成药, 2009, 31(10):1522-1526.
[6] 姚 干,何宗玉,闫光凡,等.正交设计法配合多药效指标综合评价筛选二至丸有效部位群组方的最佳配比[J].中成药, 2009, 31(9): 1444-1447.
[7] 黄 进,张 进,徐志伟.5种中药多糖及其含药血清对MSCs增殖的影响 [J].辽宁中医杂志, 2010, 37 (9):1821-1823.
[8] 毛 平,马 骏,陈艳艳,等.不同药性补气中药对小鼠脾淋巴细胞增殖及细胞因子分泌的影响[J].上海中医药大学学报, 2006, 20(3): 49-51.
[ 9 ] 王琪琳.海带硫酸多糖对小鼠腹腔巨噬细胞 IL-1 分泌功能的研究[J].聊城大学学报: 自然科学版, 2007, 20(4):51-53.
[10] 徐庆荣, 邱世翠, 韩兆东, 等.落地生根对小鼠脾淋巴细胞增殖、 IL-2 的影响[ J] .中国中医药科技, 2002, 9 (6 ):356, 363.
[11] 宋淑霞, 吕占军.扶正、 补肾及益气补肾方药对肾虚老龄小鼠免疫功能的影响[J].细胞与分子免疫学杂志, 2002,18(4): 387-389.
[12] 陈书明, 常云花, 梁新峰, 等.麻鸡脾脏总 RNA提取方法初探[J].山西农业科学, 2010, 38(10): 51-52, 64.
[13 ] Lio D, D'Anna C, Gervasi F, et al.Interleukin-12 release by mitogen-stimulated mononuclear cells in the elderly[ J] .Mech Ageing Dev, 1998, 102 (2/3) : 211-219.
[14 ] Song F, Matsuzaki G, Mitsuyama M, et al.Differential effects of viable and killed bacteria on IL-12 expression ofmac-rophages[J] .J Immunol, 1996, 156(8): 2979-2986.
[15] Ma D, Shan A, Chen Z, et al.Effect of Ligustrum lucidum and Schisandra chinensis on the egg production, antioxidant status and immunity of laying hens during heat stress[ J] .Arch Anim Nutr, 2005, 59(6) : 439-447.
[16] Shoemaker M, Hamilton B, Dairkee S H, et al.In vitro anticancer activity of twelve Chinesemedicinal herbs[J] .Phytother Res, 2005, 19(7) : 649-651.
Promotion of effective fractions from Erzhi Pills on immune activity of T lymphocyte
YAO Gan, WANG Yun, LIU Yi, TAO Yong, DAIWen-fei, WANG Hao, LIU Heng
(College of Bioinformation of Chongqing University of Postsand Telecommunications, Chongqing 400065, China)
AIM To study the promotion of effective fractions from Erzhi Pills(total saponins from Broussonetiae Fructus, polysaccharides from Broussnetiae Fructus, total flavonoids from Ecliptae Herba)on immune activity of T lymphocyte in mice.METHODS Cyclophosphamide was used to cause immunosuppressive mice and the test drug was applied by gavage.Drug-contained serum, cell suspension and total RNA in spleen were later prepared. Themacrophage phagocytosis, the lymphocytic proliferation, the levels of IL-1, IL-2 and IL-12, and the expressions of IL-1, IL-2 and IL-12 mRNAs in spleen from immunosuppressivemice were evaluated by natural redmethod, MTT colorimetry, thymus cell proliferation assay, ELISA and RT-PCR, respectively.RESULTS Themacrophage phagocytosis, the lymphocytic proliferation, the levels of IL-1, IL-2 and IL-12, and theirmRNA expressions in cyclophosphamide group were significantly lower than those in the normalmice.The above-mentioned indexes all improved to a certain extent after the treatment with effective fractions from Erzhi Pills.CONCLUSIONS The protective effect of effective fractions from Erzhi Pillson immunosuppressivemicemay be related to increasing levels of cytokines of T lymphocytes and theirmRNA expressions.
effective fractions from Erzhi Pills; hypoimmunity; mice; T lymphocytes
R285.5
: A
: 1001-1528(2014)03-0441-06
10.3969/j.issn.1001-1528.2014.03.001
2013-04-14
重庆市自然科学基金 (CSTC2006BB5429)
姚 干 (1970—), 男, 博士, 副教授, 研究方向: 中药药效物质基础、 作用机理及中药新药。 Tel: (023) 62471286, E-mail: 451037849@qq.com
