加糖红参对生脉饮质量的影响
2014-04-11逄世峰许世泉崔丽丽孙成贺王英平中国农业科学院特产研究所吉林长春130112
逄世峰, 许世泉, 崔丽丽, 孙成贺, 张 浩, 王英平(中国农业科学院特产研究所, 吉林 长春 130112)
加糖红参对生脉饮质量的影响
逄世峰, 许世泉, 崔丽丽, 孙成贺, 张 浩, 王英平*(中国农业科学院特产研究所, 吉林 长春 130112)
目的 研究加糖红参对生脉饮中有效成分的影响。方法 采用高效液相色谱法,比较不同加糖量红参制得生脉饮制剂中人参皂苷 Rg1、 Re、 Rb1、 五味子醇甲、 五味子醇乙、 五味子甲素、 五味子乙素的量。 结果 加糖红参生脉饮中人参皂苷和五味子木脂素类成分含有量均低于正常红参生脉饮,并随加糖量增加相应减少。结论 当红参加糖量超过 10%时, 即对生脉饮质量造成显著影响。
生脉饮;加糖红参;人参皂苷;木脂素;高效液相色谱
生脉饮为 《中国药典》 2010 年版一部 “成方制剂和单味制剂”项下收载品种[1], 由红参、 麦冬、五味子组成,具有益气复脉、养阴生津之功效,是治疗气阴两亏、心悸气短、脉微自汗等疾病常用中成药之一。
为改善参口味,延长保质期,增加参质量,市场上红参普遍加糖,有说法 “中药红参被曝约两成加糖,加糖红参增重两成”。然而,加糖后无法判断红参是水煮还是水蒸,而水煮会使参的功效降低[2]。
红参为生脉饮方中君药[3], 加糖红参势必对生脉饮质量造成一定影响,本实验研究不同加糖量对生脉饮质量的影响,探讨加糖红参危害程度,为中药制剂生脉饮提供可靠质量评价依据。
1 仪器、 试剂和材料
1.1 仪器 高效液相色谱仪 ( 岛津 LC-10A),SPD-M10A二极管阵列检测器;DHG-9145A电热恒温鼓风干燥箱 (上海一恒科技有限公司); 电子天平 (上海梅特勒 -托利多仪器有限公司); HH-6 型数显恒温水浴锅 (常州澳华仪器有限公司);SK8200H超声波清洗器 (上海科导超声仪器有限公司)。
1.2 试药 乙腈为色谱纯, 水为超纯水, 其他试剂均为分析纯。五味子醇甲、五味子醇乙、五味子甲素、 五味子乙素、 人参皂苷 Rg1、 Re、Rb1均购自中国药品生物制品检定所。
1.3 材料 人参购自吉林省抚松县; 麦冬购自康美药业股份有限公司;五味子购自吉林省通化县。以上药材经中国农业科学院特产研究所药用植物研究室许世泉副研究员鉴定, 分别为人参 Panax ginseng C.A.Mey的干燥根、 麦冬 Ophiopogon japonicus(thunb.)ker-Gawl. 的 干 燥 块 根、 五 味 子Schisandra chinensis(Turcz.)Baill的干燥果实。
2 方法与结果
2.1 红参制备
2.1.1 正常红参[4-5]取大小相近鲜人参若干, 去须, 洗净后, 蒸制 4 h, 70 ℃下烘 8 h,随后在50℃下彻底烘干, 即得。
2.1.2 加糖红参[6]取红参 90 支, 随机分 成 3组, 每组 30 支, 分别称重; 取各组质量 10%、20%、40%蔗糖分别溶解于 2 000 mL水中, 制成糖水; 取各组红参于相应糖水中浸泡 48 h, 50 ℃下彻底烘干,即得。
2.2 生脉饮制备[7-8]取红参 100 g, 麦冬 200 g,五味子 100 g,分别粉碎成粗粉, 用 65%乙醇作溶剂, 浸渍 24 h 后进行渗漉, 收集渗漉液约 4 500 m L, 减压浓缩至 250 mL, 放冷, 加水 400 mL稀释, 滤过, 另加60%糖浆300 m L及1 g苯甲酸钠,并调节 pH值至8,加水至1 000 mL, 搅匀, 静置,滤过,灌封,灭菌,即得。
2.3 不同生脉饮制品中人参皂苷测定
2.3.1 色谱条件[9]Agilent SB-C18色谱柱 (4.6 mm×250 mm, 5 μm),流动相为 0.1%甲酸乙腈溶液 (A)-0.1% 甲 酸 水 溶 液 (B) 梯 度 洗 脱(0 ~20 min, 19% ~23%A; 20 ~30 min, 23% ~25%A; 30 ~35 min, 25% ~26%A; 35 ~40 min,26% ~36%A;40 ~45 min, 36% ~42%A; 45 ~50 min, 42% ~19%A), 体积流量 1mL/min, 检测波长为203 nm, 柱温30 ℃, 进样量 10 μL。 见图 1。
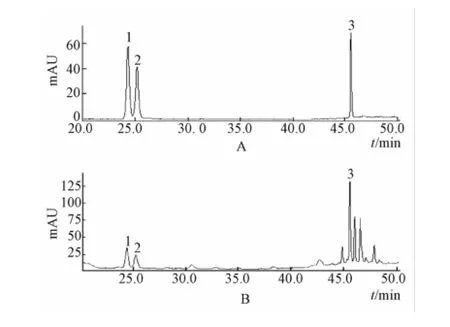
图1 混合对照品 (A) 及生脉饮样品 (B) HPLC色谱图Fig.1 HPLC chromatograms of reference substances and ShengmaiOral Liquid sample
2.3.2 对照品溶液的制备 精密称取人参皂苷Rg1、 Re、 Rb1对照品适量,置于 10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀即得。
2.3.3 供试品溶液制备[10]精密量取生脉饮溶液10mL,加20mL水稀释,混匀, 转入分液漏斗中,加乙醚萃取3次,弃去乙醚层,正丁醇萃取4次,每次 50 mL, 合并正丁醇层, 用 0.1 mol/L NaOH洗涤正丁醇层 2 次, 每次30 m L, 蒸干正丁醇, 甲醇定容至 10 mL。
2.3.4 标准曲线绘制 精密量取对照品溶液 20、50、 100、 200、 400 μL, 分别置于 10 m L量瓶中,用甲醇定容至刻度稀释成一系列质量浓度的混合对照品溶液,在上述色谱条件下,注入超高效液相色谱仪。以峰面积为纵坐标,进样量为横坐标,绘制标准曲 线, 得 Rg1、 Re、 Rb1回 归 方 程 分 别 为: Y=4.3104 ×10-6X-0.029 7(r2=0.999 3)、 Y= 2.427 2 ×10-6X+0.018 9(r2=0.999 5)、 Y= 4.687 7 ×10-6X-0.009 6(r2=0.999 6)。 结果表明: 人参皂苷 Rg1在 0.338 ~6.76 μg, 人参皂苷Re在 0.182 ~3.64 μg, 人参皂苷 Rb1在 0.246 ~4.92 μg范围内均呈良好线性关系。
2.3.5 精密度试验 取同一供试品溶液按上述色谱条件连续进样5次,以峰面积计算人参皂苷Rg1、 Re、 Rb1的 RSD 分 别 为 0.85、 0.76%、0.58%。 结果表明本实验仪器的精密度良好。
2.3.6 稳定性试验 取同一供试品溶液分别于 0、4、 8、 12 h 按上述色谱条件进样测定, 以峰面积计 算 人 参 皂 苷 Rg1、 Re、 Rb1的 RSD 分 别 为1.81%、 1.92%、1.71%, 结果表明样品在 12 h内稳定。
2.3.7 重复性试验 取同一批样品, 按 “2.3.3”项下制备供试品溶液6份,在上述色谱条件下分别进行 HPLC分析, 计算人参皂苷 Rg1、Re、 Rb1峰面积的 RSD分别为 3.38%、 2.76%、1.65%, 结果表明实验方法重复性良好。
2.3.8 加样回收率试验 分别精密称取人参皂苷Rg1、 Re、 Rb1对照品适量, 加甲醇稀释制得每 1 mL含 人 参 皂 苷 Rg1、 Re、Rb1分 别 为 179.36、85.78、 416.31μg的混合对照品溶液。 精密移取已知含量的正常红参生脉饮样品溶液 2 mL, 分别加入上述的混合对照品溶液 2 mL, 定容至 5 mL量瓶,平行制备6份供试溶液。在上述色谱条件下注入液相色谱仪,测得3种人参单体皂苷的量,计算平均回收率在 97.08% ~100.04%之间, RSD均小于 3%, 结果见表 1。
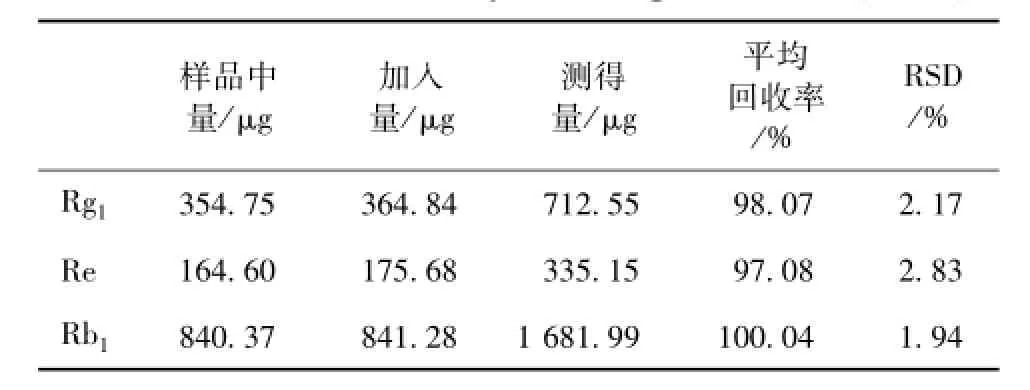
表 1 人参皂苷回收率 (n=6)Tab.1 Results of recovery test for ginsenosides( n=6)
2.3.9 试验结果 取各生脉饮制品 10mL(规格:每支装 10mL), 按 “2.3.3” 项制备供试品溶液,在上述色谱条件下测定人参皂苷 Rg1、 Re、 Rb1,结果见表2。
由表2可知,加糖红参生脉饮中人参皂苷Rg1、 Re、 Rb1的量均低于正常红参生脉饮, 并随加糖量增加, 其含有量相应减少, 其中 40%加糖红参组人参皂苷 Rg1、 Rb1的量与其他 3 组相比较,具有显著性差异。
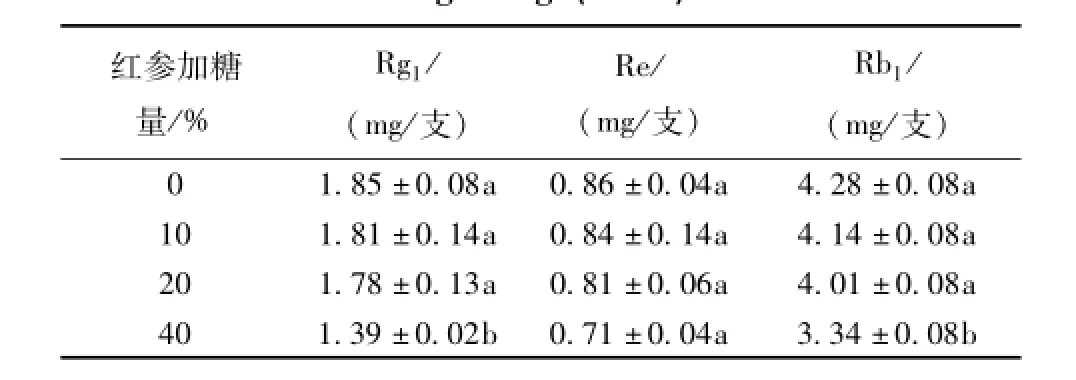
表2 加糖红参生脉饮制品中人参单体皂苷 (n=3)Tab.2 Content of ginsenoside in Shengmai O ral Liquid of sweetened red ginseng (n=3)
2.4 不同生脉饮制品中五味子木脂素测定
2.4.1 色谱 条 件[11]Agilent SB-C18色 谱 柱 (4.6 mm×250 mm, 5 μm), 流动相为乙腈-水, 梯度洗脱 (0 ~30min, 45% ~75% 乙 腈; 30 ~45min,75% ~100%乙腈),体积流量 1 mL/min, 检测波长为254 nm,柱温30 ℃, 进样量 10 μL, 见图 2。

图2 混合对照品 (A) 及生脉饮样品 (B) HPLC色谱图Fig.2 HPLC ch romatogram s of reference substances and Shengmai Oral Liquid sample
2.4.2 对照品溶液的制备 精密称量五味子醇甲、五味子醇乙、五味子甲素、五味子乙素对照品适量, 置10 mL量瓶中, 用甲醇溶解并稀释至刻度,摇匀,即得。
2.4.3 供试品溶液制备[12]精密量取生脉饮溶液10mL,加20mL水稀释,混匀, 转入分液漏斗中,加乙酸乙酯萃取 5 次,每次 50 mL,合并乙酸乙酯层, 蒸干乙酸乙酯, 甲醇定容至10 m L, 即得。
2.4.4 标准曲线绘制 精密量取对照品溶液 20、50、 100、 200、 400 μL, 分别置于 10 m L量瓶中,用甲醇定容至刻度稀释成一系列的混合对照品溶液,在上述色谱条件下,注入超高效液相色谱仪。以峰面积为纵坐标,进样量为横坐标,绘制标准曲线,得五味子醇甲、五味子醇乙、五味子甲素、五味子乙素回归方程分别为:Y=3.510 2 ×10-7X-0.000 2(r2=0.999 8)、 Y=3.942 6 ×10-7X+ 0.005 1(r2=0.999 5)、 Y=3.786 9 ×10-7X+ 0.000 4(r2=0.999 4)、 Y=4.687 2 ×10-7X+ 0.004 5(r2=0.999 5)。 结果表明五味子醇甲在0.193 ~3.86 μg, 五味子醇乙在 0.168 ~3.36 μg,五味子甲素在 0.064 ~1.28 μg, 五味子 乙素在0.131 ~2.62 μg范围内均呈良好线性关系。
2.4.5 精密度试验 取同一供试品溶液按上述色谱条件连续进样5次,以峰面积计算五味子醇甲、五味子醇乙、 五味子甲素、 五味子乙素的 RSD分别为 0.46%、 0.55%、 0.67%、 0.51%。 结 果 表明本实验仪器的精密度良好。
2.4.6 稳定性试验 取同一供试品溶液分别于 0、4、 8、12 h 按上述色谱条件进样测定, 以峰面积计算五味子醇甲、五味子醇乙、五味子甲素、五味子乙素的 RSD分别为 1.69%、1.57%、 2.36%、1.81%。 结果表明样品在 12 h 内稳定。
2.4.7 重复性试验 取同一批样品, 按 “2.4.3”项下制备供试品溶液6份,在上述色谱条件下分别进行 HPLC分析, 计算五味子醇甲、 五味子醇乙、五味子甲素、 五味子乙素峰面积的 RSD分别为1.67%、 3.36%、 3.65%、 2.56%。 结果表明方法重复性良好。
2.4.8 加样回收率试验 分别精密称取五味子醇甲、五味子醇乙、五味子甲素、五味子乙素对照品适量,加甲醇稀释制得每1 mL含五味子醇甲、五味子醇乙、五味子甲素、五味子乙素分别为256.86、63.77、 25.38、58.19 μg的混合对照品溶液。精密移取已知含有量的正常红参生脉饮样品溶液 2 mL, 分别加入上述的混合对照品溶液 2 mL,定容至5 m L量瓶,平行制备6份供试溶液。在上述色谱条件下注入液相色谱仪,测得4个五味子木脂素的量, 结果见表3。
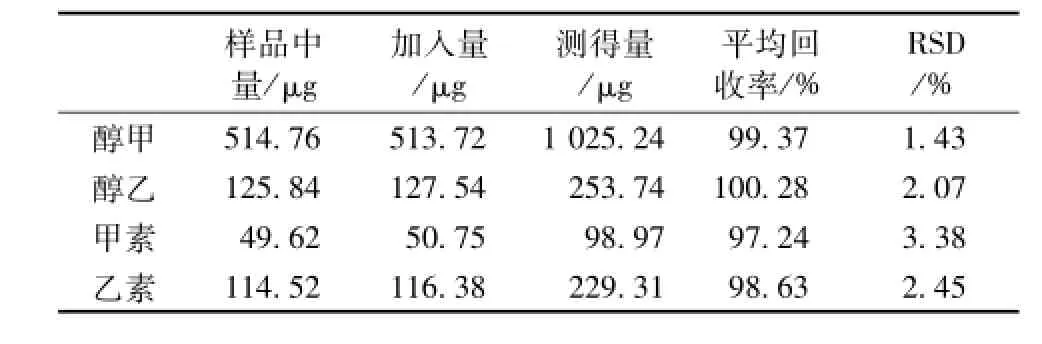
表 3 五味子木脂素回收率 (n=6)Tab.3 Recoveries of ginsenosides( n=6)
2.4.9 结果分析 取各生脉饮制品 10mL(规格:每支装 10mL), 按 “2.4.3” 项下制备供试品溶液,在上述色谱条件下测定五味子醇甲、五味子醇乙、 五味子甲素、 五味子乙素, 结果见表4。

表 4 加糖红参生脉饮制品中木脂素 (n=3)Tab.4 Content of lignans in Shengmai Oral Liquid of sweetened red ginseng (n=3)
由表4可知,加糖红参生脉饮制剂中五味子醇甲、五味子醇乙、五味子甲素、五味子乙素的量均低于正常红参生脉饮,除 40%加糖红参组比 20%加糖红参组五味子甲素量略高外,随加糖量增加,五味子木脂素含有量相应减少, 其中 10%加糖红参组木脂素含有量与正常红参组均没有显著性差异, 但与其他两组有显著性差异, 并且 20%加糖红参组五味子醇甲含有量与 40%加糖红参组相比较,也存在显著差异。
3 讨论
以加糖红参为原料不但影响生脉饮制剂中人参皂苷类成分含有量,而且对生脉饮中木脂素类成分也有不良影响。可能由于加糖红参增加了药材粗粉的黏度,影响生脉饮生产过程中渗漉环节,使得木脂素类成分不能被完全浸提出来,最终造成生脉饮中五味子木脂素类成分也相应减少。同时,有研究表明市售与自制生脉饮质量差异显著[13], 与本实验结果相一致,我们推测市售生脉饮所用红参很有可能为加糖红参。
综上,加糖红参不仅对其自身质量危害严重,以其为原料的中药制剂更同受其害,并造成大量资源浪费。目前,《中国药典》 仅规定薄层色谱检验法[1], 以此很难保证生脉饮质量。 本研究通过实测分析,探讨加糖红参对生脉饮质量的影响,试图通过测定有效成分量对红参加糖量予以间接控制,当红参加糖量超过 10%时, 即对生脉饮质量造成显著影响,为中药制剂生脉饮质量控制及质量标准的完善提供依据。
[ 1 ] 国家药典委员会.中华人民共和国药典:2010 年版一部[S].北京: 中国医药科技出版社, 2010:653-654.
[2] 邝凝丹.中药红参被曝约两成加糖, 为博重秤不择手段[N].大洋网-信息时报, 2011-01-26.
[3] 张颜彤,李淑惠,章春宇.对 “生脉饮” 中三种中药作用的分析[J].中国实用医药, 2009, 4(23):130-131.
[4] 李卓艳,李德坤,周大铮,等.正交试验法优选红参加工工艺[ J].中成药, 2011, 33(6):1005-1007.
[5] 李 震,刘 兵,李文艳.改进工艺提高红参加工质量[J].人参研究, 2010, 3(3):37.
[ 6 ] 邝凝丹.中药红参被曝约两成加糖[J].科学养生, 2011 (4):48.
[ 7 ] 邵云生.影响 “生脉饮口服液” 澄明度的因素[J].黑龙江中医药, 1999, (1):51-52.
[ 8 ] 李建修, 杨兴礼.生脉饮工艺改进及稳定性考察[J].中成药, 1988, (8):2-3.
[ 9 ] 孙成贺, 王英平.HPLC-ELSD法测定人参茎、 叶、 根中 7种人参皂苷含量[J].特产研究, 2009(4):54.
[10] 黄海欣.ELSD-HPLC法测定生脉饮中人参皂苷 Re、 Rgl和Rbl的含量[J].中国药师, 2010, 13(7):1045-1046.
[11] 何海冰, 唐 星, 于叶淼.生脉粉针剂中五味子醇甲和总木脂素的含量测定[J].沈阳药科大学学报, 2005, 22(4): 282-283.
[12] 欧金梅, 罗捷华.HPLC法测定生脉饮中五味子醇甲含量[J].安徽中医学院学报, 2006, 25(1):33-34.
[13] 潘晓丽.生脉饮质量评价方法研究 [D].成都: 成都中医药大学, 2009:11-22.
Influence of heavy sugar red ginseng on quality of Shengmai Oral Liquid
PANG Shi-feng, XU Shi-quan, CUILi-li, SUN Cheng-he, ZHANG Hao, WANG Ying-ping*
(Institute of SpecialWild Economic Animal and Plant Science, CAAS, Changchun 130112, China)
Shengmai Oral Liquid;heavy sugar red ginseng; ginsenoside; lignans; HPLC
R927.2
:A
:1001-1528(2014)02-0362-05
10.3969/j.issn.1001-1528.2014.02.032
2013-04-15
吉林省科技支撑计划 (20100926)
逄世峰 (1983—) , 男, 研实员, 研究方向: 药用植物质量评价。 E-mail:psf5295@sohu.com
*通信作者: 王英平 E-mail:yingpingw@126.com
