天竺桂多酚提取物降血糖活性研究
2014-04-11李医明陈凯先
陈 亮, 孙 鹏,, 王 婷, 徐 娜, 贾 琦*, 李医明, 陈凯先,4
(1.上海中医药大学 中药学院,上海 201203;2.中科院上海药物研究所 第三药理研究室, 上海 201203;3.河南省南阳市中心医院 内分泌科, 河南 南阳 473009; 4.中国科学院上海药物研究所 新药研究国家重点实验室, 上海 201203)
天竺桂多酚提取物降血糖活性研究
陈 亮1, 孙 鹏1,2, 王 婷2, 徐 娜3, 贾 琦1*, 李医明1, 陈凯先1,4
(1.上海中医药大学 中药学院,上海 201203;2.中科院上海药物研究所 第三药理研究室, 上海 201203;3.河南省南阳市中心医院 内分泌科, 河南 南阳 473009; 4.中国科学院上海药物研究所 新药研究国家重点实验室, 上海 201203)
目的 研究天竺桂提取物中多酚的结构类型及降糖活性。 方法 运用 HPLC及 ESI-MS 方法确定多酚的结构,利用噻唑蓝法测定细胞活力评价天竺桂提取物对棕榈酸或过氧化氢损伤的 INS-1 细胞的保护作用, 利用 db/db自发 2型糖尿病小鼠观察天竺桂提取物对糖尿病小鼠糖代谢的影响。 结果 天竺桂提取物中多酚主要为 B-型多酚; 提取物能剂量依赖地保护棕榈酸或过氧化氢诱导损伤的 INS-1 细胞, 并且显著抑制过氧化氢引起的 INS-1 细胞内活性氧增加;200mg/kg剂量给药 4 周后降低了 db/db小鼠空腹血糖, 改善了口服糖耐量, 显著增加了胰岛素耐量。 结论 天竺桂多酚为 B-型多酚, 具有一定的降糖活性, 其机制可能为减少胰岛 β细胞活性氧水平, 抵抗氧化应激对 β细胞的损伤,从而保护胰岛β细胞。
天竺桂; 多酚; INS-1 胰岛 β细胞; db/db 2 型糖尿病小鼠; 抗糖尿病
桂 皮 Cinnamon 为樟 科 Lauraceae植物 天竺桂Cinnamomun japonicum Sieb.、 阴 香 C.burmannii (Nees)Blume、 细叶香桂 C.chingii M.et Calf以及肉桂 C.cassia Presl等树皮的通称[1], 为药食两用植物。近年来国内外研究表明,桂皮具有明显的降血糖作用[2-6], 其多酚 类成分被认为是其 降血糖作用的主要物质基础[5]。 天竺桂分布于我国广东、广西、江西等省,具有暖脾胃,散风寒,通血脉作用。作为桂皮的一种资源,其中的多酚成分和降血糖作用还未见深入研究。
本研究的目的是确定天竺桂提取物中含有的主要多酚类成分的类型,并利用大鼠胰岛瘤细胞INS-1 及自发 2 型糖尿病 db/db小鼠模型, 研究富含天竺桂多酚的提取物对胰岛β细胞的保护作用及在体降糖效果,评价该类提取物的降糖活性并初步探讨其抗糖尿病机制。
1 材料与仪器
1.1 实 验 材 料 天 竺 桂 Cinnamomun japonicum Sieb.2011 年购买于江西, 由复旦大学顾关云教授鉴定,样品保存在上海中医药大学中药学院中药化学教研室。
1.2 实验主要试剂 RPMI1640 细胞培养基、 胎牛血清和胰蛋白酶购自 Hyclone; 活性氧检测试剂盒购自碧云天生物有限公司; Beta巯基乙醇、 噻唑蓝购自sigma; 二甲亚砜购自国药集团化学试剂有限公司。
1.3 对照品 compound 1 ~3 为作者实验室自己分离和鉴定的多酚, 经 HPLC检测它们的纯度均在95%以上。 结构分别是 compound 1 为 procyanidin B2; compound 2 为 (-)-epicatechin; compound 3为 procyanidin C1(图 1)。

图 1 对照品 com pounds 1 ~3 结构Fig.1 Structure of reference compounds 1 ~3
1.4 主要仪器和设备 Agilent1200 高效液相色谱仪 (DAD为检测器); 赛默飞世尔科技 Thermo-LCQ FleeT ESI-MS 分析仪; 罗氏 ACCU-CHEK血糖仪及血 糖试 纸; Thermo Fisher恒 温 细 胞 培 养 箱;MD公司 (MolecularDevice)Flexstation 3 酶标仪。
2 实验方法
2.1 药学部分
2.1.1 样品制备 天竺桂药材粗粉 1.12 kg, 用10 倍量的 50%丙酮-水溶液 40 ℃搅拌提取 2 次,每次2 h。 滤液合并浓缩至无丙酮味后,浓缩液依次用乙醚和乙酸乙酯萃取3次,回收乙酸乙酯层得到富含天竺桂多酚样品 (TZG)27.1 g。
2.1.2 HPLC测定条件 Agilent Extend-C18色谱柱(250 mm×4.6 mm, 5 μm);流动相乙腈 (A)-0.02%三氟乙酸 (体积分数, B), 梯度洗脱:0 ~20 min, 10% ~35%A(体积分数); 20 ~35 min,35% ~50%A( 体积分数)。 体积流量 1 mL/min;柱温30 ℃; 检测波长 280 nm。
2.1.3 多酚的含量测定方法 参照 2010 年版 《中国药典》鞣质含量测定法对样品中多酚含量进行测试[7]。
2.2 药理学部分
2.2.1 细胞培养 大鼠胰岛瘤细胞株 INS-1 细胞来自 ATCC, 培养基使用 RPMI1640 及 10%胎牛血清培养, 培养基中添加 50 μmol/L beta巯基乙醇,于 37 ℃ 5%CO2恒温细胞培养箱常规培养。 实验前细胞使用胰蛋白酶消化, 均匀铺板于 96 孔细胞培养板 (NUNC) 中,每孔细胞数为 2.5 万, 24 h后开始实验。
2.2.2 细胞活力实验 接种于 96 孔板的 INS-1 细胞分为空白对照组、棕榈酸刺激组和棕榈酸刺激加药组 ( 浓度梯 度:100、50、 25、 12.5 μg/mL)。每孔细胞加入 0.4 mmol/L棕榈酸于 37 ℃ 5%CO2恒温细胞培养箱孵育48 h, 空白对照组以等体积溶剂代替。加药组加入上述浓度梯度天竺桂多酚,与棕榈酸同时孵育48 h。 孵育结束后, 每孔细胞加入0.5 mg/mL的噻唑蓝试剂, 于 37 ℃ 5%CO2恒温细胞培养箱孵育4 h后,吸去培养基,每孔细胞加入 100 μL二甲亚砜溶解, 于 492 nm下读取吸收值, 评价天竺桂多酚对棕榈酸损伤的 INS-1 细胞活力影响。
在过氧化氢刺激的 INS-1 细胞模型中, 以 50 μmol/L过氧化氢代替棕榈酸, 孵育时间为 20 min,加药 组 浓 度 梯 度 为 400、 200、 100、50、25、12.5、 6.25、 3.125 μg/mL, 其余步骤与棕榈酸刺激模型相同,评价天竺桂多酚对过氧化氢损伤的INS-1 细胞活力影响。
2.2.3 胞内活性氧检测 接种于 96 孔板的 INS-1细胞预先用不同浓度 (400、 200、 100、 50、 25、12.5、 6.25、 3.125 μg/mL) 天竺桂多酚孵育 2 h,用无血清培养基洗1遍后,加入活性氧检测试剂孵育 1 h, 吸去培养上清, 加入 50 μmol/L过氧化氢损伤 20 min, 使用 488 nm激发波长, 在 525 nm下读取荧光吸收值,评价天竺桂多酚对过氧化氢刺激下 INS-1 细胞胞内活性氧水平的抑制情况。
2.2.4 自发 2 型糖尿病 db/db小鼠体内降糖活性评价 C57BL/KsJ db/db小鼠 (美国 Jackson 实验室), 雄性, 8 周龄, 体质量 (35 ±2)g, 用于本次实验。 小鼠按照 SPF级动物饲养标准操作规程饲养。所有动物实验经中国科学院上海药物研究所实验动物管理与使用委员会批准 (许可证号: SIMM-2011-01-WHY-04) 。
db/db小鼠随机分为 4 组: 对照组 (Control,灌胃给予 0.5%质量分数的羧甲基纤维素钠), 天竺桂提取物 100 mg/kg给药组 (TZG-100), 天竺桂提取 物 200 mg/kg给药 组 (TZG-200), 每组 6只, 阳性对照组 (罗格列酮 15 mg/kg剂量组,Rosi-15)。 每天 14 ∶00 ~16 ∶00 pm.之间灌胃给药 1次,持续4周。
2.2.5 体质量、 血糖变化及口服葡萄糖耐量及胰岛素耐量检测 小鼠定期记录体质量、饮食量和饮水量。每周各组小鼠禁食6 h后,尾静脉采血,利用罗氏 ACCU-CHEK血糖仪及血糖试纸测量空腹血糖水平。 给药 4 周后, 各组小鼠禁食 12 h检测血糖后, 行口服葡萄糖耐量实验 (Oral Glucose Tolerance Test, OGTT)。小鼠灌胃给予 1 g/kg葡萄糖溶液, 在给葡萄糖后 0、 15、 30、 60、 120 min 尾静脉采血测血糖浓度。 以时间-血糖浓度绘制 OGTT曲线,并计算曲线下面积。间隔1 d后,各组小鼠禁食 6 h,行 胰 岛 素 耐 量 实 验 (Isulin Tolerance Test, ITT)。 小鼠腹腔注射 1 U/kg胰岛素, 给胰岛素后 0、 30、 60、 90、 120 min 测血糖。 以时间-血糖浓度绘制 ITT曲线, 并计算曲线下面积。
2.2.6 统计分析处理 所有统计均利用 PASW Statistics 18(SPSS 18.0) 进行。 统计数据使用平均数 ±标准差表示, 采用单因素方差分析 (One Way ANOVA), P<0.05 时认为有显著性差异。
3 结果
3.1 药学部分
3.1.1 多酚定量测定 根据 2010 年版 《中国药典》的方法测定天竺桂提取物中多酚的含有量。标准曲线为 Y=10.564 X-0.646 5, R2=0.999 2,测得总多酚为 39.37%。
3.1.2 天竺桂多酚的结构判断 用自制的 compound 1-3 作为对照品, 在同样测试条件下对天竺桂样品进行了 HPLC比对, 推测了 T1、 T2 和 T3 峰结构, 比对显示 T1 峰为 procyanidin B2; T2 峰为(-)-epicatechin; T3 峰为 procyanidin C1( 图 2)。对 T4 峰进行了 ESI-MS 正负离子扫描 ( 图 3), 发现它是分子质量为866 和1154 的二个多酚混合物。

图2 提取物与对照品的比对 (HPLC图谱)Fig.2 Compare extract with reference substances by HPLC

图 3 T4 峰的 ESI-MS图 (A.负离子图 B.正离子图)Fig.3 ESI-MS spectra of T4 peak.A.nagetive ion ESI-MS spectra; B.positive ion ESI-MS spectra
3.2 药理学部分
3.2.1 天竺桂提取物对棕榈酸或过氧化氢损伤的INS-1 细胞 活力的影响 0.4 mmol/L棕榈 酸刺激48 h后, INS-1 细胞活力较空白组显著下降, 而天竺桂提取物剂量依赖地拮抗了棕榈酸引起的 INS-1细胞活力下降 ( 与棕榈酸单独刺激组比较,**P<0.01,***P<0.001, 图 4)。 提示天竺桂多酚能够保护棕榈酸引起的 INS-1 细胞损伤。
50 μmol/L过氧化氢刺激 20 min 后, INS-1 细胞活力较空白组显著下降,而天竺桂提取物剂量依赖地拮抗了过氧化氢引起的 INS-1 细胞活力下降(与过氧 化 氢 单 独 刺 激 组 比较,**P<0.01,***P<0.001, 图 4)。 提示天竺桂多酚能够保护过氧化氢引起的 INS-1 细胞损伤。

图 4 提取物对损伤的 INS-1 细胞活力的影响Fig.4 Effects of TZG on cell viability of INS-1
3.2.2 天竺桂提取物对过氧化氢刺激的 INS-1 细胞胞内活性氧的影响 50 μmol/L过氧化氢刺激20 min后, INS-1 细胞胞 内活性 氧水平 显著升高,而天竺桂提取物剂量依赖地拮抗了过氧化氢引起的INS-1 细胞胞内活性氧水平 (图 5)。提示天竺桂多酚能够抑制过氧化氢引起的 INS-1 细胞胞内活性氧升高。
3.2.3 天竺桂提取物对 db/db小鼠体质量及血糖的影响 给药 4 周时,天竺桂提取物对 db/db小鼠摄食、摄水 (数据未显示) 及体质量与对照组相比均无明显影响 (图6)。 同时, 天竺桂提取物在db/db小鼠上 100 mg/kg剂量组 (TZG-100) 与 200 mg/kg剂量组 (TZG-200) 给药 2 周时, 空腹 6 h血糖无明显变化, 此时罗格列酮 15 mg/kg剂量组已有显著下降。 给药 4 周后, 虽然 100 mg/kg剂量组 db/db小鼠空腹 6 h 血糖有下降趋势但无统计学差异, 200 mg/kg剂量组空腹 6 h 血糖较对照组显著下降, 降糖效果接近罗格列酮 15 mg/kg剂量组(*P<0.05,图6)。
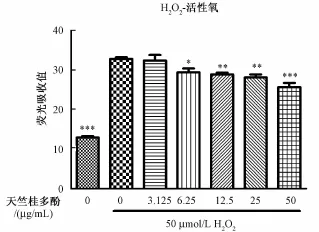
图 5 提取物对 INS-1 细胞胞内活性氧的影响Fig.5 E ffect of TZG on reactive oxygen level in INS-1 cells
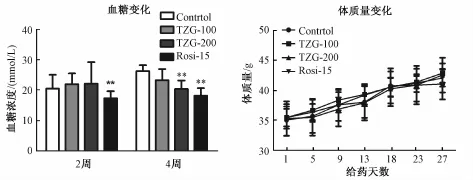
图6 提取物对小鼠体质量及血糖的影响Fig.6 Effect of TZG on blood glucose and body weight change in m ice
3.2.4 天竺桂提取物对 db/db小鼠口服糖耐量及胰岛素耐量的影响 结果显示,天竺桂提取物在200 mg/kg剂量给药 4 周后,db/db小鼠口服糖耐量得到有效改善, 曲线下面积 (AUC) 统计结果显示 200 mg/kg剂量给药组与对照组具有显著性差异 (*P<0.05, 图 7)。 同时, ITT结果显示, 给药 4 周后,天竺桂提取物剂量依赖地改善了 db/db小鼠胰岛素耐量, 在 200 mg/kg剂量时 ITT曲线下面积与对照组相比, 显著降低 (**P<0.01, 图7)。 天竺桂提取物在 200 mg/kg的改善糖耐量及胰岛素耐量效果均接近于 15 mg/kg剂量组的阳性对照罗格列酮。
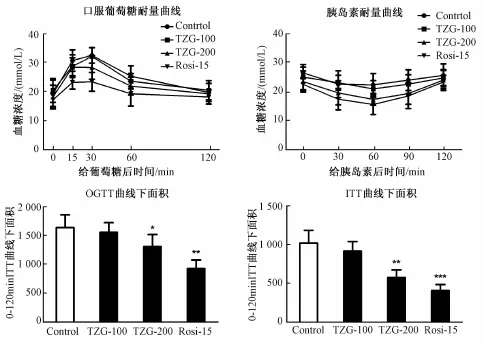
图 7 提取物对小鼠 OGTT和 ITT的影响Fig.7 Effect of TZG on OGTT and ITT in m ice
4 讨论
文献记载,桂皮中的原花青素类多酚成分主要有两种结构类型,一种是原花青素各单元间通过C4 ~C8 或 C4 ~C6 方式由一根键连接而成的 B-型多酚, 其三聚体和四聚体的分子量分别是 866 Da和 1154 Da; 另一种是原花青素间通过 C2-O-C7 和C4-C8 两个键同时相连而成的 A-型多酚, 其三聚体和四聚体的分子量分别是 864 Da和 1152 Da[8]。天竺桂中含有的多酚经 HPLC比对分析和 ESI-MS扫描, 可知主要属于 B-型多酚。参照 《中国药典》鞣质含量测定法测得样品中多酚含量为 39.37%。样品中的其它成分根据多酚样品的提取方法推断,应该是一些极性比较大的成分, 该类成分与 α-萘酚-浓 H2SO4没有显色反应, 说明样品中不含糖类。HPLC在相同条件下比对也不含有桂皮醛, 苯甲酸。 因样品呈浅褐色, 我们推测 39.37%以外的部分应该是一些水溶性的色素和大分子量的鞣质等。
原青花素类多酚低聚物的抗氧化作用多有报道[9],该类化合物能够有效减少应激条件下的细胞活性氧水平增加[10]。 INS-1 细胞是来自于大鼠胰岛瘤的细胞,具有胰岛素分泌功能,在体外与胰岛β细胞功能类似[11]。 在 2 型糖尿病的发病过程中,胰岛β细胞在长期高糖高脂环境下逐渐受到损伤,发生凋亡[12]。 该过程中, 氧化应激具有非常重要的作用[13]。 本实验中所使用的 0.4 mmol/L质量浓度的棕榈酸为一类不饱和脂肪酸,能够有效模拟体内高脂对胰岛 β细胞的损伤[12]。 结果显示, 天竺桂提取物能够剂量依赖的保护 48 h的棕榈酸长期作用引起的 INS-1 细胞损伤, 提示化合物对胰岛 β细胞具有保护作用。为研究其保护机制,我们使用过氧化氢增加细胞活性氧水平损伤 INS-1 细胞, 结果发现,天竺桂提取物能够剂量依赖地抑制过氧化氢对 INS-1 细胞的损伤, 提示在 INS-1 细胞中,天竺桂提取物能够有效对抗过氧化氢引起的细胞活性氧升高,该机制可能是天竺桂多酚保护棕榈酸引起的细胞活力下降的主要原因之一。为确证天竺桂提取物的抗氧化作用,我们检测了细胞内活性氧水平,结果证实了这一推测,天竺桂提取物剂量依赖的减少了过氧化氢引起的 INS-1 细胞胞内活性氧水平升高,证实该提取物可以有效对抗胰岛β细胞活性氧水平升高引起的细胞损伤,从而保护长期高脂高糖作用下胰岛β细胞。这可能是多酚类化合物对抗糖尿病的主要作用机制之一。
为了验证天竺桂提取物在体降糖效果,我们利用 db/db自发 2 型糖尿病小鼠进行在体降糖药效评价。 临床上应用桂皮开展降糖治疗时,1 到10 g每天每人剂量均能够有效改善糖尿病患者空腹血糖[3]。 因此, 根据临床剂量换算, 本实验中选择100 及 200 mg/kg剂量在 db/db小鼠模型上评价其体内降糖活性。实验结果表明,天竺桂提取物连续给药4周后,对小鼠体质量无显著影响,提示提取物无明显毒性。 同时 200 mg/kg剂量给药组 db/db小鼠空腹血糖与对照组相比显著降低;口服糖耐量实验表明天竺桂提取物能够有效改善 db/db小鼠糖耐量;给药4周后胰岛素耐量实验表明,天竺桂提取物在 200 mg/kg剂量能够显著改善 db/db小鼠胰岛素耐量。罗格列酮为一类过氧化物酶体增殖物激活受体 γ(PPARγ) 激动剂, 能够有效增加胰岛素敏感性, 降低血糖[14]。 利用罗格列酮在 15 mg/kg剂量做阳性对照, 发现天竺桂提取物在 200 mg/kg剂量对改善空腹血糖、口服糖耐量及胰岛素耐量与罗格列酮接近, 均能够显著改善 db/db小鼠糖尿病症状。以上结果表明,天竺桂提取物长期给药能够有效降低 db/db小鼠血糖, 改善小鼠糖耐量, 提高小鼠胰岛素耐受, 有效改善了 db/db自发 2 型糖尿病小鼠的糖尿病症状。
综上所述,天竺桂多酚提取物具有一定的降糖活性,其主要机制可能是通过减少胰岛β细胞在高脂高糖环境下的氧化应激,保护β细胞,维持β细胞的胰岛素分泌功能,增加外周组织对胰岛素的敏感性, 从而改善了 db/db小鼠糖尿病症状。 提取物中聚合多酚成分主要为原花青素单位间通过单键相连的 B-型多酚, 该类型多酚可能在该过程中发挥重要作用。
[ 1] 李家实.中药鉴定学[M].上海: 上海科技出版社,1996:301.
[ 2 ] Verspohl E J, Bauer K, Neddermann E.Antidiabetic effect of Cinnamomum cassia and Cinnamomum zeylanicum in vivo and in vitro[ J] .Phytother Res, 2005, 19(3):203-206.
[ 3 ] Khan A, Safdar M, Mohammad M A, et al.Cinnamon improves glucose and lipids of people with Type 2 diabetes[ J]. Diabetes Care, 2003, 26(12):3215-3218.
[ 4 ] Akilen R, Tsiami A, Devendra D, et al.Glycated haemoglobin and blood pressure-lowering effect of cinnamon in multi-ethnic Type 2 diabetic patients in the UK:a randomized, placebocontrolled, double-blind clinical trial[ J].DiabetMed, 2010,27(10):1159-1167.
[ 5 ] Anderson R A, BroadhurstC L, Polansky M M, et al.Isolation and characterization of polyphenol type-A oligomers from Cinnamon with insulin-like biological activity[ J] .J Agric Food Chem, 2004, 52(1):65-70.
[ 6 ] Jia Q, Lu X, Wu X, etal.Hypoglycemic activity ofa polyphenolic oligomer-rich extract of Cinnamomum parthenoxylon bark in normal and streptozotocin-induced diabetic rats[ J] .Phytomedicine, 2009, 16(8):744-750.
[ 7 ] 国家药典委员会.中华人民共和国药典:2010 年版一部[S].北京: 中国医药科技出版社, 2010: 附录 62.
[ 8 ] Porter L J, Harbone JB.Flavans and proanthocyanidins[ M]. New York:Chapman and Hall Ltd, 1988:21-63.
[ 9 ] Thomas O I, Abiodun O O, Abiola O S, et al.Doubly linked,A-type proanthocyanidin trimer and other constituents of Ixora coccinea leaves and their antioxidantand antibacterial properties[ J] .Phytochemistry, 2010, 71(17/18):2092-2098.
[10 ] Jose JL, Isaac J, Gines M S, et al.Cinnamtannin B-1 as an antioxidant and platelet aggregation inhibitor[ J] .Life Sci,2008, 82(19/20):977-982.
[11 ] AsfariM, Janjic D, Meda P, et al.Establishment of2-mercaptoethanol-dependent differentiated insulin-secreting cell lines[ J] .Endocrinology, 1992, 130(1):167-178.
[12 ] Abaravicience SM, Lundquist I, Galvanovskis J, et al.Palmitate-Induced β-Cell Dysfunction Is Associated with Excessive NO Production and Is Reversed by Thiazolidinedione-Mediated Inhibition ofGPR40 Transduction Mechanisms[ J] .PLoSOne,2008, 3(5):2182.
[13] Kajimoto Y, Kaneto H.Role of oxidative stress in pancreatic beta-cell dysfunction [ J] .Ann N Y Acad Sci, 2004, 1011: 168-176.
[14] Fei Y, Rongya T, Weina C, et al.Utilization of fluorescence tracer in hyperinsulinemic-euglycemic clamp test inmice[ J].J Biochem BiophysMethods, 2008, 70(6):978-984.
Hypoglycem ic activity of polyphenol-rich extract from Cinnamomun japonicum Sieb
CHEN Liang1, SUN Peng1,2, WANG Ting2, XU Na3, JIA Qi1*, LIYi-ming1,CHEN Kai-xian1,4
(1.School of Pharmacy, Shanghai University of Traditional Chinese Medicine, Shanghai201203, China; 2.The Third Department of Pharmacology,Shanghai Instituteof Materia Medica, Shanghai201203, China; 3.Departmentof Endocrinology, Central Hospital of Nanyang, Henan 473009, China;4.State Key Laboratory of Drug Research, Shanghai Institute of Materia Medica, Shanghai 201203, China)
AIM To explore the structure and hypoglycemic activity of the polyphenols-rich extract isolated from Cinnamomun japonicum Sieb.M ETHODS HPLC and ESI-MSmethods were employed to characterize their structures.The biological activity of the extractwas determined on pancreatic INS-1 βcells and db/db type 2 diabetic micemodel.The effects of the extracton the vitality of INS-1 cell under palmitate or H2O2stimulation were examined.RESULTS Themain polyphenols found in C.japonicum extracts were identified as B-type polyphenols, and that the extract could protect INS-1 cells from palmitate or H2O2damage.The reaction oxygen levelwas also significantly reduced in the extract-treated INS-1 cells under H2O2induction in a dose dependentmanner.After the administration of the extract once daily for 4 weeks at the dosage of 200 mg/kg, the fasting blood glucose of db/db mice was reduced, and the oral glucose and insulin tolerances were also improved.CONCLUSION B-type polyphenols from C.japonicum have anti-diabetic activity.It could protect pancreatic beta cells from palmitate or H2O2induced damage via reducing the intracellular reaction oxygen level, which could be one possible reason forthe improvement in the symptoms of diabetes in db/db mice.
Cinnamomun japonicum Sieb.; polyphenol; pancreatic INS-1 beta cells; type 2 diabetic db/db mice; anti-diabetic activity
R285.5
:A
:1001-1528(2014)02-0229-07
10.3969/j.issn.1001-1528.2014.02.003
2013-03-07
国家自然科学基金面上项目 (81172951); 上海市中药现代化课题 (08DZ1972102); 上海市药剂学重点学科建设项目(J50302) ; 新药研究国家重点实验室开放课题 (SIMM1106KF-14)
陈 亮 (1986—) , 男, 博士生, 从事中药化学成分构效关系及 新药开发研 究。 Tel:(021)51322451, E-mail:clcivilian@ hotmail.com
