基于 GSE-1 细胞相关活性评价体系的延胡索总生物碱萃取纯化工艺研究
2014-04-11孟宪生包永睿
李 爽, 王 帅,2, 孟宪生,2*, 包永睿,2
(1.辽宁中医药大学药学院, 辽宁 大连 116600; 2.辽宁省现代中药研究工程实验室, 辽宁 大连 116600)
[制 剂]
基于 GSE-1 细胞相关活性评价体系的延胡索总生物碱萃取纯化工艺研究
李 爽1, 王 帅1,2, 孟宪生1,2*, 包永睿1,2
(1.辽宁中医药大学药学院, 辽宁 大连 116600; 2.辽宁省现代中药研究工程实验室, 辽宁 大连 116600)
目的 通过体外抗溃疡活性来评价延胡索总生物碱有机溶剂萃取的纯化工艺。方法 采用酸性染料比色法,以延胡索总生物碱纯度为指标, 考察大孔吸附树脂结合有机溶剂萃取纯化的总生物碱纯度, 并采用 MTT法测定 GSE-1细胞相关活性评价, 对总生物碱纯度和药效进行相关性分析。 结果 最佳纯化工艺为 1 mol/L的 HCl溶解树脂纯化物, 1 倍药液体积的三氯甲烷除杂, 药液加氨水碱化, 以 1 倍药液体积的有机溶剂, 按照三氯甲烷-乙酸乙酯-正丁醇的顺序分段综合萃取, 合并有机溶剂层。 结论 所建立的纯化工艺稳定可行, 总生物碱纯度 >90%, 体外抗 GSE-1 溃疡量效关系明确。
延胡索总生物碱;萃取;纯化工艺;抗溃疡;体外
延胡索为罂粟科植物延胡索 Corydalis yanhusuo W.T.Wang的干燥块茎。 有活血, 行气, 止痛的功效。用于胸胁、脘腹疼痛,胸痹心痛,经闭痛经, 产后瘀阻,跌扑肿痛[1]。 延胡索主要有效成分为生物碱,主要为叔胺、季胺类生物碱。叔胺类生物碱在原药材中的量约为 0.65%, 季铵类生物碱 (如延胡索甲素、 乙素) 约为 0.3%[2]。 延胡索中的生物碱具有很强的抗炎镇痛、镇静、降压和抗心律失常等作用[3]。 通过文献调研, 近几年对于延胡索总生物碱的纯化没有达到理想的纯度,不利于明确药效物质基础、阐明作用机理以及新药的开发。根据课题组前期研究工作,延胡索提取物的主要有效组分是生物碱类,对无水乙醇造成的人胃黏膜上壁 ( GES-1) 细胞溃疡损伤有良好的抑制作用,本实验通过对延胡索总生物碱富集物的二次纯化,将总生物碱的纯度提高到 90%以上, 并通过体外 GSE-1 相关活性评价, 考察了一次纯化产物和二次纯化产物的量效关系,进一步阐明提取物的有效组分是生物碱类,为其剂型的改善及临床合理用药提供参考。
1 材料
脱氢延胡索甲素对照品 ( 批号 120604, CAS号 30045-16-0, 四川省维克奇生物科技有限公司,纯度≥98%); 延胡索乙素对照品 (批号 120604,CAS 号 30045-16-0, 四川省维克奇生物科技有限公司, 纯度≥98%); 延胡索药材由辽宁本溪三药有限公司提供;经辽宁中医药大学中药鉴定教研室翟延君教授鉴定为罂粟科植物 Corydalis yanhusuo W. T.Wang的干燥根; 均符合 《中国药典》 2010 年版一部有关规定。
人胃黏膜上皮细胞 (由上海艾研生物科技有限公司提 供); 小 牛 血清 ( 美国 GIBCO公 司);DMEM高糖 (美国 GIBCO公司); 青 /链霉素双抗(哈药集团制药总厂、 大连美罗大药厂); EDTA(天津基准化学试剂有限公司); 胰蛋白酶 (美国GIBCO公司)、 MTT ( 美 国 GIBCO公 司)、 DMSO(北京索莱宝科技有限公司)、 细胞培养板 (Corning costar, USA) 。
AB-8 购自南开大学化工厂; 无水乙醇 (天津市科密欧化学试剂有限公司)。
UV-1750 型 紫外 分 光 光 度 计 ( 日 本 岛 津 公司); CO2培养箱 (德国 NUAIRE公司), 倒置显微镜 (Motic公司), 酶标仪 (瑞士 TECAN公司)。
2 方法与结果
2.1 总生物碱的测定
2.1.1 对照品溶液的制备 精密称取干燥的脱氢延胡索甲素对照品 10.55 mg, 延胡索乙素 7.25 mg,分别置 50 mL量瓶中,加醋酸-醋酸钠缓冲液溶解并稀释至刻度, 摇匀备用 (每 1 mL含脱氢延胡索甲素 0.211 mg, 每 1 mL含延胡索乙素 0.145 mg)。
2.1.2 延胡索总生物碱一次纯化产物的制备 精密称取延胡索药材粉末 (过三号筛)约 250 g,根据文献[4-6] 报道, 加 6 倍量 70% 乙醇, 提取 3次, 每次2 h, 过滤, 合并滤液, 减压浓缩, 加水稀释并定容至 500 mL, 采用 AB-8 树脂, 以药材树脂用量比 3 ∶1 (3 g药材∶1 mL湿树脂)上柱, 以10 倍量 90%乙醇洗脱, 收集洗脱液 10 BV, 水浴蒸干,即得总生物碱一次纯化产物富集物,其纯度可达 45.8%。
2.1.3 最大吸收波长的确定 根据延胡索总生物碱的性质, 参考有关文献[7], 选择酸性染料 比色法测延胡索总生物碱的量[8]。 精密量取 “2.1.1”项下的两种对照品溶液各 5 mL, 分别置预先精密加入三氯甲烷10mL的分液漏斗中, 各精密加入溴甲酚绿溶液 4 mL, 振摇提取 3 min, 静置 40 min 使分层, 分取三氯甲烷层, 以醋酸-醋酸钠缓冲液经同法操作的三氯甲烷液为空白, 在 190 ~800 nm波长内测定吸收光谱,结果两种对照品溶液均在413 nm波长处有最大吸收, 故确定 413 nm波长为测定波长。
2.1.4 标准曲线的建立 分别精密吸取 “2.1.1”项下的脱氢延胡索甲素、延胡索乙素对照品溶液各0.2、 0.3、 0.4、 0.5、 0.6、 0.7、 0.8 mL, 分别补加醋酸-醋酸钠缓冲液 0.8、 0.7、 0.6、 0.5、 0.4、0.3、 0.2 mL, 按 “2.1.3” 项下方法操作,同时做空白组, 于 413 nm处测定吸光度 (Y)。以 Y对延胡索总生物碱质量浓度 (X) 进行线性回归, 分别 得 回 归 方 程 Y=4.835 5X+0.028 4 ( r= 0.999 4), Y=5.020 1X+0.075 9 (r=0.999 3)。结果表明在 0.042 2 ~0.147 7 mg,0.028 5 ~0.116 0 mg与Y呈良好线性关系。
2.2 总生物碱富集物的溶剂萃取
2.2.1 萃取液的制备 精密称取 “2.1.2” 项下所得的总生物碱一次纯化富集物 0.5 g, 加 1 mol/L的稀 HCl溶解, 并定容至 250 mL量瓶中 (使每 1 mL萃取液中含有 2 mg一次纯化产物), 摇匀,即得。
2.2.2 碱化试剂的选择 根据生物碱的性质, 考察氨水、三乙胺、碳酸钠、氢氧化钙、氢氧化钠5种试剂对总生物碱萃取率的影响。
精密称取5 份按 “2.2.1” 项下方法所得的萃取液各50 mL, 分别加入体积分数28%的氨水、 三乙胺、 碳酸钠、 氢氧化钙、 氢氧化钠溶液各8 mL,碱化 30 min, 再各加入三氯甲烷 50 mL, 振摇 3 min, 静置 1 h 使其分层, 收集三氯甲烷层, 蒸干,残渣加甲醇溶 解并定容至 10 mL量瓶 中, 按“2.1” 项下方法测 5 种样品的吸光度, 结果见表1。 结果表明, 经氨水碱化后的药液总生物碱纯度最大,故确定氨水为最佳碱化试剂。

表1 不同碱化试剂萃取后药液吸光度Tab.1 Absorbance of liquid med icine by using different alkaline reagents
2.2.3 萃取溶剂的选择 萃取剂的选择在萃取工艺研究中很重要,本实验根据生物碱的理化性质选择石油醚、三氯甲烷、乙酸乙酯、正丁醇、苯5种有机溶剂进行萃取实验。 精密吸取 4 份 “2.2.1”项下所得的萃取液各 50 mL, 萃取条件为室温25 ℃, 萃取剂与药液比为 1 ∶1, 表 2 是 20 ℃下 5种溶剂萃取的萃取率。

表2 不同溶剂的性质和对萃取效果的影响Tab.2 Nature of the different solvents and the influence on the extraction effect
结果可得不同溶剂的萃取率为三氯甲烷>正丁醇>乙酸乙酯>石油醚>苯。 经三氯甲烷萃取后总生物碱纯度可达 75%, 大大提高了一次纯化后富集物的纯度。
由于生物碱属于含氮碱性有机化合物,三氯甲烷是强偶极溶剂,可以给出质子,易与生物碱中的氮原子形成氢键产生溶剂化作用,增强了生物碱在三氯甲烷中的溶解 度[7], 再综合购买难度、溶剂回收难易等考虑,以下研究选用萃取能力较大、选择性好、沸点较低的三氯甲烷作为主要萃取溶剂进行实验。
2.2.4 萃取方法的优化 根据延胡索总生物碱极性特点,选择三氯甲烷、乙酸乙酯、正丁醇3种有机溶剂综合分段萃取,依次按照极性从小到大和极性从大到小的顺序比较萃取后总生物碱的纯度。
试验分组及萃取方法 精密称取 4 份 “2.2.1”项下所得的萃取液50 mL,分别至 4 个分液漏斗中,萃取条件为室温 25 ℃, ①向分液漏斗中加入 50 mL三氯甲烷, 振摇 3 min, 静止 1 h, 弃三氯甲烷层,向分液漏斗中各加氨水 8mL调 pH至 10[9], 碱化 30 min, 再以萃取剂-萃取液 (1 ∶1)的比例, 分别按照三氯甲烷-乙酸乙酯-正丁醇的顺序萃取, 收集有机溶剂层,蒸干,即得。②萃取条件同①,只改变萃取溶剂的萃取顺序, 按照正丁醇-乙酸乙酯-三氯甲烷的顺序萃取,收集有机溶剂层,蒸干,即得。③向分液漏斗中加氨水 8 mL调 pH至 10, 以三氯甲烷-萃取液 (3 ∶1) 的比例萃取, 收集三氯甲烷层,蒸干, 即得。 ④向分液漏斗中加氨水8 mL调 pH至10, 以正丁醇-萃取液 (3 ∶1) 的比例萃取,收集正丁醇层,蒸干,即得。
所得4 组富集物分别精密称取 1 mg, 加入乙酸-乙酸钠缓冲液溶解并定容至 10 mL量瓶, 按“2.1” 项下方法测吸光度, 结果见表 3。
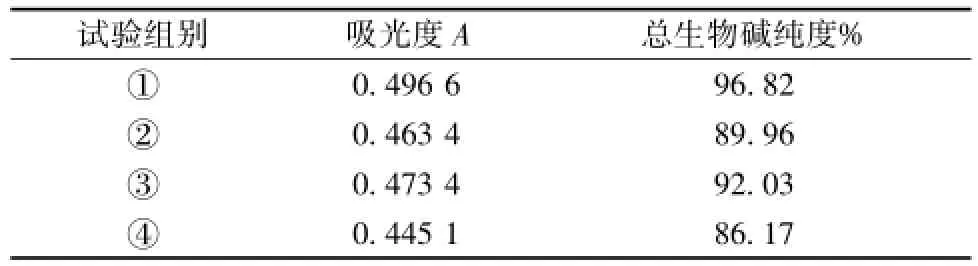
表3 不同萃取方法总生物碱纯度%Tab.3 Purity of the total alkaloids by using different extraction methods
总生物碱萃取率= [ (原萃取液质量浓度 ×原药液体积-萃取后剩余药液质量浓度×萃取后剩余药液体积) /原萃取液质量浓度 ×原药液体积]×100%
结果可知,①组所得总生物碱的纯度最高,优选的最佳萃取方法为一次纯化产物用 1 mol/L的 HCl溶解后, 先以 1 倍药液体积的三氯甲烷萃取除去非生物碱类杂质,弃掉三氯甲烷层,向药液中加入氨水 8 mL碱化, 再以萃取剂-萃取液(1 ∶1) 的比例, 分别按照三氯甲烷-乙酸乙酯-正丁醇的顺序分段综合萃取,收集并合并有机溶剂层,蒸干即得。
2.3 纯化工艺重复性试验 精密吸取 3 份按“2.2.1” 项 下 所 得 的 萃 取 液 各 50 mL, 均 按“2.2.3” 项下最佳萃取方法制备总生物碱二次纯化富集物,按 “2.1”项下方法测总生物碱的量,计算总生物碱萃取率及其纯度,结果显示该纯化工艺稳定、 可靠、 较理想,实验结果见表4。

表4 纯化工艺重复性试验Tab.4 ReProducibility of Purification technology tests
2.4 体外细胞药效学实验
2.4.1 细胞培养、 铺板、 造模和分组处理 人胃黏膜上皮细胞 GES-1 细胞株用 DMEM培养基加 10%的小牛血清, 在标准 CO2培养箱中常规培养 2 ~3 d,隔天换液, 约 90%满瓶时传代[10]。 取对数生长期、状态良好的细胞, 接种于 96 孔培养板, 每孔 100 μL(除空白调零孔外)。 设空白调零孔 (只加培养基,酶标仪调零用)、空白对照孔、 模型孔, 和给药试验孔 (给药试验孔分为 6 组), 每组设 6 个复孔。 置37 ℃ 5%CO2培养箱中继续培养约 12 h, 待细胞贴壁完全, 弃去旧培养液, 磷酸盐缓冲液 (PBS) 洗 2次,用不完全培养基同步24 h, PBS 洗2 次。
细胞损伤模型的制备 模型孔和给药试验孔分别补加100 μL 8%无水乙醇, 培养2 h 后吸弃培养基, PBS 洗 2 次。 经 MTT检测使细胞抑制率达到30%左右[11]。
2.4.2 MTT法测定细胞抑制率 供试品溶液的制备:按照常规给药剂量结合出膏率及总生物碱纯度,保证动物灌胃延胡索一次纯化产物和二次纯化产物富集物中所含总生物碱量均为高剂量 (48.6 mg/kg)、中 剂 量 (16.2 mg/kg)、低 剂 量 (5.4 mg/kg), 根据总生物碱纯度折合实际给药量为一次纯 化 产 物 高剂量组 108 mg/kg、 中剂量组 36 mg/kg、低剂量组 12 mg/kg, 二次纯化产物高剂量组 51.70 mg/kg、中剂量组 17.23 mg/kg、 低剂量组 5.74 mg/kg。
MTT法测定细胞抑制率 空白对照孔和模型孔分别补加 100 μL培养基培养 2 h 后吸弃培养基,PBS 洗 2 次。 空白对照孔和模型孔加入 100 μL 10%空白血浆, 给药试验孔分别加入供试品溶液经大鼠灌胃给药得到的含药血浆 100 μL, 体积分数为10%。各组细胞经分别处理后于 37 ℃、 5% CO2培养箱中继续培养 24 h, 每孔补加20 μL培养液, 继续培养 3 h, 每孔加入 200 μL/孔新鲜配置的含 0.2 mg/m LMTT的无血清培养液于 37 ℃CO2培养箱中培养 4 h, 吸弃上清液, 加入 DMSO 200 μL, 震荡混匀后易溶解结晶,用酶标仪于 490 nm波长处读取光密度值 A490, 测定 OD值。 按下式计算不同组细胞的生长抑制率。 MTT抑制率 =(OD试验组/OD对照组-1) ×100%[12]。 结果见表 5。

表 5 不同组别含药血浆对损伤 GES-1 细胞光密度及抑制率的影响Tab.5 Different effects on oPtical density of cell GSE-1 and inhibition rate
由表中可以看出,二次纯化产物低剂量组的体外药效指标优于一次纯化产物高剂量组的体外药效指标,并且随着剂量的增加,二次纯化产物的药效也逐渐增强。利用 SPSS 软件, 对总生物碱纯度和体外药效做相关性分析结果见表6。

表 6 延胡索总生物碱纯度与体外抗 GSE-1 细胞溃疡药效相关性分析Tab.6 Correlation analysis between the Purity of the total alkaloids and the effect on u lcer of extracorPoreal cell GSE-1
对一次纯化产物和二次纯化产物高剂量给药量的纯度 和 药 效进 行 Spearson Correlation 分 析。 见表7。
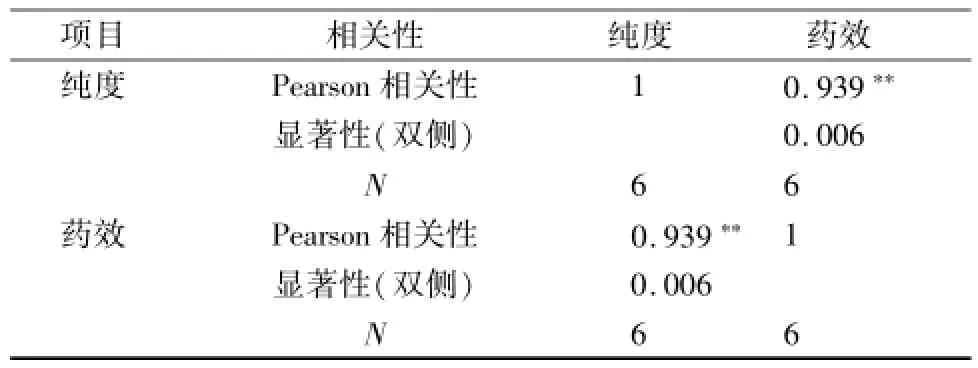
表7 延胡索总生物碱纯度和体外药效做相关性分析Tab.7 Correlation analysis betw een the Purity of the total alkaloids and the extracorPoreal Potency
SPSS 软件分析结果: Pearson 相关性 =0.939,显著性 ( 双侧) =0.006, N=6; 在 0.01 水平(双侧) 上显著相关。由结果可知在总生物碱量保持相等的条件下,纯度和药效存在高度的正相关,相关系数为 0.939, 双侧 P<0.01, 具有统计学意义。
3 讨论
3.1 延胡索生物碱成分复杂, 化学结构和极性相似,本实验对延胡索总生物碱纯化工艺进行优化,结果显示, 延胡索药液经 AB-8 树脂纯化所得的一次纯化产物总生物碱含有量可达 45%以上, 仍然含有大量的其他成分。因此,本实验通过多种萃取方法对其进行进一步纯化, 其纯度可达 90%以上,在国内文献中尚未见报道,有利于明确总生物碱的药效,为进一步阐明其总生物碱成分组成及实验所需奠定基础。
3.2 由于生物碱难溶于水, 但是生物碱盐的形式溶于稀酸水中, 所以用 1 mol/L的 HCl溶解, 加入三氯甲烷可以将非生物碱类杂质萃取到三氯甲烷层;此时向药液中加入碱化试剂可使生物碱盐重新以生物碱的形式游离出来,有利于有机溶剂的进一步萃取,提高总生物碱的萃取率和纯度。优选的纯化工艺为延胡索总生物碱一次纯化产物用 1 mol/L的 HCl溶解, 先以等体积比的三氯甲烷萃取弃三氯甲烷层,再按照三氯甲烷、乙酸乙酯、正丁醇的顺序, 以萃取液-萃取剂 (1 ∶1) 的体积比分段萃取,合并3次萃取的有机溶剂层,蒸干即得延胡索总生物碱二次纯化产物,此时总生物碱纯度可达90%以上。 本方法稳定、 可靠、纯度理想, 为最小剂量最高药效、阐明作用机理、组分表征以及研发新药奠定了基础。
3.3 本实验选用三氯甲烷作为主要萃取溶剂,由于生物碱属于含氮碱性有机化合物,三氯甲烷是强偶极溶剂,可以给出质子,易与生物碱中的氮原子形成氢键产生溶剂化作用,增强了生物碱在三氯甲烷中的溶解度,并综合其萃取能力强、选择性好、毒性低、沸点较低、溶剂回收难易等条件,因此选用三氯甲烷作为实验的萃取溶剂。
3.4 本实验通过 MTT法测定细胞抑制率, 比较一次纯化产物高、中、低剂量组,和二次纯化产物高、中、低剂量,对体外无水乙醇所致的的人胃黏膜上皮细胞损伤模型的抑制率,发现随着剂量的增大,药效也逐渐增大,并且在总生物碱用量保持相等的前提下,二次纯化产物的药效高于一次纯化产物的药效,由此说明本研究优选出的萃取纯化工艺不仅是纯度提高到 90%以上, 还大大提高了药效,减小了用药剂量,并且为以后的临床作用机制以及新药的开发奠定基础。
3.5 本实验利用 SPSS 软件, 对一次纯化产物和二次纯化产物高剂量给药量的纯度和药效进行 Spearson Correlation 分析。 结果值为 0.939, 且双侧 P<0.01, 具有统计学意义,说明纯度和药效存在高度的正相关,即随着纯度的提高,药效也逐渐增大,进一步阐明了提高总生物碱纯度的意义,为阐明作用机理、组分表征以及研发新药奠定了基础。
[ 1 ] 国家药典委员会.中华人民共和国药典: 2010 年版一部[S].北京: 中国医药科技出版社, 2010: 94.
[2] 贺 凯,高建莉,赵光树.延胡索化学成分、药理作用及质量控制研究进展[J].中草药, 2007, 38(12): 1909.
[3] 鲁春梅,张春森,姜立勇.延胡索化学成分及药理作用研究进展[ J].中国现代药物应用, 2011, 5(15) : 126-127.
[4] 邹 薇,张 鹤,包永睿,等.延胡索提取工艺的优化及化学成分与药效指标相关性分析[J].中草药, 2012, 43(4): 694-698.
[ 5 ] 廖 维, 夏新华.延胡索提取工艺的研究[J].中成药,2004, 26(10): 94-96.
[6] 杨欣欣,王 巍, 包永睿, 等.知母治疗湿热痹证有效物质组纯化工艺优选[ J].中国实验方剂学杂志, 2012, 18(8): 7-8.
[ 7 ] 周毅玲.酸性染料比色法测定延胡索总生物碱的量[J].中草药, 2008, 39(8): 1257-1258.
[8] 邹 薇,张 鹤, 孟宪生,等.毛细管电泳法测定延胡索中 2 种生物碱含量电泳条件优化研究[J].中国实验方剂学, 2012, 18(2): 59-61.
[9] 王洪新,马朝阳,陶冠军.苦豆子生物碱单体的分离纯化工艺研究[J].高校化学工程学报, 2007, 21(2): 196.
[10] 洪金标, 易受乡, 黄 芸, 等.艾灸血浆对离体人胃黏膜上皮细胞损伤的保护作用及其线粒体细胞凋亡通路机制针刺研究[J].世界华人消化杂志, 2011, 36(3): 157-159.
[11] 洪金标, 易受乡, 黄 芸, 等.艾灸血浆对乙醇损伤的人胃黏膜上皮细胞的影响[J].世界华人消化杂志, 2010, 18(31): 3287-3293.
[12] 钟振国, 梁 红, 钟益宁, 等.余甘子叶提取成分没食子酸的体外抗肿瘤实验研究[J].时珍国医国药, 2009, 20(8): 1954-1955.
Purification of total alkaloids from Corydalis Rhizoma based on evaluating liveness of extracorPoreal anti-ulcer about cell“GSE-1“
LIShuang1, WANG Shuai1,2, MENG Xian-sheng1,2*, BAO Yong-rui1,2
(1.College of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China; 2.Liaoning Provincial Modern Traditional Chinese Medicine Research and Engineering Laboratory, Dalian 116600, China)
AIM To optimize and screen the purity of total alkaloids from Corydalis Rhizoma with the aid of GSE-1.METHODS The purification of the total alkaloids was performed with organic solution and on macroporous adsorptive resins.Acid dye colorimetry was used to determine total alkaloids from R.Corydalis.MTT assay was used to evaluate the effectof depurantive total alkaloids on GSE-1 proliferation, and the correlation between the purity and potency of total alkaloids was studied.RESULTS The optimal extraction was that the purified extract was dissolved with 1 mol/L hydrochloric acid.And then the impurities were removed by double volume of chloroform , ammonified, chloroform-acetoacetate-n-butanol extraction,three layers of organic solvent were collected and combined.CONCLUSION This process is reasonable and feasible the obtained purity of the total alkaloids ismore than 90%, with a explicit connection resistance to ulcer of GSE-1 in vitro.
total alkaloids from Corydalis Rhizoma; extraction; purification; anti-ulcer; in vitro
R285.5; R284.2
: A
: 1001-1528(2014)01-0056-06
10.3969/j.issn.1001-1528.2014.01.014
2013-04-16
国家自然科学基金项目 (81241111)
李 爽 (1987—) , 女, 硕士生, 研究方向: 药物分析。 Tel: (0411) 87406496, E-mail: 474159163@qq.com
*通信作者: 孟宪生 (1964—), 男, 教授, 研究方向: 中药组分配伍、 代谢组学及药品质量分析工作。 Tel: (0411) 87406496, E-mail: mxsvvv@126.com
