O1群霍乱弧菌PFGE分子分型和菌株流行能力关系研究
2014-04-09陈爱平杨劲松李曲文徐海滨王灵岚郑金凤严延生
陈爱平,杨劲松,李曲文,徐海滨,王灵岚,郑金凤,严延生
福建省自1962年发生埃尔托型霍乱弧菌(EVC)引起的霍乱以来,疫情起伏不定,先后发生了几次较大流行。首次为1962-1964年,流行优势血清型为O1群小川;第2次为1978-1989年,流行优势血清型先为1978年O1群小川型,后转为稻叶型,流行时间持续近10年;第3次1994-2000年,流行优势血清型为O1群小川;2005年我省又发生了O1群稻叶的霍乱流行,疫情仅限于2005年;在福建省50年的霍乱流行过程中病原和流行特征都发生着改变。为阐明福建省不同时期、地域、不同血清群霍乱分离菌株间的遗传联系和遗传多样性,我们选择福建省1962-2005年代表性霍乱弧菌,运用脉冲场凝胶电泳(PFGE)技术进行分子分型,从细菌全基因组水平探索霍乱弧菌在福建省传播及流行规律;同时结合流行病学资料,根据疫情流行持续时间、相关疫情病例数等,分析不同PFGE型(簇)的霍乱菌株的流行能力。
1 材料方法
1.1实验用菌株 选择1962-2005年福建省历次霍乱流行,病人中分离保存的菌种77株;包括3次大流行的菌株(1962-1964年、 1978-1989年, 1994-2000年)、2005年菌株和2001-2003年散发病例的菌株;实验用菌株均经过血清学重新复核鉴定为O1群霍乱弧菌。菌株信息见图1。
1.2PFGE实验方法 根据 PulseNet USA(美国CDC)网络实验室推荐的标准方法,经国家CDC实验优化条件的基础上进行PFGE实验[1]。采用NotI限制性内切酶对实验菌株进行酶切,标准菌株H9812采用XbaI限制性内切酶消化,主要的电泳参数为电压梯度6 V/cm,电泳夹角120°,电泳温度14 ℃;电泳参数:2 s~10 s,13 h, 20 s~25 s ,6 h(ctxA基因阴性菌株在电泳液中加硫脲,终浓度为50 μmol/L)。
1.3数据分析 PFGE图像导入BioNumerics(version 6.0,Applied Maths,Inc)软件包进行处理,选择Dice相关系数和UPGMA方法,tolerance设置为1.5%。
1.4试剂仪器 Seakem Gold Agarose PFGE 级琼脂糖购自Lonza公司,XbaⅠ和NotⅠ限制性内切酶以及蛋白酶K购自美国NEB公司,BIO-RAD公司的Basic电泳仪、Gel Doc XR+读胶仪、CHEF MAPPER脉冲场凝胶电泳仪,BioMerieux Vitek公司的DENSIMAT细菌浊度仪。
2 结 果
2.177株霍乱弧菌PFGE分子分型结果 77株1962-2005年霍乱弧菌用NotⅠ酶切并进行脉冲场电泳后,DNA片段可得到较好地分离,可见大小不一的电泳条带,分子量从20~690 kb;菌株条带数目在21~26之间。利用Bionumerics软件的Cluster analysis模块进行聚类分析,菌株间条带相似度在75.3%~100%之间;按照100%的相似度可将菌株酶切图谱分为61个PFGE型,其中P1型有6株,P13、P14和P57型各有3株,其余各型为1-2株。根据TENOVER原则[2],只有1-3条带差异的菌株在遗传上可能有紧密相关性,按照90%的相似度将部分菌株酶切图谱划为同一个簇,可得到5个主要的PFGE簇(G1-G5)。见图1。

图177株霍乱弧菌PFGE分型结果
Fig.1NotI-digestedPFGEpatternsof77V.choleraeO1serogroupisolates
2.277株霍乱弧菌PFGE簇不同流行时期分布 第1次流行的菌株以G5 PFGE簇为主(6/9),同时存在G4和G1 PFGE簇;第2次流行的菌株以G1和G4 PFGE簇为主(18/24,6/24),第3次流行的菌株以G3和G4 PFGE簇为主(11/30,10/30),2005年流行的菌株以G2为主(6/6),2001-2003年散发的菌株没有优势的PFGE簇,具体见表1。
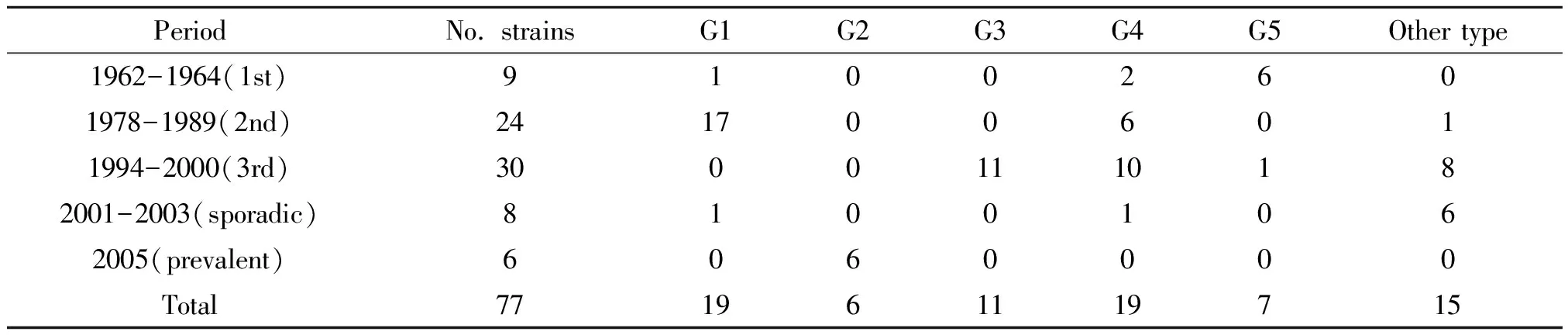
表1 77株1962-2005年霍乱弧菌PFGE 簇不同流行时期分布情况
2.352株小川血清型PFGE分子分型结果 52株小川型霍乱弧菌,按照100%的相似度可将菌株酶切图谱分为47个PFGE型。按照90%的相似度将部分菌株酶切图谱划为同一个簇,可得到4个主要的PFGE簇,命名为G1(o)-G4(o),o是小川型(Ogawa)的第一个字母;具体见图2。
2.4小川型PFGE 簇不同流行时期的分布情况 1962-1964年流行的菌株以G4(o)PFGE簇为主(7/9);1978年流行的菌株以G3(o)PFGE簇为主(6/8);1994-2000年流行的菌株以G2(o)PFGE簇为主(14/29);1994-2000年属于其它型别的小川型菌株有9/29;2001-2003散发的小川型菌株没有优势PFGE簇;具体见表2。
2.5稻叶血清型PFGE分子分型结果 25株稻叶型霍乱弧菌按照100%的相似度可将菌株酶切图谱分为15个PFGE型。按照90%的相似度将部分菌株酶切图谱划为同一个簇,可得到2个主要的PFGE簇,命名为G1(i)-G2(i),i是稻叶型(Inaba)的第一个字母;具体见图3。1979-1989年的菌株属于G1(i) PFGE簇(14/14),2005年的菌株属于G2(i)PFGE簇(6/6);其余年份散发的稻叶型菌株没有优势的PFGE簇;具体见图3。

图252株小川血清型PFGE分子分型结果
Fig.2PFGEpatternsof52V.choleraeOgawaserotypestrains
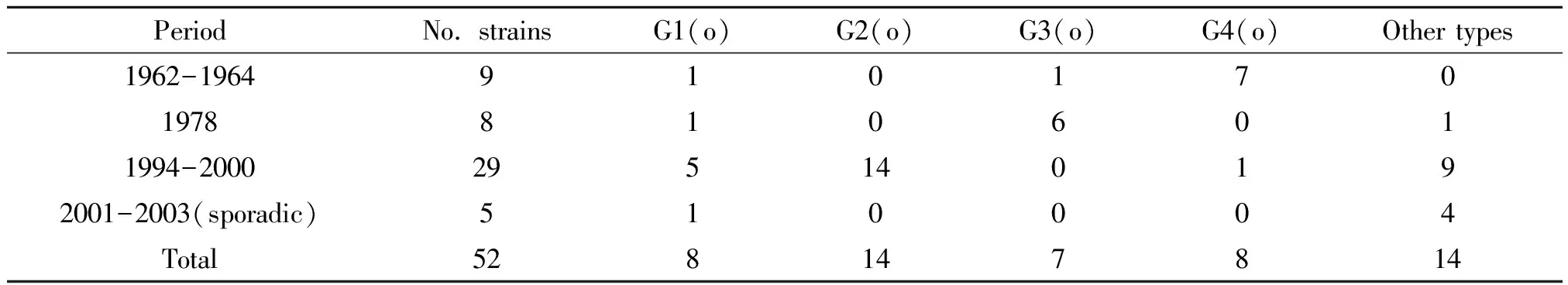
表2 52株小川型霍乱弧菌PFGE簇不同流行时期分布情况
3 讨 论
随着脉冲场凝胶电泳(PFGE)分子分型技术的标准化以及PulseNet监测网络的建立,越来越多的公共实验室逐渐利用该技术平台进行各种细菌性病原体监测。我们对1962-2005代表性的O1群霍乱病人分离株进行PFGE分子分型,结果发现,按照100%的相似度可将77株菌株酶切图谱分为61个PFGE型,没有集中优势的PFGE型别。PFGE分子分型针对的是全细菌的基因组,对于同一次暴发流行的菌株,理论上菌株的基因组应该表现为100%的相似度;但是针对长时间跨年度流行的分离株以及实验室长期保存的菌株(特别是以保种半固体方式保存的霍乱菌株),因为菌株在长时间流行传播和保存过程可能产生基因变异,即使是有遗传相关性的菌株PFGE分型也不一定表现为100%的相似度;但是这种变异一般不会产生大的基因组变异。根据TENOVE原则[1],PFGE基因型别只有1-3条带差异的菌株在遗传上可能有紧密相关性,实验结果按照90%的相似度将大部分菌株酶切图谱划分为5个主要的PFGE簇G1-G5,实际上归于同一个簇的菌株大部分是同一次流行的菌株;散发的菌株没有显示优势的簇,表现为各自不同的PFGE型别,提示散发菌株没有遗传上的相关性。因此对于PFGE分子分型的结果分析要结合收集菌株的流行病学背景资料、研究菌株的时间跨度和菌种的保存方式等选择适当的相似度进行聚类,更能客观、准确地反映菌株之间的相关性。
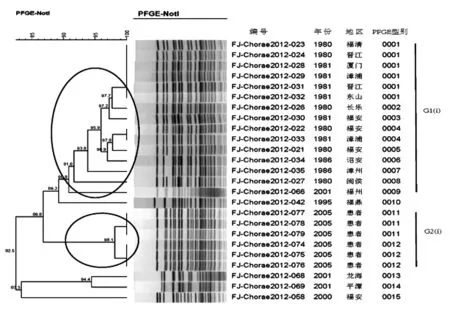
图325株稻叶型PFGE分子分型结果
Fig.3PFGEpatternsof25V.choleraeInabaserotypestrains
从1962-2005年福建省霍乱菌株PFGE簇不同流行时期的分布情况可见,前3次流行的菌株既有上一次流行簇的延续,又有新的优势簇的出现;说明前3次流行的菌株在遗传上有关联性,但是在长时间流行过程中产生基因变异出现新的优势簇。相同的优势簇分布于福建省各个地区,提示福建省各地区间的霍乱流行在传播上有相关性。
福建以小川型为优势血清型的霍乱流行时期有1962-1964、1978和1994-2000年[1];各个流行时期均有各自优势的PFGE簇,分别为G4(o)、G3(o)、G2(o)。小川型为优势血清型的3次流行,均造成较多的病例数(均>1500例),但是从流行持续的时间来看1994-2000年明显超过1962-1964年和1978年,推测G2(o) PFGE簇的小川型菌株在引起霍乱流行时间长度能力上要强于G3(o)和G4(o)簇。另外,1994-2000年小川型菌株比其它流行时期的小川型菌株基因组更具有多样性,可能原因是由于该次流行的时间跨度达10年之久,在长时间的流行过程中菌株产生了基因变异,特别是到了流行后期;而实际上归于其它PFGE型别的9株菌株,有8株是1998-2000年流行后期的菌株。
福建以稻叶为优势血清型的霍乱流行时期有1979-1989和2005年;1979-1989年稻叶型流行了将近10年的时间,总发病数为22292例,2005年稻叶型引发的疫情仅限于当年,发病数310;从疫情的延续时间、发病规模和引发的病例数进行比较,1979-1989年都明显超过2005年;1979-1989年的菌株均归于G1(i) PFGE簇,2005年的菌株均归于G2(i) PFGE簇;可以推测G1(i) PFGE簇的稻叶型菌株具有引起长时间、大规模霍乱流行的能力;G2(i) PFGE簇的菌株在流行能力上明显较弱。
本文将O1群霍乱弧菌PFGE分子分型的结果和流行病学的背景资料相结合,对不同PFGE簇(型)菌株在流行时间长短、引发流行规模的能力等方面,进行初步探索,为评估将来霍乱疫情分离株对流行趋势的可能影响积累实验室研究本底资料。
参考文献:
[1]Cooper KL, Luey CKY, Bird M, et al. Development and validation of a PulseNet standardized pulsed-field gel electrophoresis protocol for subtyping ofVibriocholerae[J]. Foodborne Pathog Dis, 2006, 3(1): 51-58. DOI: 10.1089/fpd.2006.3.51
[2]Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J]. J Clin Microbiol, 1995, 33(9): 2233-2239.
