日本血吸虫重组Bb(pGEX-Sj26GST-Sj32)疫苗免疫BALB/c鼠血清抗体及细胞因子的动态观察
2014-04-09向进平李文桂
向进平,李文桂,张 丽
日本血吸虫病是卫生部规划防治的重点寄生虫病之一,研制疫苗防治该病成为当前研究的热点领域。人们发现血清抗体和细胞因子在疫苗诱导的保护性免疫机制中起重要作用。本文在成功构建重组Bb(pGEX-Sj26GST-Sj32)疫苗的基础上,将其免疫BALB/c小鼠,动态观察血清抗体及细胞因子,为研究该疫苗的作用机制提供材料。
1 材料与方法
1.1实验动物 10~12周龄BALB/c鼠96只,雌性,15~20 g,购自重庆医科大学实验动物中心。
1.2主要试剂及器材 羊抗小鼠IgG、IgG1、IgG2a、IgG2b、IgG3、IgE和IgA均购自美国Southern Biotech公司;IL-10、IL-12试剂盒购自深圳欣博盛生物科技有限公司;其它试剂为国产分析纯;SjAWA和rBb(pGEX-Sj26GST-Sj32)疫苗由本实验室制备及保存;Elx800UV酶标仪购自美国Bio-tek公司。
1.3免疫方案 将96只BALB/c鼠随机分为口服灌胃(per os,PO)组、鼻腔粘膜(intranasal,IN)组两组,每组各48只。PO组给予108CFU/100 μL单次口服灌胃,IN组给予105CFU/10 μL单次鼻腔粘膜接种。至实验结束时无小鼠死亡。
1.4血清收集:两组小鼠分别于免疫后0、2、4、6、8、10、12、14、16、18、20和22周各随机剖杀4只,取眼球血,室温静置6 h,5 000 r/min 7 min离心(离心半径9.5 cm),分离血清,并于-20 ℃冰箱保存备用。
1.5血清IgG及其亚类、IgE和IgA抗体检测 采用常规ELISA法。方阵滴定法确定SjAWA(1 μg/μL)的包被液浓度为2.4 μg/孔,小鼠血清的稀释度为1∶50,酶标抗体的稀释度为1∶5 000。酶标仪测定OD450值。
1.6血清IL-10及IL-12水平检测 采用双抗夹心ELISA法。按照IL-10和IL-12试剂盒的说明书进行操作。测OD450值;制作标准曲线,通过其OD值即可计算出各对应的细胞因子浓度,以pg/ml为单位(IL-10与IL-12检测步骤相同)。
1.7统计学分析 采用SPSS 17.0对实验数据进行分析,每周每组四份标本,多组间比较用单因素方差分析,组间两两比用Dunnett’s T3法,P<0.05有统计学意义。
2 结 果
2.1血清抗体检测 口服免疫组小鼠血清中IgG、IgG1、IgG2a、IgG2b、IgG3、IgE和IgA水平分别在免疫后4~22周、8~22周、4~22周、2~8周、2~14周、8~16周和4~22周升高,并分别在6、8、8、4、6、12和6周达到峰值,此时与0周相比差异均有统计学意义(P<0.05);鼻腔粘膜接种组小鼠血清中IgG、IgG1、IgG2a、IgG2b、IgG3、IgE和IgA水平分别在免疫后4~22周、2~16周、2~20周、2~8周、4~10周、2~18周和2~22周升高,并分别在4、2、6、2、4、8和8周达到峰值,此时与0周相比差异均有统计学意义(P<0.05)。且鼻腔粘膜组各抗体水平均较口服免疫组先达峰值(P<0.05)。(见表1、图1及图2)
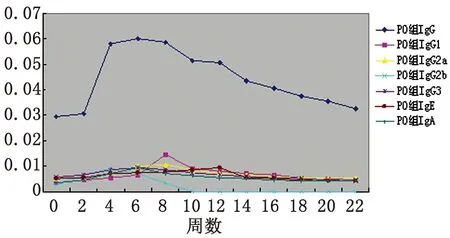
图1rBb(pGEX-Sj26GST-Sj32)疫苗口服免疫小鼠血清抗体水平的动态变化
Fig.1DynamicchangesonthelevelsofantibodiesinseraofBALB/cmiceorallyimmunizedwithrBb(pGEX-Sj26GST-Sj32)vaccine
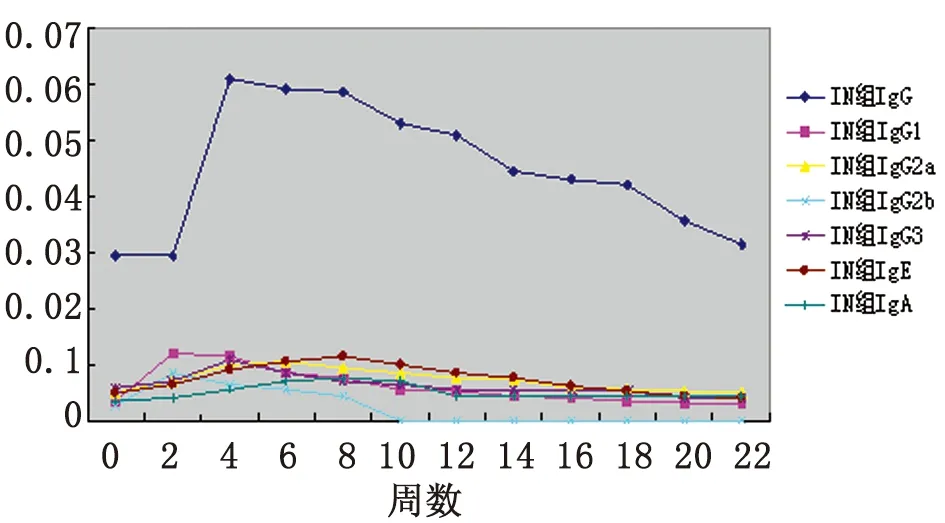
图2rBb(pGEX-Sj26GST-Sj32)疫苗鼻腔粘膜免疫小鼠血清抗体水平的动态变化
Fig.2DynamicchangesonthelevelsofantibodiesinseraofBALB/cmiceintranasallyimmunizedwithrBb(pGEX-Sj26GST-Sj32)vaccine
2.2血清IL-10及 IL-12水平检测 与0周相比,口服免疫组血清IL-10水平于2~22周显著升高,并于12周达到峰值(P<0.05);鼻腔粘膜免疫组亦于2~22周显著升高,且于6周达峰值(P<0.05)。口服组及鼻腔粘膜组IL-12水平均于2~14周升高,且均于6周达到最大值(P<0.05)(表2,图3)。
3 讨 论
抗血吸虫感染过程中,IgG是抗感染的主要抗体,它具有调理作用,可增强吞噬细胞的吞噬作用;gG2a、IgG2b及IgE与保护力呈正相关,尤其是血吸虫抗原特异性IgE抗体依赖的、嗜酸性粒细胞等细胞介导的细胞毒效应;IgG1及IgG2a也参与细胞毒效应,从而对靶细胞产生非特异性杀伤作用[1]。抗体依赖细胞介导的细胞毒作用(ADCC)杀伤血吸虫童虫被认为是抗血吸虫感染中重要的免疫效应机制之一。Widhe等[2]发现IgG3可能通过IFN-γ激活效应细胞发挥杀伤血吸虫作用。
表1rBb(pGEX-Sj26GST-Sj32)疫苗免疫小鼠后血清抗体的动态观察
Tab.1DynamicobservationonthelevelsofantibodiesinseraofBALB/cmiceimmunizedwithrBb(pGEX-Sj26GST-Sj32)vaccine
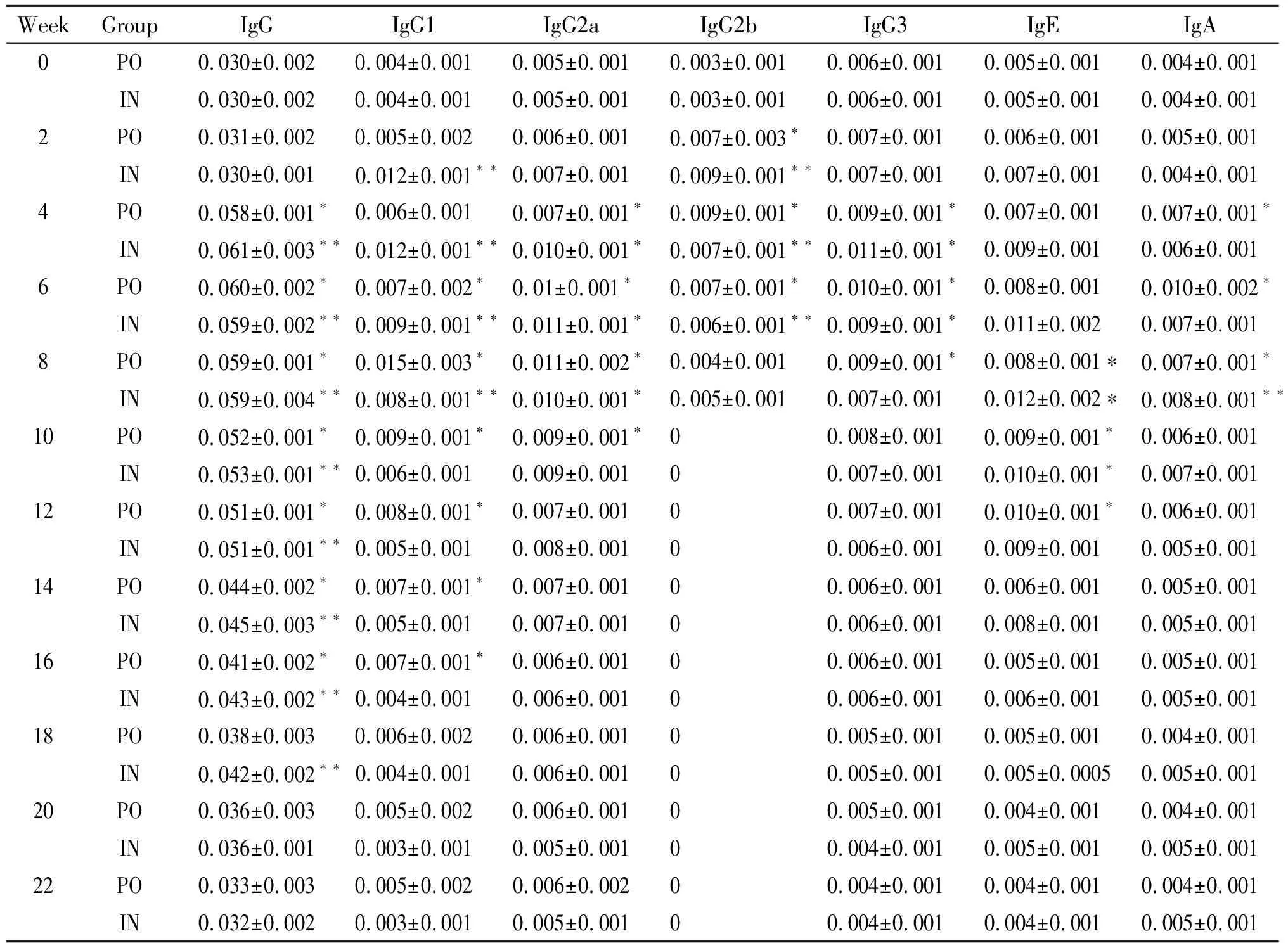
WeekGroupIgGIgG1IgG2aIgG2bIgG3IgEIgA0PO0.030±0.0020.004±0.0010.005±0.0010.003±0.0010.006±0.0010.005±0.0010.004±0.001IN0.030±0.0020.004±0.0010.005±0.0010.003±0.0010.006±0.0010.005±0.0010.004±0.0012PO0.031±0.0020.005±0.0020.006±0.0010.007±0.003∗0.007±0.0010.006±0.0010.005±0.001IN0.030±0.0010.012±0.001∗∗0.007±0.0010.009±0.001∗∗0.007±0.0010.007±0.0010.004±0.0014PO0.058±0.001∗0.006±0.0010.007±0.001∗0.009±0.001∗0.009±0.001∗0.007±0.0010.007±0.001∗IN0.061±0.003∗∗0.012±0.001∗∗0.010±0.001∗0.007±0.001∗∗0.011±0.001∗0.009±0.0010.006±0.0016PO0.060±0.002∗0.007±0.002∗0.01±0.001∗0.007±0.001∗0.010±0.001∗0.008±0.0010.010±0.002∗IN0.059±0.002∗∗0.009±0.001∗∗0.011±0.001∗0.006±0.001∗∗0.009±0.001∗0.011±0.0020.007±0.0018PO0.059±0.001∗0.015±0.003∗0.011±0.002∗0.004±0.0010.009±0.001∗0.008±0.001∗0.007±0.001∗IN0.059±0.004∗∗0.008±0.001∗∗0.010±0.001∗0.005±0.0010.007±0.0010.012±0.002∗0.008±0.001∗∗10PO0.052±0.001∗0.009±0.001∗0.009±0.001∗00.008±0.0010.009±0.001∗0.006±0.001IN0.053±0.001∗∗0.006±0.0010.009±0.00100.007±0.0010.010±0.001∗0.007±0.00112PO0.051±0.001∗0.008±0.001∗0.007±0.00100.007±0.0010.010±0.001∗0.006±0.001IN0.051±0.001∗∗0.005±0.0010.008±0.00100.006±0.0010.009±0.0010.005±0.00114PO0.044±0.002∗0.007±0.001∗0.007±0.00100.006±0.0010.006±0.0010.005±0.001IN0.045±0.003∗∗0.005±0.0010.007±0.00100.006±0.0010.008±0.0010.005±0.00116PO0.041±0.002∗0.007±0.001∗0.006±0.00100.006±0.0010.005±0.0010.005±0.001IN0.043±0.002∗∗0.004±0.0010.006±0.00100.006±0.0010.006±0.0010.005±0.00118PO0.038±0.0030.006±0.0020.006±0.00100.005±0.0010.005±0.0010.004±0.001IN0.042±0.002∗∗0.004±0.0010.006±0.00100.005±0.0010.005±0.00050.005±0.00120PO0.036±0.0030.005±0.0020.006±0.00100.005±0.0010.004±0.0010.004±0.001IN0.036±0.0010.003±0.0010.005±0.00100.004±0.0010.005±0.0010.005±0.00122PO0.033±0.0030.005±0.0020.006±0.00200.004±0.0010.004±0.0010.004±0.001IN0.032±0.0020.003±0.0010.005±0.00100.004±0.0010.004±0.0010.005±0.001
Note: Compared with 0 week,*P<0.05, **P<0.01.
表2rBb(pGEX-Sj26GST-Sj32)疫苗免疫小鼠后血清IL-10及IL-12水平的动态观察
Tab.2DynamicobservationonthelevelsofIL-10andIL-12inseraofBALB/cmiceimmunizedwithrBb(pGEX-Sj26GST-Sj32)vaccine
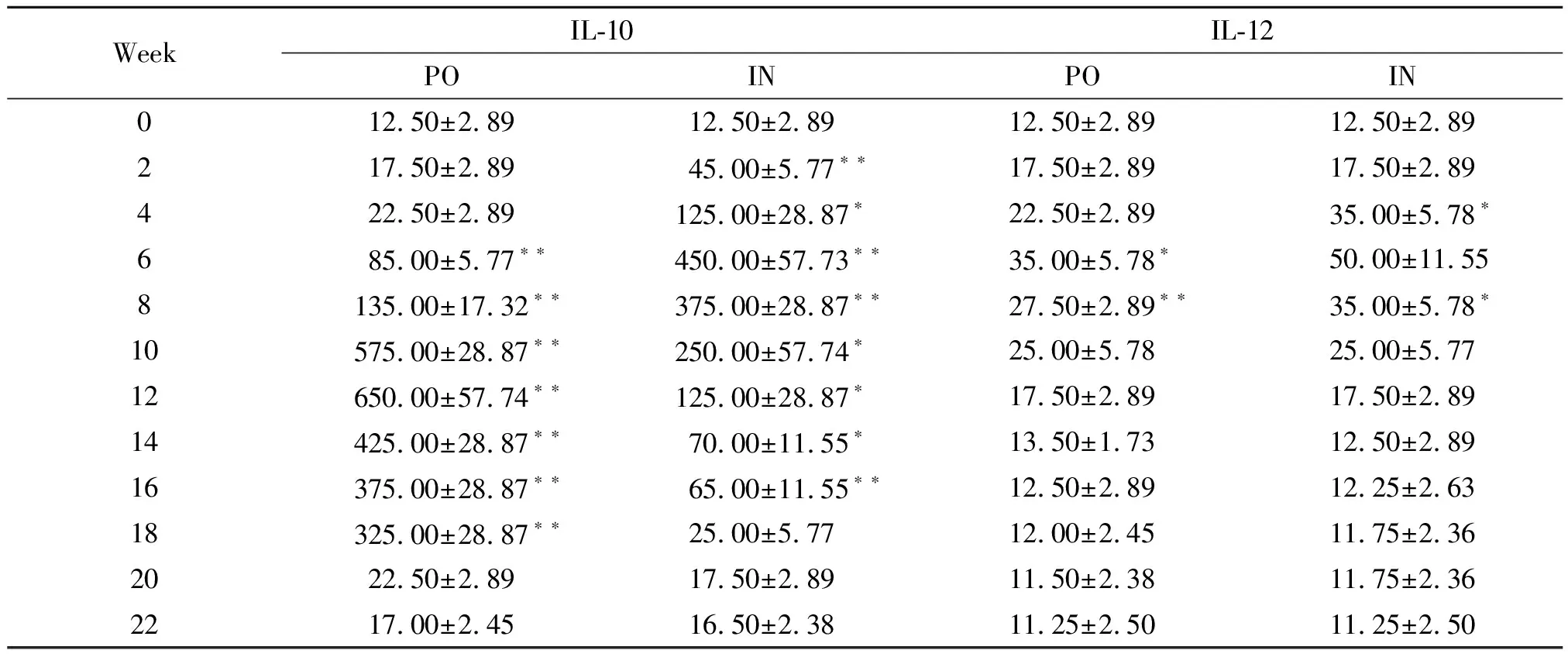
WeekIL-10IL-12PO IN PO IN012.50±2.8912.50±2.8912.50±2.8912.50±2.89217.50±2.8945.00±5.77∗∗17.50±2.8917.50±2.89422.50±2.89125.00±28.87∗22.50±2.8935.00±5.78∗685.00±5.77∗∗450.00±57.73∗∗35.00±5.78∗50.00±11.558135.00±17.32∗∗375.00±28.87∗∗27.50±2.89∗∗35.00±5.78∗10575.00±28.87∗∗250.00±57.74∗25.00±5.7825.00±5.7712650.00±57.74∗∗125.00±28.87∗17.50±2.8917.50±2.8914425.00±28.87∗∗70.00±11.55∗13.50±1.7312.50±2.8916375.00±28.87∗∗65.00±11.55∗∗12.50±2.8912.25±2.6318325.00±28.87∗∗25.00±5.7712.00±2.4511.75±2.362022.50±2.8917.50±2.8911.50±2.3811.75±2.362217.00±2.4516.50±2.3811.25±2.5011.25±2.50
Note: Compared with 0 week,*P<0.05, **P<0.01
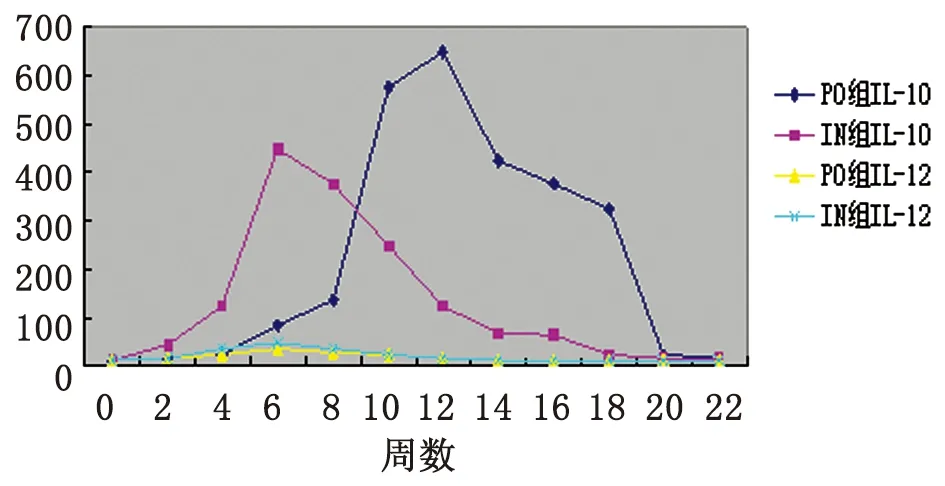
图3rBb(pGEX-Sj26GST-Sj32)疫苗免疫小鼠后血清IL-10及IL-12水平的动态变化
Fig.3DynamicchangesonthelevelsofIL-10andIL-12inseraofBALB/cmiceimmunizedwithrBb(pGEX-Sj26GST-Sj32)vaccine
周霞等[3]将BALB/c小鼠经紫外减毒尾蚴免疫后,血清中针对成虫抗原(SWAP)的IgG水平感染组小鼠上升较免疫组小鼠快,并于第5周达峰值。而免疫组小鼠血清IgG水平于第6周达峰值,且后者的峰值略高于前者。提示BALB/c鼠经免疫可使机体产生较强针对SWAP的抗体。龚唯等[4]将rSjc26GST加活化剂免疫BALB/c鼠后经皮肤感染尾蚴,发现用AWA检测免疫小鼠血清IgG及IgG1水平均显著高于对照组,能明显增强免疫小鼠的体液免疫应答,使肝内血吸虫卵肉芽肿病变显著减轻,成熟虫卵比例明显下降。蒋守富等[5]将日本血吸虫攻击感染东方田鼠1~4周后,产生针对SAWA的IgG3抗体,抗体水平在攻击感染后第3周增幅较大,第4周达高峰,较感染前增加49.6%;感染昆明种小鼠后,抗SAWA的IgG3抗体水平在攻击感染后第3周增加36.7%;并发现该抗体主要针对Sj童虫和成虫。Wynn等[6]用曼氏血吸虫(Sm)减毒活疫苗加IL-12多次免疫小鼠,攻击感染后发现IgG2a 、IgG2b和 IgG1同时升高。李永等[7]采用非糖蛋白31/32 kDa抗原检测慢性血吸虫病人血清中IgG1、IgG3、IgG4各亚类均明显增高,而IgG1高出正常对照组11.9倍。该结果与Jassim的报道基本一致[8]。Dupré等[9]用曼氏血吸虫28 kDa谷胱甘肽-S-转移酶的cDNA构建的DNA疫苗pNlp28于皮内注射免疫大鼠后,对血清抗体IgG及其亚类进行了观察。结果表明,血清抗体可持续至第126 d(未继续观察),抗体亚类检测表明主要是IgG2a和IgG2b。Etard等[10]认为血吸虫感染免疫力的表达可能是“效应免疫应答” (主要是抗血吸虫成虫表面抗原,抗童虫表面抗原的IgA、IgG1、IgG2a、IgG3和IgE)与“阻断免疫应答”(主要是抗虫卵多糖抗原的IgM、IgG2c和IgG4 )之间动态平衡的结果。
本研究发现,口服免疫组小鼠血清中IgG、IgG1、IgG2a、IgG2b和IgG3水平分别在免疫后4~22周、8~22周、4~22周、2~8周和2~14周升高,并分别在6、8、8、4和6周达到峰值(P<0.05);鼻腔粘膜接种组小鼠血清中IgG、IgG1、IgG2a、IgG2b和IgG3水平分别在免疫后4~22周、2~16周、2~20周、2~8周和4~10周升高,并分别在4、2、6、2和4周达到峰值(P<0.05)。且鼻腔粘膜组各抗体水平均较口服免疫组先达峰值(P<0.05)。提示重组Bb(pGEX-Sj26GST-Sj32)疫苗在早期就能产生有效的免疫应答,从而获得较好的保护性免疫力。IgG水平显著升高,说明其在抗日本血吸虫感染过程中发挥抗感染作用,而IgG亚类则辅助其发挥免疫功能。且鼻腔粘膜免疫较口服免疫更早出现特异性抗体,提示粘膜接种途径可有效诱导全身性免疫反应,因而免疫效率更高。
流行病学调查资料显示,血吸虫病流行区居民存在年龄依赖的与血吸虫特异性IgE抗体相关的对再感染的抗力,提示血吸虫特异性IgE抗体在血吸虫病抗感染免疫中起到重要作用[11-12]。研究表明,日本血吸虫血清IgE抗体水平与血吸虫再感染和感染度显著负相关。有报道指出,血吸虫26GST免疫BALB/c小鼠能引起特异性IgE抗体的产生[13]。同样,IgA在抗血吸虫感染中也起着重要作用。Hernandez等[14]发现蠕虫成虫抗原IgA为保护性抗体,并可能在抗成虫生殖力和虫卵活性方面发挥重要作用。本课题组曾用日本血吸虫重组Bb(pGEX-Sj4-3-3)疫苗以口服灌胃及鼻腔粘膜接种方式免疫BALB/c小鼠,发现两种途径均可诱导较高水平的IgE和IgA抗体,从而提高宿主抗血吸虫感染的保护性免疫反应[15]。
本实验中口服组及鼻腔粘膜组在疫苗免疫后IgE及IgA抗体水平均升高,口服组分别于8周~16周和4周~22周升高,并分别于12周和6周达到峰值(差异有统计学意义,P<0.05);鼻腔粘膜组分别于2周~18周和2周~22周升高,并均于8周达到峰值(P<0.05)。提示该重组Bb疫苗能引起抗日本血吸虫感染免疫力,并在对抗成虫生殖力、抗虫卵活性及防止再感染方面起到一定作用。相比于口服组,鼻腔粘膜组能更早产生相应特异性抗体,减少虫体及虫卵对机体的损害。
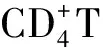
对血吸虫辐照致弱尾蚴诱导的早期免疫应答的研究发现,IL-10是一种重要的负向调控因子,在IL-12介导的早期获得性免疫应答调节中起着重要作用,包括减轻过度的皮肤炎症和有效阻止高度极化Th1型应答的发生[19]。Hoffmann等认为 IL-10虽然被视为Th2效应因子,但研究发现IL-10对Th1和Th2反应都有重要的调控作用,影响疾病的发展和转归[20]。另外,人们对IL-12的生物学活性、功能、基因结构以及与疫苗相关性研究发现,IL-12在寄生虫感染中具有保护性免疫作用。IL-12主要由单核-巨噬细胞、B细胞及肥大细胞产生, IL-12对T细胞和NK细胞具有显著的生物学作用,能促进NK细胞活化、增殖,增强NK细胞和细胞毒T细胞(CTL)的杀伤活性,诱导活化的T细胞和NK细胞分泌IFN-γ,从而间接地激活巨噬细胞,协同IL-2诱导NK细胞活性的产生[21];同时IL-12使巨噬细胞增多,增加NO杀童虫能力[22],从而增强宿主抗日本血吸虫感染的保护性免疫力。曼氏血吸虫感染早期主要是Thl为主的细胞免疫,IL-2、IL-12和IFN-γ水平升高,临床表现为急性期反应;产卵后宿主体内的免疫反应由Th1型转变为Th2型为主的体液免疫,以 IL-4、IL-5及IL-10等细胞因子升高为特点[23],在肉芽肿形成和纤维化过程中起着重要作用[24]。
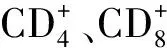
参考文献:
[1]Capron M, Capron A. Immunoglobulin E and effector cells in schistosomiasis[J]. Science, 1994, 264(5167): 1876-1877.
[2]Widhe M, Ekerfelt C, Forsberg P, et al. IgG subclasses in Lyme borreliosis: a study of specific IgG subclass distribution in an interferon-gamma-predominated disease[J]. Scand J Immunol, 1998, 47(6): 575-581.
[3]Zhou X, Zhuge HX, Gong W, et al. Dynamic changes of IgG levels and passive transfer research with sera from BALB/c mice vaccinated with attenuated cercariae ofSchistosomajaponicum[J]. Chin J Zoonoses, 2008, 24(5): 483-484. (in Chinese)
周霞,诸葛洪祥,龚唯,等.减毒日本血吸虫尾蚴免疫BALB/c小鼠血清IgG水平动态及其被动转移保护力研究[J].中国人兽共患病学报,2008,24(5):483-484.
[4]Gong W, Luo W, Liu SX, et al. Effect of rSjc26GST on anti-Schistosomajaponicumhepatic egg granuloma reinforced by activator HYP and its mechanism[J]. Suzhou Univ J Med Sci, 2005, 25(1): 1-3. (in Chinese)
龚唯,骆伟,刘述先,等.活化剂 HYP协同rSjc26GST的抗血吸虫性肉芽肿的效果及其机制的研究[J].苏州大学学报,2005,25(1):1-3(37).
[5]Jiang SF, Wei MX, Lin JJ, et al. Effect of IgG3 antibody purified from sera ofMicrotusfortisagainstSchistosomajaponicum[J]. Chin J Parasitol Parasit Dis, 2008, 26(1): 34-36. (in Chinese)
蒋守富,魏梅雄,林矫矫,等.东方田鼠IgG3抗体抗血吸虫病作用研究[J].中国寄生虫学与寄生虫病杂志,2008,26(1):34-36.
[6]Wynn TA, Reynolds A, James S, et al. IL-12 enhances vaccine-induced immunity to schistosomes by augmenting both humoral and cell-mediated immune responses against the parasite[J]. J Immunol, 1996, 157(9): 4068-4078.
[7]Li Y, Zeng XF, Yi XY, et al. Detection of different class (subclass) antibodies in sera of patients with schistosomiasis japonica for diagnosis and efficiency evaluation[J]. Bull Hunan Med Univ, 1997, 22(5): 381-383. (in Chinese)
李永,曾宪芳,易新元,等.应用日本血吸虫病患者血清特异性抗体亚类考核疗效[J].湖南医科大学学报,1997,22(5):381-383.
[8]Jassim A, Hassen K, Carty D. Antibody subclass in human schistosomiasis[J]. Parasite Immunol, 1987, 9(6): 627-650.
[9]Dupré L, Poulain-Godefroy O, Ban E, et al. Intradermal immunization of rats with plasmid DNA encodingSchistosomamansoni28 kDa glutathione S-transferase[J]. Parasite Immunol, 1997, 19(11): 505-513.
[10]Etard JF, Audibert M, Dabo A, et al. Age-acquired resistance and predisposition to reinfection withSchistosomahaematobiumafter treament with praziquantel in Mali[J]. Am J Trop Med Hyg, 1995, 52(6): 549-558.
[11]Dunne DW, Webster M, Smith P, et al. The isolation of a 22 kDa band after SDS-PAGE ofSchistosomamansoniadult worms and its use to demonstrate that IgE responses against the antigen(s) it contains are associated with human resistance to reinfection[J]. Parasite Immunol, 1997, 19(2): 79-89.
[12]Caldas IR, Correa-Oliveira R, Colosimo E, et al. Susceptibility and resistance toSchistosomamansonireinfection: parallel cellular and isotypic immunologic assessment[J]. Am J Trop Med Hyg, 2000, 62(1): 57-64.
[13]Hsu CH, Chua KY, Huang SK, et al. Glutathione-S-transferase induces murine dermatitis that resembles human atopic dermatitis[J]. Clin Exp Allergy, 1996, 26(11): 1329-1337.
[14]Hernandez MG, Hafalla JC, Acosta LP, et al. Paramyosin is a major target of the human IgA response againstSchistosomajaponicum[J]. Parasite Immunol, 1999, 21(12): 641-647.
[15]Zhang N, Li WG. Dynamic observation on levels of antibodies in sera of BALB/c mice immunized with recombinantBifidobacteriumbifidumpGEX-Sj14-3-3 vaccine ofSchistosomajaponicum[J]. Chin J Endemiol, 2012, 31(3): 301-304. (in Chinese)
张宁,李文桂.日本血吸虫重组两歧双歧杆菌pGEX-Sj14-3-3疫苗免疫BALB/c小鼠的血清抗体动态观察[J].中国地方病学杂志,2012,31(3):301-304.
[16]Jankovic D, Wynn TA, Kullberg MC, et al. Optimal vaccination againstSchistosomamansonirequires the induction of both B cell- and IFN-gamma-dependent effector mechanisms[J]. J Immunol, 1999, 162(1): 345-351.
[17]Oswald IP, Caspar P, Jankovic D, et al. IL-12 inhibits Th2 cytokine responses induced by eggs ofSchistosomamansoni[J]. J Immunol, 1994, 153(4): 1707-1713.
[18]Xia CM, Luo W, Gong W, et al. Effects of varied immunogen on Thl/Th2 immune deviation of mice infected withSchistosomajaponicum[J]. Chin J Zoonoses, 2002, 18(1): 55-58. (in Chinese)
夏超明,骆伟,龚唯,等.日本血吸虫不同免疫原对小鼠Th1/Th2免疫偏移的影响[J].中国人兽共患病杂志,2002,18(1):55-58.
[19]Qadir K, Metwali A, Blum AM, et al. TGF-beta and IL-10 regulation of IFN-gamma produced in Th2-type schistosome granulomas requires IL-12[J]. Am J Physiol Gastrointest Liver Physiol, 2001, 281(4): G940-946.
[20]Hoffmann KF, Cheever AW, Wynn TA. IL-10 and the dangers of immune polarization: excessive type 1 and type 2 cytokine responses induce distinct forms of lethal immunopathology in murine schistosomasis[J]. J Immunol, 2000, 164(12): 6406-6416.
[21]Scott P. IL-12: initiation cytokine for cell-mediated immunity[J]. Science, 1993, 260(5107): 496-497.
[22]Wynn TA, Oswald IP, Eltoum IA, et al. Elevated expression of Th1 cytokines and nitric oxide synthase in the lungs of vaccinated mice after challenge infection withSchistosomamansoni[J]. J Immunol, 1994, 153(11): 5200-5209.
[23]Pearce EJ, Kane CM, Sun J, et al. Th2 response polarization during infection with the helminth parasiteSchistosomamansoni[J]. Immunol Rev, 2004, 201: 117-126.
[24]Li XY, Shen JL. TH1/TH2 immune response and schistosomal fibrosis[J]. Chin J Zoonoses, 2009, 25(2): 179-182. (in Chinese)
李小月,沈继龙.TH1/TH2免疫应答与血吸虫性纤维化[J].中国人兽共患病学报,2009,25(2):179-182.
[25]Li Y, Gong W, Zhang HQ, et al. Reorganization and identification of fractional antigens from adult worms and eggs by sera of rabbits infected withSchistosomajaponicumin different stages of disease[J]. Chin J Zoonoses, 2008, 24(6): 551-554. (in Chinese)
李颖,龚唯,张惠琴,等.日本血吸虫不同病期血清抗体对虫源性及卵源性组分抗原的识别及鉴定[J].中国人兽共患病学报,2008,24(6):551-554.
