弓形虫蛋白激酶C受体1蛋白的表达与抗原性分析
2014-04-09侯俊然李卓雅詹希美
侯俊然,何 霭,李卓雅,詹希美
刚地弓形虫是一种机会致病性原虫,人群感染极为普遍,特别对免疫力低下人群,危害严重。但是,弓形虫病的防治及疫苗研究进程较慢。弓形虫入侵机制的研究多集中于肌动蛋白、棒状体及微线体等方面,研究证实这些蛋白对细胞在弓形虫入侵方面都有一定的作用,对这些蛋白的调控方面还了解较少。Robert-GangneuxF[1]用实验证实了蛋白激酶C(Protein Kinase C,PKC)的激活能够下调巨噬细胞的吞噬清除能力,增加弓形虫对细胞的入侵易感性,可增加弓形虫的感染性,在弓形虫的增殖、分化、入侵方面都有重要作用。Peng[2]研究证明弓形虫速殖子可以通过PKC通路下调巨噬细胞的功能而增加自身的感染能力, 可以通过减弱PKC的活性降低弓形虫对细胞的侵袭性。 以上研究证实PKC 传导通路对弓形虫的入侵和致病方面具有重要的调节作用。蛋白激酶C受体1(Receptor for Activated C-Kinase 1,RACK1)是具有7个WD40重复结构的支架蛋白,在原核和真核生物高度保守,参与多种信号转导的调节,作用非常重要[3]。其中在PKC信号转导通路中,能够与PKC结合、绑定PKC到细胞骨架上并使它与底物结合,调节PKC的活性[4]。目前,对于RACK1的研究主要集中在人体的恶性肿瘤方面,尤其在肺癌、肝癌、黑色素瘤等恶性肿瘤中可以观察到RACK1蛋白的表达上调,参与癌细胞的转移等恶性生物学行为[5-6],在原虫方面 Gonzale[7]研究发现利什曼原虫表达的 RACK1 蛋白具有很强的抗原性。鉴于RACK1蛋白的重要作用,对RACK1蛋白进行克隆表达,分析其抗原性,为弓形虫的分子诊断提供候选分子,同时表达的蛋白为进一步研究RACK1蛋白的分子作用奠定基础。
1 材料与方法
1.1材料
1.1.1虫株、菌株、质粒 刚地弓形虫RH株、大肠埃希菌BL21(DE3)、PET-30a(+)均由中山医学院寄生虫学教研室保存。
1.1.2主要试剂 Ttizol Reagent购自Invitrogen公司;SacI、NcoI、PyrobenstTMDNA Polymerase均购自TaKaRa公司;His 标签蛋白纯化树脂(Ni-IDA His Bind Resin) 购自德国 Novagen公司。Mouse Anti His polyantiboby 购自美国Amersham Bioscience公司,Goat Anti mouse IgG-HRP、Goat Anti human IgG-HRP购自美国Boster Biotechnology公司。兔抗弓形虫抗体、人抗弓形虫抗体由中山医学院寄生虫学教研室保存。
1.2方法
1.2.1RACK1基因原核表达载体的构建及鉴定 根据GenBank( AY547291.1)上的刚地弓形虫CDNA序列,设计引物,P1:5′ATCCAT GGAATGTCGGGTGAATCTC 3′ 下游引物P2:5′TAGTCGACTTTACGCGGTCACTTGCT 3′,上游引物引入NcoI酶切位点(下划线部分),下游引物引入SacI酶切位点(下划线部分)。PCR扩增:94℃预变性5 min,94℃45 s、57℃45 s、72℃90 s 28个循环,再72℃延伸10 min,将PCR产物进行1.0%琼脂糖凝胶电泳,观察结果。将RACK1基因扩增产物和质粒pET-30a(+)经NcoI和SacI双酶切后回收,连接,构建pET-30a(+)-RACK1重组质粒,转化大肠杆菌BL21(DE3)感受态,平板培养至长出单菌落。挑取菌种接种于5 mL LB 培养液(含卡那霉素)37 ℃振摇过夜培养,分别取2 mL 菌液抽提质粒双酶切,双酶切阳性的菌液和质粒送测序鉴定。
1.2.2RACK1蛋白的表达与纯化 取含有pET-30a(+)-RACK1重组质粒的菌液,以1∶100比例重新接种入LB 培养液(含卡那霉素)37 ℃,225 r/min振摇培养至OD600=0.6, 加入IPT G至终浓度为0.8 mmol/ L。30 ℃,225 r/min诱导表达8 h后离心收集沉淀, 加入1×SDS凝胶上样缓冲液100 μL,沸水浴5 min,离心,取裂解上清作SDS-PAGE电泳。优化表达条件,以优化条件为准,进行大量表达。收集大量表达的菌液500 mL,4 ℃,8 000 g离心20 min,收集包涵体沉淀;按每100 mL培养基所得菌体加入40 mL1×结合缓冲液(20 mmol/LTris-HCl pH=7.5、0.5 mol/L Nacl、5 mmol/L 咪唑)比例重悬菌体,此步骤不加变性剂。功率160 W,持续1 s,停2 s,共12 min进行超生裂解,5 000g 离心15 min,弃上清。按每100 mL培养基加入5 mL缓冲液比例,加入含6 mol/L尿素的1×结合缓冲液重悬沉淀。 冰浴1 h,16 000g离心 30 min,取上清,经0.45 μm滤器过滤后,用于亲和层析柱进行目的蛋白的纯化。收集洗脱液,备用。
1.2.3兔免疫血清的制备 取弓形虫速殖子裂解液与弗氏完全佐剂1∶1的混合液,对健康新西兰大白兔腹部进行多点免疫。4周后,用速殖子裂解液与弗式不完全佐剂1∶1的混合液加强免疫,2周后再次加强。末次加强免疫的10 d后从耳缘静脉抽血,用连续稀释ELISA法检测抗体滴度,抗体滴度达到1∶100以上时,心脏取血进行免疫血清制备。
1.2.4RACK1蛋白的Western blotting检测 将纯化后的蛋白12 %SDS-PAGE 电泳完毕后采用100 V 电转移 1 h,将蛋白条带转移至NC膜上。分别以兔免疫血清为一抗,1∶400 稀释的山羊抗兔 IgG-HRP 为二抗;人抗弓形虫血清为一抗、 1∶400稀释的山羊抗人 IgG-HRP 为二抗作用后, DAB 显色至出现目的条带, TBS 缓冲液清洗终止显色反应。
2 结 果
2.1重组质粒pET-30a(+)-RACK1的鉴定 重组质粒pET-30a(+)-RACK1双酶切及RACK1基因PCR用1.0%琼脂糖凝胶电泳,可见1 000 bp左右的条带,与966 bp的理论值相符(图1)。
2.2RACK1蛋白的表达与纯化 重组质粒pET-30a(+)-RACK1在30 ℃、0.8 mmol/ L IPTG条件下大量诱导表达。表达产物以包涵体的形式存在,超生破碎后,凝胶层析纯化,12%的SDS-PAGE分析可见35 kD附近清晰条带,无杂蛋白(图2)。

图1pET-30a(+)-RACK1重组质粒的PCR及双酶切鉴定
Fig.1IdentificationofthepET-30a(+)-RACK1byPCRamplificationanddigestionwithrestrictionenzymes
M: DNA marker; 1: Product of recombinant by digestion withNcoI andSacI; 2: tPCR product of RACK1 gene.
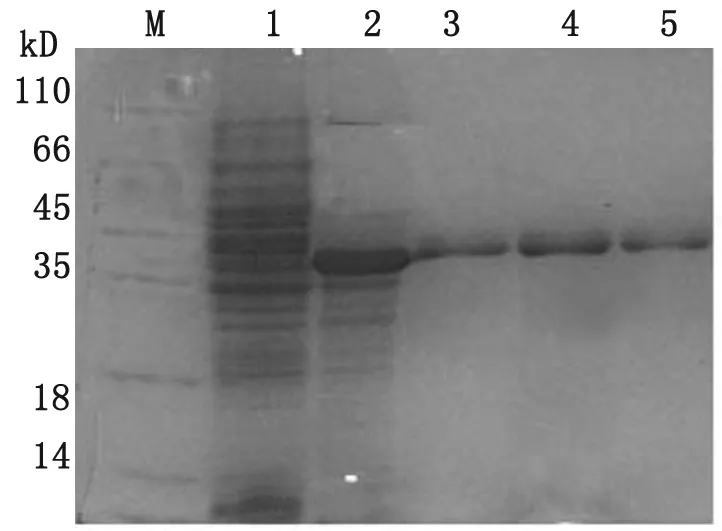
图2RACK1蛋白的表达及纯化
Fig.2ExpressionandpurificationofRACK1protein
M: Protein marker; 1: pET-30a(+)/BL21 with IPTG(0.8 mmol/L) induced for 4 h; 2: pET-30a(+)-RACK1 with IPTG (0.8 mmol/L) induced for 2 h; 3-5: Purification of RACK1.
2.3抗原性分析 利用Western-blotting方法,兔免疫血清及人免疫血清均可识别分子量约为36 kDa的目的蛋白(图3)。
3 讨 论
弓形虫通过速殖子的入侵与缓殖子的休眠状态等不同生命阶段达到与宿主共生存,其中需要信号转导通路的介导。研究表明[8]RACK1蛋白表达的上调能够诱导布什锥虫的凋亡耐受,延长布什锥虫的生存时间。RACK1蛋白对弓形虫的入侵及免疫逃避等方面应该具有重要作用。
本研究成功构建pET-30a(+)-RACK1/BL21表达菌株,质粒在BL21大肠杆菌中的表达温度在24 ℃~30 ℃,在温度、IPTG浓度等表达条件进行优化,确定pET-30a(+)-RACK1/BL21表达最佳条件为30 ℃、IPTG 0.8 mmol/L,为后续蛋白大量表达利用奠定基础。RACK1大量表达纯化后,与兔免疫血清、人抗弓形虫血清进行Western-blotting分析,发现RACK1具有抗原性。这与Gonzale 等[8]研究发现利什曼原虫表达的 RACK1 蛋白具有很强的抗原性相一致。但是,本研究同时做了人抗肝吸虫阳性血清、人抗裂头蚴阳性血清、兔抗日本血吸虫阳性血清、小鼠抗旋毛虫阳性血清与弓形虫RACK1的免疫印迹反应,发现均有免疫条带显示,交叉反应现象严重,可能由于RACK1蛋白是保守性蛋白的原因。所以,RACK1蛋白虽然具有抗原性,但是作为弓形虫的候选抗原诊断分子不甚合适。因此本研究所得到的弓形虫RACK1蛋白,将会对其与PKC蛋白的作用及其与弓形虫入侵有关的细胞器方面的调节进一步研究,继续探讨RACK1蛋白在弓形虫入侵及致病方面具有的功能。

图3RACK1蛋白纯化产物的抗原性分析
Fig.3AnalysisoftheproteinRACK1inantigenicitybywestern-blotting
M: Protein marker; 1: Identified by mouse anti-HIS-tag serum; 2: Identified trophozoite protein by rabbit anti-T.gondiiserum; 3: Identified by rabbit anti-T.gondiiserum; 4: Identified by human anti-T.gondiiserum.
参考文献:
[1]Robert-Gangneux F, Creuzet C, Dupouy-Camet J, et al. Involvement of the mitogen-activated protein (MAP) kinase signalling pathway in host cell invasion byToxoplasmagondii[J]. Parasite, 2000, 7(2): 95-101.
[2]Peng BW, Zheng DL, Jiang XM, et al. Intra-cellular signal pathway and synthesis of prostaglandin E2 during invasion of macrophage byToxoplasmagondii[J]. Chin J Parasitol Parasit Dis, 2004, 22(1): 42-45.
[3]Adams DR, Ron D, Kiely PA. RACK1, A multifaceted scaffolding protein: Structure and function[J]. Cell Commun Signal, 2011, 10(6): 9-22. DOI: 10.1186/1478-811X-9-22
[4]Kröger C, Loschke F, Schwarz N, et al. Keratins control intercellular adhesion involving PKC-α-mediated desmoplakin phosphorylation[J]. J Cell Biol, 2013, 201(5): 681-692. DOI: 10.1083/jcb.201208162
[5]Wu J, Meng J, Du Y, et al. RACK1 promotes the proliferation, migration and invasion capacity of mouse hepatocellular carcinoma cell lineinvitroprobably by PI3K/Rac1 signaling pathway[J]. Biomed Pharmacother, 2013, 67(4): 313-319. DOI: 10.1016/j.biopha. 013.01.011
[6]Sutton P, Borgia JA, Bonomi P, et al. Lyn, a Src family kinase, regulates activation of epidermal growth factor receptors in lung adenocarcinoma cells[J]. Mol Cancer, 2013, 12(1): 76. DOI: 10.1186/1476-4598-12-76
[7] Gonzalez-Aseguinolaz G, Taladriz S, Marquet A, et al. Molecular replication protein of the p36/LACK protective antigen fromLeishmaniainfantum[J]. Eur J Biochem, 1999, 259(3): 909-916.
[8]Welburn SC, Murphy NB. Prohibitin and RACK homologues are up-regulated in trypanosomes induced to undergo apoptosis and in naturally occurring terminally differentiated forms[J]. Cell Death Diff, 1998, 5(7): 615-622.
