人参皂苷对胃癌术后化疗患者血清VEGF的影响
2014-04-08谢晓东朱永康
谢晓东,朱永康
胃癌是常见的消化道恶性肿瘤,约占消化道肿瘤的62%,是世界范围内致死率居第二位的恶性肿瘤。在我国,胃癌发病率和死亡率均很高,2012年新发胃癌患者占全球胃癌二分之一多。由于胃癌早期症状不明显,且对胃癌开展早期筛查的国家很少,大部分患者明确诊断时已为晚期或有远处转移,手术多无法实现根治性切除,手术后易出现转移复发,患者的远期生存率低。众多研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)在胃癌发生、发展过程中起到重要作用。人参皂苷具有多靶点抗肿瘤血管生成作用,具有选择性地抑制肿瘤细胞浸润和转移的作用。本研究纳入胃癌术后化疗加人参皂苷、单纯化疗患者以及门诊浅表性胃炎患者,通过比较不同组别术前、术后血清VEGF的检测值,评价人参皂苷对胃癌患者血清VEGF的影响,为进一步提高胃癌综合疗效提供新的治疗思路。
1 资料与方法
1.1 方法设计 选取2009年2月至2013年12月江苏省中医院收治的胃癌患者94例,其中男63例,女31例,平均年龄48.00岁。采取前瞻性研究方法,42例术后采用FOLFOX4方案化疗,为对照组,以14天为1个周期;52例患者术后采用FOLFOX4化疗+口服参一胶囊(主要成分为人参皂苷Rg3,吉林亚太制药有限公司生产,批号20010103,具体用法:20 mg,每天2次,连续服用30d为1个疗程)方案进行治疗,为实验组。患者术前均未接受化放疗;术后病理组织学分型:高、中分化组(乳头状腺癌和管状腺癌) 共38例, 低分化组(黏液腺癌、印戒细胞癌、低分化腺癌和未分化癌) 共56例。手术结束后对胃癌标本进行淋巴结解剖、取材、分站, 按照美国癌症联合委员会(AJCC) 公布的TNM分期标准(2002年, 第6版) 进行术后病理分期。T分期: Tis 4例, T1 21例, T2 17例, T3 48例, T4 4例, N分期: N0 34例, N1 40例, N2 14例, N3 6例。另纳入门诊浅表性胃炎患者30例为正常组,平均年龄37.43岁。分别在术前、术后第1、3、6个月这4个时间点对正常组、对照组、实验组的血清VEGF进行检测,比较不同组别在相同时间点血清VEGF浓度、同一组别在不同时间点的血清VEGF浓度,以及对照组和实验组术后6个月肿瘤复发情况、复发患者与未复发患者血清VEGF浓度。通过病历记录、门诊随诊以及电话等方式进行随访,以进行病情记录和血液标本采集。
1.2 主要实验试剂和器材
采血管(BD Vacutainer,英国)、人VEGF ELISA 检测试剂盒(R&D,美国)、离心机(BECKMAN,美国)、恒温摇床(江苏太仓科教仪器厂)、移液器(Eppendorf,德国)酶标仪(BIORAD,德国)。
1.3 标本的采集、处理与检测
实验组、对照组患者于入院次日清晨空腹、正常组患者随机清晨空腹抽取外周静脉血10 ml,室温放置30~60 min后3 000 r/min离心10 min,抽取上层血清放至2 ml Eppendort管中,于-80 ℃冰箱保存待测。采用双抗体夹心ELISA法进行检测。
1.4 随访方法
所有病例均进行了随访,在术前、术后1、3、6个月分别进行标本采集和病情记录,以病例记录、门诊、电话等方式进行。通过肿瘤标记物、CT、胃镜检查确诊复发病例。
1.5 病例的脱落与处理
当受试者脱落后,可以采取预约家访、电话、邮件等各种方式与受试者取得联系,询问理由,记录末次服药的时间,完成现有的评估项目。因药物不良反应或治疗无效而退出试验的病例,根据受试者具体病情,按照诊疗规范选择治疗方案。凡是入选的患者,无论是否脱落,均需记录和保留病例实验资料。
1.6 统计学方法
使用t检验或非参数检验对不同组别和各组不同时间点的血清VEGF浓度进行比较,采用χ2检验或确切概率法比较对照组及实验组术后6个月肿瘤复发情况。使用SPSS19.0统计分析软件进行分析。采取α=0.05的双侧检验。
2 结果
2.1 纵向比较——各组不同时间点VEGF浓度比较(表1) 对照组VEGF浓度均高于正常组(P<0.05)。术前、术后1个月、术后3个月:实验组血清VEGF浓度均高于正常组(P<0.05);术后6个月:实验组血清VEGF浓度与正常组比较,差异无统计学意义(P>0.05);术前、术后1个月、术后3个月:实验组与对照组的血清VEGF浓度未见显著差异,但实验组血清VEGF浓度较对照组下降的更为明显;术后6个月:实验组血清VEGF浓度显著低于对照组(P<0.05)。
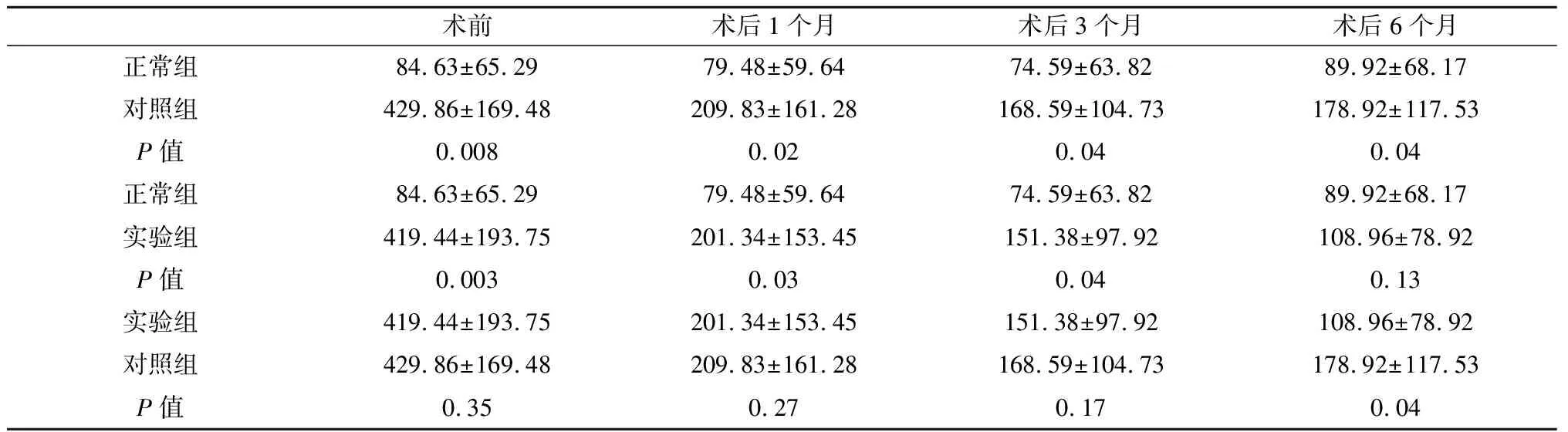
表1 不同时间点在各组间的VEGF比较
2.2 横向比较——不同组别VEGF浓度比较(表2) 正常组:在各时间点均无显著差异;对照组:术后1个月较术前显著下降(P<0.01),术后3个月较术后1个月有进一步下降趋势,但差异不显著(P>0.05),而术后6个月较术后3个月则有轻度升高趋势,但未见显著差异(P>0.05);实验组:术后1个月较术前显著下降(P<0.01),术后3个月较术后1个月进一步下降(P<0.05),术后6个月较术后3个月又进一步下降(P<0.05),且基本降至正常人群水平,与同期正常组无显著差异(P>0.05)。

表2 各组在不同时间点的VEGF比较
2.3 复发情况比较 对照组术后6个月复发6例,复发率14.29%,实验组术后6个月复发3例,复发率5.77%,实验组复发率显著低于对照组(P<0.05)。对照组及实验组所有复发患者术后6个月的血清VEGF浓度均值为(363.14±149.48 pg/ml),而所有未复发患者的血清VEGF浓度均值为(138.47±84.92 pg/ml),复发患者显著高于未复发患者(P<0.01)。各组在不同时间点VEGF变化趋势图见图1。

图1 各组在不同时间点VEGF变化趋势图
3 讨论
胃癌是人类常见恶性肿瘤之一,其发病率在全世界范围内一直居高不下。尽管全球各国都对胃癌的研究投入巨大的人力和物力,胃癌仍然是第二大肿瘤相关死亡病因,其死亡率仅次于肺癌、肝癌。我国是胃癌高发病率、高致死率的国家,全球每年新发病例近百万,其中50%以上在中国[1],全球因胃癌死亡80万人中仅中国就占35%[2-3]。现有的研究表明VEGF是目前已知的作用最强、特异性最高的血管生成调控因子[4],肿瘤组织及患者血清中VEGF的表达对判断肿瘤生物学行为、病情进展、治疗效果及术后生存期等方面具有重要价值。在多种恶性肿瘤的相关研究中,如肝癌、乳腺癌、神经胶质瘤等均发现VEGF 的高表达与肿瘤的生长、转移及浸润有关[5-6]。胃癌患者血清VEGF 水平也同样升高,这在中晚期胃癌中表现尤为明显。故由此认为VEGF参与了胃癌的发生发展及转移,并与肿瘤的浸润和转移密切相关[7-8]。
在本研究中证实了胃癌患者血清内VEGF浓度显著高于非胃癌患者,提示检测胃癌患者血清VEGF浓度可作为诊断指标之一。而术后患者血清VEGF浓度较术前显著下降,并且随化疗的进行,血清VEGF浓度进一步下降,而术后复发患者的血清VEGF浓度则显著高于未复发患者。这些均提示血清VEGF浓度可以作为胃癌诊断、疗效评估、预后及复发情况评价的最有力的指标之一。
内皮抑素是目前活性最强的血管生成抑制剂,人参皂苷Rg3是在内皮抑素N 端添加了9个独特氨基酸序列,其药效及稳定性均得到明显提高,可抑制脑部肿瘤患者血清可溶性VEGF 的表达水平。其主要机制是通过抑制肿瘤的血管形成, 诱导细胞凋亡,具有多靶点抗肿瘤血管生成作用,从而具有抗肿瘤作用[9]。有研究发现,采用联合口服人参皂苷Rg3治疗方案能明显降低浅表性膀胱癌和晚期大肠癌患者的VEGF水平[10-11]。另有实验发现人参皂苷Rg3能明显抑制肿瘤生长和转移,如肝癌[12]、乳腺癌[13]、肺癌[14]、膀胱癌[15]、卵巢癌[16]等,人参皂苷Rg3通过促进肿瘤细胞凋亡在抑制肿瘤细胞生长、转移起着重要作用[17]。但人参皂苷Rg3在胃癌治疗方面的研究鲜见报道。本研究中实验组患者术后血清VEGF浓度进行性下降,程度较对照组更为明显,术后6个月复发率显著低于对照组,提示人参皂苷Rg3能够通过抑制肿瘤的血管形成, 诱导细胞凋亡,抑制胃癌转移与复发。
综上所述, 人参皂苷Rg3可明显降低胃癌患者术后血清VEGF浓度,抑制胃癌细胞的生长, 并呈浓度、时间依赖关系,并降低胃癌术后患者的复发率,有助于提高胃癌化疗的疗效。人参皂苷Rg3 是防治胃癌复发与转移的可行性途径之一。通过分析人参皂苷Rg3的生物活性,研究者已经发现它具有多靶点、高活性的特性[10-17], 因此进一步研究拓宽其抗肿瘤谱, 采取单药、联合用药的方法预防和治疗肿瘤将会有广阔的前景。
参考文献:
[1] Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26(1):48-51.
[2] Yang L.Incidence and mortality of gastric cancer in China[J].World J Gastroenterol,2006,12(1):17-20.
[3] 陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤, 2013 (1):2-12.
[4] Wierzbicki M,Sawosz E,Grodzik M,et al.Comparison of anti-angiogenic properties of pristine carbon nanoparticles[J].Nanoscale Res Lett,2013,8(1):195-198.
[5] Tsutsumi S,Kuwano H,Shimura T,et al.Vascular endothelial growth factor C (VEGF-C) expression in pT2 gastric cancer[J].Hepatogastroenterology,2004,52(62):629-632.
[6] Ohta M,Konno H,Tanaka T,et al.The significance of circulating vascular endothelial growth factor (VEGF) protein in gastric cancer[J].Cancer Lett,2003, 192(2):215-225.
[7] Soumaoro LT,Uetake H,Takagi Y,et al.Coexpression of VEGF-C and Cox-2 in human colorectal cancer and its association with lymph node metastasis[J].Dis Colon Rectum,2006,49(3):392-398.
[8] 李淑坤,李玉林,戎秀阁,等.胃癌血清和尿液中血管内皮生长因子测定及意义[J].中国综合临床,2006,22(5):391-392.
[9] Samoto K,Ikezaki K,Ono M,et al.Expression of vascular endothelial growth factor and its possible relation with neovascularization in human brain tumors[J].Cancer Res, 1995,55(5):1189-1193.
[10] 莫乃新,常宝元,吕忠,等.口服人参皂甙Rg3联合丝裂霉素C膀胱内灌注对表浅性膀胱癌术后血清VEGF的影响[J].中国临床医学,2010,17(5):727-728.
[11] 李晓辉,李军民,冯秋霞,等.参一胶囊联合化疗对晚期大肠癌VEGF的影响[J].中国医学工程,2012,20(1):146-147.
[12] Jiang JW,Chen XM,Chen XH,et al.Ginsenoside Rg3 inhibit hepatocellular carcinoma growth via intrinsic apoptotic pathway[J].World J Gastroenterol,2011, 17(31):3605-3613.
[13] Zhang Q,Kang X,Yang B,et al.Antiangiogenic effect of capecitabine combined with ginsenoside Rg3 on breast cancer in mice[J].Cancer Biother Radiopharm, 2008, 23(5): 647-653.
[14] Lu P,Su W,Miao Z,et al.Effect and mechanism of ginsenoside Rg3 on postoperative life span of patients with non-small cell lung cancer[J].Chin J Integr Med, 2008, 14(1):33-36.
[15] Kim HS,Lee EH,Ko SR,et al.Effects of ginsenosides Rg3 and Rh2 on the proliferation of prostate cancer cells[J].Arch Pharm Res,2004,27(4): 429-435.
[16] Xu T,Cui MH,Xin Y,et al.Inhibitory effect of ginsenoside Rg3 on ovarian cancer metastasis[J].Chin Med J (Engl),2008,121(15):1394-1396.
[17] Wang SH,Wang YC,Nie YL,et al.Antiproliferative activity of the chinese medicinal compound,delisheng, compared with Rg3 and gemcitabine in HepG2 cells[J].Indian J Pharm Sci,2013,75(5):578-584.
