沙苑子总黄酮和百草酸的体内外抗肿瘤作用
2014-04-02孙安盛
白 勇, 孙安盛, 吴 芹
(1.贵州遵义医学院药理教研室,贵州 遵义 563003; 2.郑州市卫生学校药理教研室,河南 郑州 450005)
肿瘤目前已经超过心血管疾病成为致人死亡的第一杀手,在发达国家和我国的大中城市,肿瘤的发病率也在逐年提高[1]。预防和治疗癌症,仍是我们关注的课题。当前从传统医药特别是中草药中寻找多靶点、毒副作用小的抗肿瘤药物已成为国内外医药学专家关注的焦点。
作为我国目前研究较多的中药代表沙苑子总黄酮和百草酸,两者的许多药理作用都受到了关注。沙苑子为豆科植物扁茎黄芪AstraguluscomplanatusR.Br干燥成熟的种子。具有温补肝肾、固精、缩尿、益肝明目的功能。药理研究沙苑子总黄酮(flavonoids extracts fromAstragalicomplanatiSemen)具有改善血液流变学指标、降低血压、调节血脂、抑制血小板聚集、保护肝脏、增强免疫功能、抗炎、镇痛及调节中枢神经系统等作用[2]。百草酸主要成分为熊果酸 (ursolic acid),具有镇静、抗炎、抗菌、抗溃疡、降低血糖、抗氧化等功能[3]。目前对上述两种药物报道的沙苑子总黄酮和百草酸对体内外的抗肿瘤作用,并初探其可能的作用机制。
1 材料和方法
1.1 药品、细胞、试剂和仪器 沙苑子总黄酮由苏州中药所植化室提供;百草酸由上海师范大学杨庆尧教授提供,其中体内使用的熊果酸水平为87%,体外使用的熊果酸纯度99.5%;环磷酰胺(上海华联制药有限公司),国药准字H31021703,批号060107,200 mg/瓶;羟基喜树碱(哈尔滨三联药业有限公司),国药准字H23022626,批号050901A,2 mL 1支,2 mg/支。S180肉瘤细胞来自苏州大学药理学教研室。人结肠癌细胞株SW620购自中国科学院上海细胞生物研究所的细胞库。MTT(南京兴生生物);RT 试剂(大连宝生物公司);P53、Bcl-2、Bax及β-actin的引物由大连宝生物设计(表1),上海皓嘉生物科技有限公司合成,由TaKaRa生物工程公司合成。二甲基亚砜(DMSO)(上海化学试剂厂);生产RNA 逆转录仪(德国Eppendorf公司);PCR热循环仪(美国BIO-RAD公司);电子天平(北京赛多利斯电子有限公司);倒置显微镜(美国Napco公司)。

表1 各基因的引物序列
1.2 实验动物、分组及药物的配制 昆明种小鼠,体质量18~22 g,120只,清洁级,由苏州大学实验动物中心提供,实验动物生产许可证号:XCYK(苏)2002-0008,实验动物使用许可证号:SYXK(苏)2002-0037。饲养环境的室温控制在20~25 ℃,室内安静,每日光照12 h,动物自由进食、饮水。随机分为11组,每组小鼠10只,分别为:(1)模型组;(2)环磷酰胺25 mg/kg组;(3)羟基喜树碱5 mg/kg组;(4)沙苑子总黄酮50 mg/kg组;(5)沙苑子总黄酮100 mg/kg组;(6)沙苑子总黄酮200 mg/kg组;(7)沙苑子总黄酮400 mg/kg;(8)百草酸50 mg/kg组;(9)百草酸100 mg/kg组;(10)百草酸200 mg/kg组;(11)百草酸400 mg/kg组[4-6]。由于沙苑子总黄酮易溶于水,百草酸不溶于水,两种药分别制成溶液和混悬液,环磷酰胺用生理盐水溶解,灌胃给药。MTT溶液:取适量MTT溶于PBS中,使其终质量浓度为5 mg/mL,过滤除菌,分装,避光保存。
1.3 动物模型的制备、给药及处理 抽取S180肉瘤小鼠腹腔的腹水,用生理盐水以1∶4比例混匀,记数按(2~4)×106/只接种数接种在小鼠的右侧腋窝皮下[7]。小鼠接种S180肉瘤腹水后的第2天,称定质量,每日按0.2 mL/10 g体质量分别灌服给药模型组灌服蒸馏水;环磷酰胺对照组每日按0.2 mL/10 g体质量分别灌服环磷酰胺;给药组隔天称定质量连续给药10 d,羟基喜树碱对照组每日按0.1 mL/10 g腹腔注射,隔天1次,第11天各组小鼠称定质量后颈椎脱臼处死,剥取肿瘤、脾脏、胸腺并称定质量[8]。
相关的计算公式:体内抑瘤率[9](inhibitive rate of tumorinvivo)=(1-给药组瘤定质量/模型组瘤定质量)×100%;胸腺指数及脾指数计算公式[10]:胸腺指数(Thymus index, TI)=胸腺质量(mg)/体质量(g);脾指数(Spleen index,SI)=脾质量(mg)/体质量(g)。
1.4 肿瘤细胞的培养、接种、给药及抑制率检测 SW620细胞5×105个/mL悬液,置于L-15培养液,培养液含10% FBS,于37 ℃、5% CO2培养箱进行培养, 隔日换液,3~4 d传代,取对数生长期细胞用于实验。取对数生长期肿瘤细胞5×105个/mL,接种于96孔培养板中,100 μL/孔。24 h后加入不同质量浓度熊果酸(10、20、30、40、50 μmol/L)[11-12], 对照组加0.6%DMSO,每组均设6个复孔,取其均值计算增殖抑制率, 并求其IC50,离心后吸净上清,每孔加入100 μL DMSO,轻微震荡10 min,待结晶充分溶解,于酶标仪(波长490 nm)检测吸光度A值。分别检测 12、24、36、48、72 h的A值,以时间为横轴,A值为纵轴绘制细胞生长曲线。
肿瘤细胞生长抑制率=[(A对照组-A实验组)/A对照组] × 100%
1.5 相关基因的mRNA表达测定 取对数生长期SW620细胞,分为DMSO对照组,熊果酸40 μmol/L组(分别处理3、6、12、24、48 h)。按Trizol试剂盒说明提取细胞总mRNA,收集细胞加入1 mL Trizol液,匀浆,室温静置10~15 min,使细胞完全破壁。取匀浆转入Eppendorf管中,加入三氯甲烷0.2 mL,剧烈震荡15 s,室温静置 2~3 min,4 ℃离心12 000 r/min×15 min,转移上层无色水相至另一Eppendorf管中。加入 0.5 ml 异丙醇,混匀,室温静置10 min; 4 ℃离心12 000 r/min×10 min,弃上清,75%乙醇洗涤沉淀一次,4 ℃离心7 500 r/min×5 min,室温干燥沉淀5 min,取适量DEPC水溶解沉淀,并在室温静置10 min,使沉淀完全溶解,分装后-80 ℃保存备用。测定制备mRNA样本的OD260/280的比值及进行琼脂糖凝胶电泳,检测mRNA的纯度和完整性,并根据其来定量。逆转录合成cDNA(逆转录反应体系: 5×primescriptTMBuffer(for Real Time) 2.0 μL;primescriptTMRT Enzyme Mix 0.5 μL;Oligo(dT)premier(50 μM) 0.5 μL;Random 6 mers(100 μmol/L) 0.5 μL;Total RNA 1.0 μL;Rnase Free dH2O 5.5 μL;Total 10.0 μL),加以上试剂的操作均在冰盒上进行,然后在仪器中逆转录(两步法:时间分别为15 min 30 s)逆转录反应产物保存于-20 ℃备用。

2 结果
2.1 沙苑子总黄酮和百草酸对体内肿瘤的影响 分组时及术前各组小鼠的体质量无差异,各组均长出肿瘤,说明造模成功,环磷酰胺组在造模后7 d和10 d各死亡1只,环磷酰胺组对胸腺有明显的促进作用(P<0.05),羟基喜树碱组对脾脏有明显的促进作用(P<0.05),均无明显抑制作用通过与模型组和阳性组比较可以得出,沙苑子总黄酮和百草酸对S180肉瘤小鼠均有抑制作用,百草酸的抑制作用更加明显(P<0.05)。上述两药对胸腺和脾脏均无明显抑制作用(P>0.05)(表2)。

表2 沙苑子总黄酮和百草酸对小鼠S180肿瘤的作用
2.2 沙苑子总黄酮和熊果酸对体外肿瘤细胞的影响 倒置下观察, 正常对照组细胞呈梭形,生长良好,且融合形成集落(图1-a)。熊果酸作用24 h后,细胞死亡增多(图1-b)。加入熊果酸30~50 μmol/L对SW620细胞增殖产生明显的抑制作用,且呈时间、质量浓度依赖性,熊果酸10,20 μmol/L未见没有明显影响(表3)。IC50计算软件(1.00版本)统计结果显示,熊果酸作用24、48、72 h的IC50分别为43.58、31.57、27.86 μmol/L。

图1 SW620细胞(24 h×400)
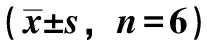
表3 熊果酸对人结肠癌SW620细胞增殖的抑制作用
2.3 总mRNA提取结果分析 提取的熊果酸(40 μmol/L)作用的SW620的mRNA,先用25 μL DEPC水溶解后,取 2 μL 加水稀释后用紫外分光光度计测定各样本总RNA在波长260与280 nm处的OD值,OD260/280比值在1.8以上,表明抽提的RNA纯度较高,无DNA污染(表4)。取 3 μL 加适量的溴芬兰在含EB的1%琼脂糖凝胶上点样,110 V电压下电泳15 min,使用凝胶成像系统观察结果。可见明亮清晰的28 S 和18 S两条RNA带,说明提取的mRNA完整(图2)。

表4 提取SW620细胞mRNA的质量和可信度

图2 提取的总mRNA在1%琼脂糖凝胶上的条带
沙苑子总黄酮对人结肠癌SW620细胞无明显抑制作用(P>0.05),而熊果酸却能明显的抑制该肿瘤细胞(P<0.05);熊果酸显著上调促凋亡基因P53和Bax的表达(P<0.05),下调抑凋亡基因Bcl-2的表达(P<0.05)(图3)。

注:与对照组比较
3 讨论
有研究证实沙苑子总黄酮和百草酸有抗肿瘤的作用[13-14],通过对相关报道的深入研究,为开发利用传统中药奠定基础。本研究采用通过体内体外筛选上述两药对肿瘤的作用,体内通过S180肉瘤模型证实了沙苑子总黄酮具有一定的抗肿瘤作用(仅200 mg/kg,抑制率23.52%<30%;400 mg/kg,抑制率41.67%>30%),而百草酸具有较强的抗肿瘤作用(50 mg/kg,抑制率37.34%>30%;100 mg/kg,抑制率42.32%>30%),体外抗肿瘤模型从两药对人结肠癌细胞的作用证实了熊果酸抗肿瘤作用明显(40~50 μmol /L,>24 h),其机制至少与上调凋亡基因P53和Bax、下调Bcl-2等抑凋亡基因的mRNA表达有关。沙苑子总黄酮无体外的抗肿瘤作用。分析沙苑子总黄酮在体内有一定抗肿瘤作用,在体外抗肿瘤作用不明显,其原因可能与沙苑子总黄酮本身的性质有关,该药是含有多种成分的中成药,对具体的相关成分的作用和含量研究不明确,它所表现的作用其实是多种成分共同作用的结果,这些成分在肿瘤相关因素中有抑制肿瘤和诱发肿瘤的两方面,该批次的沙苑子总黄酮有一定的体内作用但是不明显,说明抑制肿瘤和诱发肿瘤的综合作用基本达到平衡。由此,本课题组考虑在以后的研究中通过改进药物制备技术和方法,保留更多的抗肿瘤成分,去掉一些诱发肿瘤发生的成分,当然这中间还有很多工作去做,比如,查阅或研究沙苑子总黄酮相关成分的含量和药理作用,为最终药物相关成分的取舍奠定基础,从而得到理想的抗肿瘤中成药。
百草酸中含有最多的成分是熊果酸,人们通过对熊果酸单体的研究证实了它在体内外的都有明显的抗肿瘤作用,这样就很容易理解为何百草酸在体内外都有明显的抗肿瘤作用了。
通过对上述两种中成药体内外抗肿瘤作用的研究,发现要特别注意中成药中主要成分的药理作用,要想得到稳定而有效的中成药,必须要非常注意药物的制备技术、方法与各种相关成分的作用所达到效果的关系。只有有目的的取舍,才能够朝着目标迈进。
参考文献:
[1] Tonani M,Carvalho E C.Cancer risk and preventive behavior:per-sursolic acidsion as an intervention strategy[J].RevLatAmEnfermagem,2008,16(5):864-870.
[2] 刘丽君,佟海宁.沙苑子总黄酮药理作用研究进展[J].亚太传统医药,2012,8(1):181-183.
[3] 刘毅敏,张定林,肖 湘,等.熊果酸抗肿瘤作用及其机制研究进展[J].重庆医学,2012,41(4):398-400.
[4] 朱坤杰,宋 娟,沈云虹,等.库拉索芦荟多糖和木立芦荟多糖体内抗肿瘤作用[J].中成药,2010,32(11): 1978-1980.
[5] 蔡国琴,张 聪,郑 礼.六神丸体内抗肿瘤药效学研究[J].中成药,2012,34(6):1163-1166.
[6] 陈 勇, 李 祥,陈建伟,等.双四氢呋喃型番荔枝内酯体内抗肿瘤作用[J].中草药, 2012,43(1):139-142.
[7] Guo Q Y,Yuan M,Peng J,etal. Antitumor activity of mixed heat shock protein/peptide vaccine and cyclophosphamide plus interleukin-12 in mice sarcoma[J].JExpClinCancerRes,2011, 30:24.
[8] 魏 伟,吴希美,李元建.药理实验方法学[M].北京:人民卫生出版社,2010:1581-1610.
[9] 王赞宏,李 莉,彭芝兰,等. 自噬基因Beclin1对宫颈癌HeLa细胞生长影响的体内外研究[J].中华肿瘤杂志, 2011,33(11):804-809.
[10] Wang W, Zhao M, Wang Y,etal. {2-[1-(3-Methoxycarbonylmethyl-1H-indol-2-yl)-1-methyl-ethyl]-1H-indol-3-yl}-acetic acid methyl ester (MIAM): its anti-cancer efficacy and intercalation mechanism identified via multi-model systems[J].MolBiosyst,2011,7(3):766-772.
[11] Bajbouj K, Schulze-Luehrmann J, Diermeier S,etal. The anticancer effect of saffron in twoP53 isogenic colorectal cancer cell lines[J].BMCComplementAlternMed,2012,12(1):69.
[12] Rajabi M, Gorincioi E, Santaniello E. Antiproliferative activity of Kinetin Riboside on HCT-15 colon cancer cell line[J].NucleosidesNucleotidesNucleicAcids,2012,31(6):474-481.
[13] 刘春宇,顾振纶,杜崇民,等.沙苑子总黄酮抗肿瘤活性部位体内外筛选[J]. 中草药, 2007,38(7):1052-1054.
[14] 李希波,孙雪飞,尹秋伟,等.熊果酸体内抗肺癌作用机制探讨[J]. 山东大学学报:医学版, 2007,45(2):188-191.