微颗粒饲料中添加精胺对半滑舌鳎稚鱼生长和肠道发育的影响
2014-03-29于朝磊常青秦帮勇王新星
于朝磊常 青秦帮勇王新星
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国水产科学研究院黄海水产研究所, 青岛 266071)
微颗粒饲料中添加精胺对半滑舌鳎稚鱼生长和肠道发育的影响
于朝磊1,2常 青2秦帮勇1,2王新星2
(1. 上海海洋大学水产与生命学院, 上海 201306; 2. 中国水产科学研究院黄海水产研究所, 青岛 266071)
为获知微颗粒饲料中添加精胺对半滑舌鳎仔稚鱼肠道发育的影响, 试验以添加 0, 0.10%, 0.33%精胺的微颗粒饲料(F1、F2、F3)和活饵料卤虫(F4)饲喂初始体长为2 cm左右的半滑舌鳎稚鱼。养殖28d后结果表明, 卤虫组(F4)的特定生长率最高, 饲料组中F2组特定生长率要显著高于F1和F3组(P<0.05)。F3组的存活率仅为60.27%, 显著低于其他各组(P<0.05)。消化酶活力测定结果中, F2组在14d和28d时都含有较高的碱性磷酸酶比活力和亮氨酸氨基肽酶比活力, 较低的亮氨酸-丙氨酸肽酶比活力。卤虫组的肠道发育情况最好, 微绒毛长度显著大于其他各组(P<0.05); 黏膜厚度略小于 F2组, 但是没有显著性差异(P>0.05); 饲料组中F2组微绒毛长度和黏膜厚度都显著大于F1和F3组(P<0.05)。研究表明, 在微颗粒饲料中添加0.10%的精胺(F2组)对半滑舌鳎稚鱼肠道发育有促进作用。
微颗粒饲料; 精胺; 半滑舌鳎; 稚鱼; 肠道发育
半滑舌鳎(Cynoglossus semilaevis Günther)隶属鲽形目(Pleuronectiformes)、舌鳎科(Cynoglossidae)、舌鳎属(Cynoglossus Buchanan Hamiltou), 是我国海水养殖中重要的经济鱼类。近年来, 半滑舌鳎人工繁殖技术的研究取得了重大的进展[1], 但是仔稚鱼期间转换微粒饲料通常会出现生长缓慢、死亡率高、摄食率低且消化率低及组织器官发育异常等问题,其中一个重要原因是海水鱼类仔稚鱼在生命早期的前五周是消化道形态和功能发生重大变化的时期[2],这期间消化道发育不完善, 对外源性营养不能充分吸收和消化。目前对半滑舌鳎仔稚鱼消化系统器官发育的组织学研究已有报道[3], 但是尚未见其仔稚鱼肠道发育营养调控的报道。
精胺(Spermine, SPM)是多胺的一种, 是在生物代谢中产生的一种脂肪族胺类, 它广泛存在于生物体内, 参与细胞功能的调节[4]。它在机体内具有特殊的生理功能, 是生物体内不可缺少的营养成分之一。近年来很多文献表明, 精胺对于动物幼体的消化道成熟有很大的促进作用, 尤其是对小肠黏膜有重要的生物学意义。有研究表明, 外源性精胺可在肠腔内快速被小肠黏膜上皮细胞吸收[5,6]。动物幼体通过摄入合适剂量的外源多胺, 能够促进其肠道细胞的增殖和损伤的修复, 并且可以促进进动物幼体消化道生理生化指标达到成年动物水平[7—9]。
目前半滑舌鳎苗种培育过程中仍然依赖活饵料的供应, 其生产成本高, 产量和质量不稳定且可能携带病原微生物等原因, 制约了海水育苗生产。本试验旨在探讨微颗粒饲料中添加精胺对半滑舌鳎稚鱼生长性能、肠道消化酶和组织结构的影响, 探索促进半滑舌鳎稚鱼肠道发育的方法, 使之尽快达到成鱼的消化水平, 从而能够提高仔稚鱼对外源性营养物质的吸收和利用。研究结果为解决海水鱼类饵料供应和顺利转饵提供了一个途径。
1 材料与方法
1.1 试验动物与饲养管理
本试验是2012年6—7月份在山东省海阳市黄海水产股份有限公司完成。试验动物是采用人工繁殖同一批卵孵化后18日龄(底栖初期), 初始体长为2 cm左右的半滑舌鳎稚鱼。
试验设4个处理组, 分别投喂3组试验饲料和一组活饵料卤虫(卤虫干重营养成分: 粗蛋白占52.79%; 粗脂肪占25.32%)。每组三个平行。孵化后18d的试验鱼随机分配在12个直径1 m, 高1 m的圆柱形养殖桶中, 每桶 250尾鱼, 暂养一周后正式开始试验。水位50 cm左右, 流水养殖, 连续充气,饲料组每天投喂微颗粒饲料5次(7:00、11:30、16:00、18:30和 21:30), 卤虫组每天投喂卤虫 2次(7:00和21:30), 饱食投喂。投喂时水位保持在 20 cm左右,并停止向缸中注水, 投喂30min后吸底, 保持流水。试验期间水温在(23—25)℃。
1.2 微颗粒饲料的配制及分析
3组微颗粒饲料分别以基础饲料添加不同含量的精胺(由 Sigma公司生产, S3256)配制而成, 基础饲料由白鱼粉(购自青岛金海力水产科技有限公司),大豆浓缩蛋白(购自青岛金海力水产科技有限公司),磷虾粉(购自济南科瑞尔实业有限公司)和预混料(购自青岛金海力水产科技有限公司)等组成。精胺的添加量依据 Peres, et al.[10]对海鲈鱼(Dicentrarchus labrax)仔鱼的研究。3种试验饲料组分别为: F1, 基础饲料; F2, 基础饲料+0.10%的精胺; F3,基础饲料+0.33%的精胺。F4为卤虫组, 投喂鲜活饵料卤虫。
试验饲料配方参照表 1。精胺在饲料中的添加水平分别为0(F1)、0.10%(F2)和0.33%(F3)。先将各种原料粉碎至 88 µm以下, 充分混匀, 加入鲜鱿鱼浆和鱼油, 再次混合均匀后制粒。然后 60℃烘干,破碎, 过筛, 得到粒径为(150—200)、(200—300)和(300—450) µm三种规格的微颗粒饲料, 置于–20℃的冰箱中备用。
饲料中水分的测定为 105℃烘干恒重法(24h);粗蛋白的测定为凯氏定氮法, 采用意大利 UDK142型全自动凯氏定氮仪; 粗脂肪的测定为索氏抽提法,采用丹麦SOXTECTM2050型索氏抽提仪。

表1 试验饲料配方及营养组成Tab. 1 Diet formulation and proximate composition (%)
1.3 取样与分析
取样 体重、酶活性的测定, 每 14d取样 1次, 每桶取20尾用于体重的测定, 10尾用于酶活性的测定; 肠道组织切片材料, 试验结束时(28d)取样1次。采样时间为每日第一次投饵之前进行。取样后放于–80℃冷冻保存。
样品的处理 取鱼的腹部内脏团(鳃盖骨后缘至肛门后缘)于离心管中, 加入4倍质量比的冰冷双蒸水, 匀浆。匀浆液一部分用于提取刷状缘膜, 剩余匀浆液在4℃条件下3300 g/min离心3min, 取上清液, 稀释成适当的浓度用于测定肠酶的活力, 包括碱性磷酸酶、亮氨酸氨基肽酶和亮氨酸—丙氨酸肽酶。
刷状缘膜的分离提取 参照Crane, et al.[11]的方法提取肠刷状缘膜(BBM), 用于测定肠刷状缘膜中的碱性磷酸酶和亮氨酸氨基肽酶的活力。
肠道组织切片的制备 取全鱼, 用 Davidesdous液固定24h后, 置于70%乙醇中保存。乙醇脱水, 石蜡包埋, LEICA RM2235型切片机连续切片,切片厚度为 6 μm, HE染色, 中性树脂封片, Nikon E800型显微镜下观察、拍照。
1.4 指标测定与方法
生长性能计算 特定生长率SGR(%/d)=(ln末均干重–ln初均干重)/饲养天数×100
存活率SR(%)=(试验开始时的鱼尾数–死亡的鱼尾数)/试验开始时的鱼尾数×100
生理生化指标的测定 碱性磷酸酶和酶液蛋白浓度均采用南京建成生物工程研究所试剂盒测定。亮氨酸氨基肽酶(LAP)的测定参照Maroux, et al.[12]的方法。亮氨酸-丙氨酸肽酶(Leu-Ala)的测定参照Nicholon, et al.[13]的方法。
每组选取 5个肠道组织切片, 进行肠微绒毛(肠道上皮细胞表面伸出的细长指状突起)长度和黏膜(肠道内壁的黏膜层)厚度的测量, 观察肠道发育情况。
1.5 统计分析
试验结果以平均数±标准误表示, 经SPASS17.0处理, 使用单因素方差分析(One-Way ANOVA), 用Duncan 氏法进行多重差异显著性比较, 显著水平P<0.05。若差异显著则采用用 Duncan 氏检验进行多重比较分析。
2 结果
2.1 微颗粒饲料中添加精胺对半滑舌鳎稚鱼生长与成活率的影响
不同试验组的生长指标见表2。结果显示: 饲料中添加精胺对半滑舌鳎仔稚鱼的干重影响不大, 各饲料组之间没有显著性差异(P>0.05), 卤虫组与各饲料组之间存在显著性差异(P<0.05); 试验鱼的SGR在14d和28d时都是卤虫组最高, 且与各饲料组之间差异性显著(P<0.05), 饲料组中F2组与未添加精胺的 F1组在 14d和 28d都存在显著差异(P<0.05), 但F2组与F3组之间差异不显著(P>0.05)。
在试验结束时, 卤虫组的存活率(表 2)达到99.60%, 显著高于各饲料组(P<0.05); 各饲料组中, F3组存活率仅为60.27%, 显著低于F1和F2组(P<0.05),而F1和F2组之间没有显著性差异(P>0.05)。
2.2 微颗粒饲料中添加精胺对半滑舌鳎稚鱼肠道消化酶活力的影响
14d时卤虫组的碱性磷酸酶活性显著低于各饲料组(P<0.05)(图1), 各饲料组间碱性磷酸酶活性没有显著性差异(P>0.05); 28d时, F1组碱性磷酸酶活性显著低于其他各组(P<0.05), 其他各组间没有显著性差异(P>0.05)。

表2 精胺对半滑舌鳎稚鱼生长与成活率的影响Tab. 2 Effects of spermine on the growth and survival rate in the postlarvae of Cynoglossus semilaevis Günther

图1 精胺对半滑舌鳎稚鱼肠道碱性磷酸酶比活力的影响Fig. 1 Effect of spermine on alkaline phasphatase relative activities in the postlarvae of Cynoglossus semilaevis Günther
14d时F1组鱼体内亮氨酸氨基肽酶活力显著低于其他组(P<0.05), 其他组间没有显著性差异(P>0.05); 28d时, F2和F3组鱼体内亮氨酸氨基肽酶活性没有显著性差异(P>0.05), 但是F2和F3组显著高于F1和F4组(P<0.05), F1和F4组之间没有显著性差异(P>0.05)(图2)。
14d时F2和F3组鱼体内亮氨酸-丙氨酸肽酶活性没有显著性差异(P>0.05), 但明显低于F1和F4组(P<0.05), F1组明显地高于F4组(P<0.05); 28d时, F1和 F2组鱼体内亮氨酸-丙氨酸肽酶活性没有显著性差异(P>0.05), 但明显低于F3和F4组(P<0.05), F3组显著性低于F4组(P<0.05)(图3)。
刷状缘膜碱性磷酸酶与亮氨酸-丙氨酸肽酶的比值(AP/leu-ala)(图4)在 14d时比值大小依次是F3>F2>F1>F4, 并且各组之间存在显著性差异(P>0.05); 28d时 F2和 F3组之间没有显著性差异(P>0.05), 显著高于F1和F4组(P<0.05), F1和F4组之间没有显著性差异(P>0.05)。
刷状缘膜亮氨酸氨基肽酶与亮氨酸—丙氨酸肽酶的比值(LAP/leu-ala)(图5)在14d时F2组、F3组和F4组高于F1组, 但是各组之间没有显著性差异(P>0.05); 28d时F1组最低, F3组最高, F2组和F4组之间没有显著性差异(P>0.05), 且F3组和F2组之间也没有显著性差异(P>0.05)。
2.3 微颗粒饲料中添加精胺对半滑舌鳎稚鱼肠道组织结构的影响
各组试验鱼的肠道发育情况如表3和图6所示。F4组的肠道发育情况最好, 微绒毛长度显著大于其他各组(P<0.05); 黏膜厚度略小于 F2组, 但是没有显著性差异(P>0.05), 较 F1和 F3组有显著性差异(P<0.05)。F2组微绒毛长度和黏膜厚度都显著大于F1和F3组(P<0.05)。F1和F3组微绒毛长度和黏膜厚度都没有显著性差异(P>0.05)。
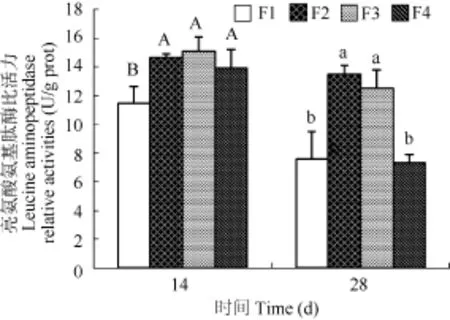
图2 精胺对半滑舌鳎稚鱼亮氨酸氨基肽酶比活力的影响Fig. 2 Effect of spermine on leucine aminopeptidase relative activities in the postlarvae of Cynoglossus semilaevis Günther

图3 精胺对半滑舌鳎稚鱼亮氨酸-丙氨酸肽酶比活力的影响Fig. 3 Effect of spermine on Leucine-alanine peptidase relative activities in the postlarvae of Cynoglossus semilaevis Günther

图4 精胺对半滑舌鳎稚鱼刷状缘膜碱性磷酸酶/亮氨酸-丙氨酸肽酶比值的影响Fig. 4 Effect of spermine on BBM alkaline phasphatase / Leucine-alanine peptidase in the postlarvae of Cynoglossus semilaevis Günther

表3 精胺对半滑舌鳎稚鱼肠道显微结构指标的影响Tab. 3 Effects of spermine on the intestinal microscopic structure parameters in the postlarvae of Cynoglossus semilaevis Günther (µm)
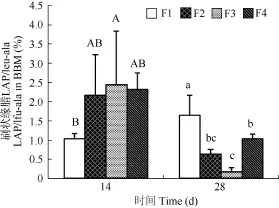
图5 精胺对半滑舌鳎稚鱼刷状缘膜亮氨酸氨基肽酶/亮氨酸-丙氨酸肽酶比值的影响Fig. 5 Effect of spermine on BBM leucine aminopeptidase / Leucinealanine peptidase in the postlarvae of Cynoglossus semilaevis Günther
3 讨论
3.1 在微颗粒饲料中添加精胺对半滑舌鳎稚鱼生长与成活率的影响
经过四周的试验, 各饲料组在14d和28d的干重并没有显著性的差异, 这一结果与海鲈鱼[10]的研究结果相似。F2组的特定生长率在14d和28d都高于F1和F3组, 并且和F1组存在显著差异, 说明微颗粒饲料中添加一定量的精胺对半滑舌鳎稚鱼的生长有一定的促进作用。
关于精胺对幼体动物存活率的影响, 不同的试验结果有所不同。Peres, et al.[10]对海鲈仔鱼研究中,成活率随着微颗粒饲料中添加精胺量的增加而增加。而Sousadias, et al.[14]发现高剂量的精胺对鸡会有毒副作用。在本试验中, 添加0.10%精胺的试验组(F2组)与未添加精胺的试验组(F1组)的成活率没有显著性差异, 而添加 0.33%精胺的试验组(F3组)的成活率仅为60.27%, 明显低于F1和F2组的成活率。这样说明微颗粒饲料中添加 0.33%的精胺可能对半滑舌鳎稚鱼产生毒副作用, 从而影响了其存活。
3.2 在微颗粒饲料中添加精胺对半滑舌鳎稚鱼消化酶活力的影响
水产动物摄食的饲料需要经过消化系统的机械处理和消化酶的分解, 逐步达到可吸收状态而被消化道的上皮吸收[15]。分析消化酶活性的水平, 能够体现不同处理水平下各组之间消化系统发育情况的差异[16]。在肠的上皮细胞中存在着两种类型的酶类:刷状缘膜酶(存在于肠上皮细胞的细胞膜中, 例如碱性磷酸酶和亮氨酸氨基肽酶)和胞浆酶(存在于肠上皮细胞的细胞质中, 主要是以肽酶形式存在, 例如亮氨酸-丙氨酸肽酶)。肠道中这些不同的酶起着互补的作用, 有助于营养成分在肠上皮细胞的消化和吸收[17]。
在对几种仔稚鱼的肠道发育的研究中发现, 伴随着小肠延长和肠黏膜褶皱高度增加等体现肠发育成熟的现象, 肠道中的刷状缘膜酶活性也急剧地增强[18—20]。碱性磷酸酶(AP)是非特异性磷酸单酯酶,主要存在于前肠的刷状缘膜上, 其活性一定程度上能够反映肠上皮细胞的发育水平, 因此常作为水生动物肠黏膜发育成熟度的标识酶[21]。在试验中, 添加精胺组的试验鱼在14d和28d都含有较高的碱性磷酸酶, 这说明精胺可以促进半滑舌鳎稚鱼肠上皮细胞的成熟。Peres, et al.[10]对海鲈鱼的研究中也发现了类似的现象, 微颗粒复合饲料中添加 0.33%的精胺后, 碱性磷酸酶活性显著性提高。亮氨酸氨基肽酶(LAP)是一种蛋白分解酶, 能水解肽链 N端由亮氨酸和其他氨基酸所形成的肽键[22]。刷状缘膜亮氨酸氨基肽酶活性的增加能够表明肠上皮细胞的成熟[23,24]。跟许多试验的结果类似, Peres, et al.[10]研究海鲈鱼在31和38d时添加0.33%精胺组都含有最高的亮氨酸氨基肽酶活性。在本试验中亮氨酸氨基肽酶在14d时添加精胺的两饲料组活性比F1和F4组都要高, 在 28d是也是出现这样的结果, 并且差别更加显著。这说明微颗粒饲料中添加精胺后能够增加亮氨酸氨基肽酶的活性, 表明精胺能够促进肠道上皮细胞的成熟。
Nicholson, et al.[25]检测出亮氨酸-丙氨酸肽酶(leu-ala)大部分存在肠上皮细胞胞质中, 是肠上皮细胞胞质中的特有酶类。在幼体发育的前3周里亮氨酸-丙氨酸肽酶的活性会很高, 随着幼体的生长其活性会不断降低[26], 这种酶活性随着幼体发育的变化为评价肠道的发育水平提供了很好指标。在本试验中, 添加精胺组的试验鱼在14d时添加精胺的F2和 F3两组的亮氨酸-丙氨酸肽酶活性明显低于卤虫组和F1组, 在28d时添加0.10%精胺组(F2组)含有亮氨酸-丙氨酸肽酶活性最低, 这说明精胺的添加促使亮氨酸-丙氨酸肽酶的活性降低, 这正是肠道发育的表现。

图6 精胺对半滑舌鳎稚鱼肠道组织的影响Fig. 6 Effect of spermine on intestine structure in the postlarvae of Cynoglossus semilaevis Günther
碱性磷酸酶/亮氨酸-丙氨酸肽酶的比值(AP/leu-ala)和亮氨酸氨基肽酶/亮氨酸-丙氨酸肽酶的比值(LAP/leu-ala)被Zambonino, et al.[17]认为是反映肠道发育成熟的重要指标。Suzer, et al.[27]也认为鱼类肠上皮细胞一个成熟的特点就是有一个高的刷状缘膜酶水平和低的胞浆酶水平。在本试验中, AP/leu-ala在14d时添加精胺的两组(F2和F3)都高于其他两组(F1和F4), 而且差异性显著。28d时也有同样的结果,只不过是F2组略高于F3组。LAP/leu-ala在14d时F3组最高, 虽然与F2和F4之间没有显著性差异, 但是与F1组之间存在着显著性差异。Zouiten, et al.[28]对海鲈鱼和Boglino, et al.[29]对塞内加尔鳎(Solea senegalensis)的研究中也发现 AP/leu-ala和LAP/leu-ala高的组肠道发育好。这说明添加精胺促进了F2和 F3组半滑舌鳎肠道的发育。
3.3 在微颗粒饲料中添加精胺对半滑舌鳎稚鱼肠道组织结构的影响
小肠微绒毛长度和黏膜厚度增加能够扩大肠道的表面积, 促进小肠的消化吸收, 是肠道发育成熟的重要指标[5]。有研究表明, 外源性精胺可在肠腔内快速被小肠黏膜上皮细胞吸收[30]。通过对幼体动物摄入合适剂量的外源多胺, 能够促进幼体动物消化道生理生化指标达到成年动物水平。
精胺对于幼体动物的肠道成熟有很大的促进作用, 尤其是对小肠黏膜有重要的生物学意义。在本试验中, 微绒毛长度以F4组最高, F2组次之。黏膜厚度以F2组最高, 添加精胺量为0.1%组(F2组)鱼体微绒毛长度显著大于未添加精胺组(F1组)和添加0.33%精胺组(F3组), 并且F2组黏膜厚度比卤虫组还要厚, 虽然两组之间没有显著性差异。这说明外源精胺的摄入能够增加小肠微绒毛长度和黏膜厚度,能够促进肠道的提前发育, 表明添加精胺量为0.1%组的肠道发育程度最好。这个结果与一些学者的观点一致[30,31]。本试验发现添加高剂量精胺组试验鱼小肠绒毛长度比低剂量精胺含量组试验鱼小肠绒毛长度短, 这是否是因为添加高含量的精胺会对半滑舌鳎稚鱼肠道发育产生负面影响还有待进一步研究。
4 结语
在本试验条件下, 从半滑舌鳎仔稚鱼生理生化和肠道发育学指标来看, 在微颗粒饲料中添加精胺能够促进肠道的发育成熟。但是添加精胺量为0.33%时, 半滑舌鳎死亡率大大增加。因此, 综合上述数据分析认为, 微颗粒饲料中添加 0.10%的精胺对半滑舌鳎稚鱼肠道发育有促进作用。
[1] Liu X Z, Zhuang Z M, Ma A J, et al. Operative technologies for seedling rearing of Cynoglossus semilaevis Günter [J]. Marine Fisheries Research, 2006, (2): 17—24 [柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎苗种生产技术的开发研究.海洋水产研究, 2006, (2): 17—24]
[2] Cahu C L, Infante J Z. Maturation of the pancreatic and intestinal digestive functions in sea bass (Dicentrarchus labrax): effect of weaning with different protein sources [J]. Fish Physiology and Biochemistry, 1995, 14(6): 431—437
[3] Chang Q, Cheng S Q, Zhang X M, et al. Histological study of the organogenesis of the digestive system of the tonguefish, Cynoglossus semilaevis [J]. Journal of Fisheries of China, 2006, 29(4): 447—453 [常青, 陈四清, 张秀梅,等. 半滑舌鳎消化系统器官发生的组织学. 水产学报, 2006, 29(4): 447—453]
[4] Thomas T, Thomas T J. Polyamines in cell growth and cell death: molecular mechanisms and therapeutic applications [J]. Cellular and Molecular Life Sciences, 2001, 58(2): 244—258
[5] Uda K, Tsujikawa T, Fujiyama Y, et al. Rapid absorption of luminal polyamines in a rat small intestine ex vivo model [J]. Journal of Gastroenterology and Herpetology, 2003, 18(5): 554—559
[6] Peulen O, Deloyer P, Dandrifosse G. Short-term effects of spermine ingestion on the small intestine: a comparison of suckling and weaned rats [J]. Reproduction Nutrition Development, 2004, 44(4): 353—364
[7] Osborne D L, Seidel E R. Microflora-derived polyamines modulate obstruction-induced colonic mucosal hypertrophy [J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 1989, 256(6): G1049—G1057
[8] Wild G E, Daly A S, Sauriol N, et al. Effect of exogenously administered polyamine on the structural maturation and enzyme ontogeny of the postnatal rat intestine [J]. Neonatology, 1993, 63(4): 246—257
[9] Peulen O, Pirlet C, Klimek M, et al. Comparison between the natural postnatal maturation and the spermine-induced maturation of the rat intestine [J]. Archives of Physiology and Biochemistry, 1998, 106(1): 46—55
[10] Péres A, Cahu C L, Zambonino Infante J L. Dietary spermine supplementation induces intestinal maturation in sea bass (Dicentrarchus labrax) larvae [J]. Fish Physiology and Biochemistry, 1997, 16(6): 479—485
[11] Crane R K, Boge G, Rigal A. Isolation of brush border membranes in vesicular form from the intestinal spiral valve of the small dogfish (Scyliorhinus canicula) [J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1979, 554(1): 264—267
[12] Maroux S, Louvard D, Barath J. The aminopeptidase from hog intestinal brush border [J]. Biochimica et Biophysica Acta (BBA)-Enzymology, 1973, 321(1): 282—295
[13] Nicholson J A, Kim Y S. A one-step L-amino acid oxidase assay for intestinal peptide hydrolase activity [J]. Analytical Biochemistry, 1975, 63(1): 110—117
[14] Sousadias M G, Smith T K. Toxicity and growth-promoting potential of spermine when fed to chicks [J]. Journal of Animal Science, 1995, 73(8): 2375-2381
[15] Liu X D, Liang M Q, Zhang L M, et al. Effect of fish protein hydrolysate levels on growth performance and biological and physiological parameters in tongue sole (Cynoglossus semilaevis Günter, 1873) [J]. Acta Hydrobiologica Sinica, 2010, 34(2): 242—249 [柳旭东, 梁萌青, 张利民, 等. 饲料中添加水解蛋白对半滑舌鳎稚鱼生长及生理生化指标的影响. 水生生物学报, 2010, 34(2): 242—249]
[16] Tong X H, Xu S H, Liu Q H, et al. Digestive enzyme activities of turbot (Scophthalmus maximus L.) during early developmental stages under culture condition [J]. Fish Physiology and Biochemistry, 2012, 38(3): 715—724
[17] Infante J L Z, Cahu C. Development and response to a diet change of some digestive enzymes in sea bass (Dicentrarchus labrax) larvae [J]. Fish Physiology and Biochemistry, 1994, 12(5): 399—408
[18] García Hernández M P, Lozano M T, Elbal M T, et al. Development of the digestive tract of sea bass (Dicentrarchus labrax L.). Light and electron microscopic studies [J]. Anatomy and Embryology, 2001, 204(1): 39—57
[19] Ortiz-Delgado J B, Darias M J, Cañavate J P, et al. Organogenesis of the digestive tract in the white seabream, Diplodus sargus [J]. Histological and Histochemical Approaches, 2003, 18(4): 1141—1154
[20] Kvåle A, Mangor-Jensen A, Moren M, et al. Development and characterisation of some intestinal enzymes in Atlantic cod (Gadus morhua L.) and Atlantic halibut (Hippoglossus hippoglossus L.) larvae [J]. Aquaculture, 2007, 264(1): 457—468
[21] Cuvier-Péres A, Kestemont P. Development of some digestive enzymes in Eurasian perch larvae Perca fluviatilis [J]. Fish Physiology and Biochemistry, 2001, 24(4): 279—285
[22] Murai T. Leucine aminopeptidase (LAP)] [J]. Rinsho Byori, 2001, 116(2): 110—116
[23] Henning S J. Functional Development of the Gastrointestinal Tract [M]. In: Johnson L R (Eds.), Physiology of the Gastrointestinal Tract. New York: Raven Press. 1987, 285—300
[24] Ji H, Sun H T, Tian J J, et al. Digestive enzyme activity during early larval development of the paddlefish Polyodon spathula [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 457—465 [吉红, 孙海涛, 田晶晶, 等. 匙吻鲟仔稚鱼消化酶发育的研究. 水生生物学报, 2012, 36(3): 457—465]
[25] Nicholson J A, McCarthy D M, Kim Y S. The responses of rat intestinal brush border and cytosol peptide hydrolase activities to variation in dietary protein content dietary regulation of intestivial peptide hydrolases [J]. Journal of Clinical Investigation, 1974, 54(4): 890—898
[26] Ribeiro L, Zambonino-Infante J L, Cahu C, et al. Development of digestive enzymes in larvae of Solea senegalensis, Kaup 1858 [J]. Aquaculture, 1999, 179(1): 465—473
[27] Suzer C, Aktülün S, Çoban D, et al. Digestive enzyme activities in larvae of sharpsnout seabream (Diplodus puntazzo) [J]. Comparative Biochemistry and PhysiologyPart A: Molecular & Integrative Physiology, 2007, 148(2): 470—477
[28] Zouiten D, Ben Khemis I, Slaheddin Masmoudi A, et al. Comparison of growth, digestive system maturation and skeletal development in sea bass larvae reared in an intensive or a mesocosm system [J]. Aquaculture Research, 2011, 42(11): 1723—1736
[29] Boglino A, Darias M J, Ortiz-Delgado J B, et al. Commercial products for Artemia enrichment affect growth performance, digestive system maturation, ossification and incidence of skeletal deformities in Senegalese sole (Solea senegalensis) larvae [J]. Aquaculture, 2012, 324(12): 290—302
[30] Peulen O, Deloyer P, Grandfils C, et al. Intestinal maturation induced by spermine in young animals [J]. Livestock Production Science, 2000, 66(2): 109—120
[31] Wang M, Hou Y Q, Ding B Y, et al. Effect of spermine on histological morphology and function of small intestine in weaned piglets [J]. Chinese Journal of Animal Nutrition, 2007, 19(4): 366—371 [王猛, 侯永清, 丁斌鹰, 等. 精胺对断奶仔猪小肠组织形态的影响. 动物营养学报, 2007, 19(4): 366—371]
THE EFFECT OF MICRODIET SUPPLEMENTATION WITH SPERMINE ON THE GROWTH AND INTESTINAL DEVELOPMENT OF TONGUE SOLE POSTLARVAE
YU Chao-Lei1,2, CHANG Qing2, QIN Bang-Yong1,2and WANG Xin-Xing2
(1. College of Fishers and Life Sciences, Shanghai Ocean University, Shanghai 201306, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
To study the effects of spermine on the intestinal development of Cynoglossus semilaevis postlarvae, we selected the subject with initial length of about 2 cm and fed them with microdiets containing 0 (F1), 0.10% (F2), 0.33% (F3) of spermine and live Artemia (F4) for 28 days. The results showed that F4 group exhibited the highest growth and survival rates. The specific growth rate of F2 group was significantly higher than that of F1 and F3 groups (P<0.05). The survival rate of F3 group was 60.27%, which was significantly lower than that of other groups (P<0.05). At day 14, the alkaline phasphatase relative activities (AP) in the bodies of fish fed with spermine-containing microdiet were significantly higher than that in fish fed with the Artemia (P<0.05); there was no significant difference among groups fed with spermine-containg mecrodiets (P>0.05). At day 28, the AP of fish fed with 0.10% spermine was significantly higher than other groups (P<0.05); no significant difference was found among other groups (P>0.05). F2 and F3 groups showed higher leucine aminopeptidase (LAP) specific activities than F1 and F4 groups at day 14 and 28 (P<0.05), but there was no significant difference between F2 and F3 (P>0.05). F2 group showed the lowest leucine-alanine peptidase (leuala) specific activity at day 14 and 28 (P<0.05). The microvilli length of Artemia group was significantly greater than that of the other groups (P<0.05). The mucosal layer of Artemia group was apparently but insignificantly hinner than that of F2 group (P>0.05). Both the length of microvilli and the thickness of the mucosal layer in F2 were greater than those of F1 and F3 groups (P<0.05). These results suggested that 0.10% spermine in microdiet had positive effects on the intestinal development of tongue sole postlarvae.
Microdiet; Spermine; Cynoglossus semilaevis; Postlarvae; Intestinal development
S965.3
A
1000-3207(2014)03-0540-08
10.7541/2014.76
2013-05-08;
2013-12-22
国家自然基金青年科学基金项目(31101913)资助
于朝磊(1987—), 男; 山东聊城人; 硕士; 主要从事海水仔稚鱼营养与个体发育的研究。E-mail: wdmmhy19871125@163.com
常青, E-mail: changqing@ysfri.ac.cn
