抗生素和紫外照射联合处理制备无菌微囊藻株
2014-03-29李建宏李文斌
李 静 李建宏 李文斌
(南京师范大学生命科学学院, 南京 210023)
抗生素和紫外照射联合处理制备无菌微囊藻株
李 静 李建宏 李文斌
(南京师范大学生命科学学院, 南京 210023)
目前我国大多数地表水体均已达到富营养化的程度,滇池、太湖等水体暴发的蓝藻水华已造成了巨大的经济损失和环境灾难[1], 其中以铜绿微囊藻(Microcystis aeruginosa)在数量和发生频率上占绝对优势[2]。由于常用微囊藻藻种附生细菌的存在, 不能准确地应用于藻类生理生化以及藻菌间相互作用, 特别是不能探索微囊藻与某一特定细菌的相互关系。另外, 由于细菌与蓝藻有较近的遗传距离, 很多从分子水平开展的研究工作, 也需要避免细菌的干扰, 因此, 获得无菌的纯培养物是许多研究的基本保证。目前对微囊藻水华的产生与水体中的各种理化因素的相互关系已有了一些研究[3], 但迄今对微囊藻水华产生的生物学机理所知有限。为在实验室控制条件下揭示微囊藻自身形成水华的机理, 亟需无菌的藻种作为研究材料。
藻种的无菌化通常可采用固体培养基平板画线、杀菌剂(抗生素、双氧水等)、离心洗涤、紫外线处理等方法[4—8]。对于一些生长繁殖迅速且对化学药物耐受性较强的藻类,传统的分离方法较易获得无菌藻株, 但对于微囊藻而言却十分困难。在实验室培养过程中, 一方面微囊藻群体丰富的细胞壁多糖很容易裹挟细菌, 这些细菌难以通过画线清除; 另一方面, 微囊藻对大多数化学药物十分敏感,杀菌的药物同样也对藻细胞也产生强烈毒害作用, 因此难以直接用于清除细菌。
为获得无菌的藻株用以深入开展微囊藻的细胞生物学研究, 本研究对一株群体微囊藻(M. aeruginosa XW01)进行了无菌化处理, 分别通过附生菌抗生素敏感性筛选, 找出了有效抑杀细菌的抗生素种类、浓度和作用时间, 并结合紫外杀菌, 最终获得了无菌的培养物。为基因测序等进一步的分子生物学研究及生理生化研究提供了有用材料。
1 材料与方法
1.1 藻种及培养条件
群体状态铜绿微囊藻M. aeruginosa XW01(以下简称XW01), 为本实验室分离培养。微藻培养液为BG11[9], 所用培养基均高压灭菌处理。
培养温度为(26±2)℃, 光照条件为30—40 μmol/(m2·s), 40 W日光灯连续光照, 培养期间每天振荡数次。
1.2 藻液中藻细胞与细菌数量的测定
藻浓度用A650测定, 细胞数量采用血球计数板计数。
培养物中细菌的浓度采用混匀平板菌落计数法计数。培养基采用LB固体培养[10], 每样3个平行, 37℃培养48h后计数。
1.3 抗生素处理法
抗生素对XW01生长的影响 选取氨苄青霉素(Amp)、卡那霉素(Km)、硫酸庆大霉素(Gm)、四环素(TE)、新霉素(N) 5种抗生素(购于上海生工生物工程有限公司)配制成10 mg/mL的母液, 使用时按需要量加入培养物。按照预实验设置各种抗生素的使用浓度分别为0、0.01、0.1、0.5、1、5 mg/L。每个浓度设置3个平行组, 以未加抗生素的为对照组。取对数生长期的藻液3 mL接种于含有不同浓度抗生素的50 mL BG11液体培养基中(100 mL锥形瓶)培养。
XW01藻液中细菌的分离鉴定 经镜检, 群体微囊藻外胶鞘上黏附大量细菌。取藻液100 μL 涂布于LB固体培养基上, 37℃培养3d, 挑取不同形态的单菌落划线纯化。通过16S rDNA基因于NCBI上比对鉴定分离的菌株[11]。
分离细菌对抗生素的敏感性实验 将分离的细菌用LB液体培养基摇菌培养, 24h后, 取50 μL菌液在LB平板上进行涂布。将分别含有5 μg/片的各含Amp、Km、Gm、TE和N滤纸片(直径5.5 mm, 购自上海生工生物工程有限公司)平贴于该平板表面在温室中培养3d, 检测抑菌圈直径。选择抑菌圈直径≥20 mm的抗生素为较敏感种类, 选为除菌药物。
抗生素除菌时间的选择 经预实验可知, 微囊藻处于对数生长期时, 其附生菌对抗生素更敏感。基于药物敏感实验的结果, 分别采用5 mg/L N、5 mg/L N+5 mg/L Gm、5 mg/L N+5 mg/L Km+5 mg/L Gm对处于对数生长期微囊藻进行无菌化处理。设置处理时间组为4、10、24、48h, 于不同处理时各取1 mL进行细菌数量检测。以初始藻液中菌数量为对照。
抗生素作用后藻的处理 将组合抗生素处理XW01后的藻液用无抗生素的BG11离心洗涕两次, 以去除抗生素的影响。取100 μL置于BG11 固体培养基上培养;同时另取藻液3 mL于50 mL BG11液体培养基中(100 mL锥形瓶)培养。待藻成活后检测是否无菌。
1.4 实验室培养藻紫外(UV)照射处理
UV光源为30 W UV灯管, 距离灯管40 cm处UV强度为1.25 μW/cm2, 通过调整照射时间控制辐射剂量。各实验组总UV照射剂量列于表1。
取 15 mL处于生长对数期的藻液, 将其倒入直径9 cm高1.8 cm的培养皿中, 使其的初始浓度一致。置于距光源40 cm处进行照射处理, 在预实验的前提下, 设计20—50min的辐射时间。在处理过程中加入电磁搅拌子进行搅拌。分别于不同照射时间, 取样分析残留细菌数量,同时培养藻样。以未经UV照射为对照。

表1 不同照射时间下的总UV辐射剂量Tab. 1 UV irradiation amount of different exposure times
1.5 抗生素结合UV照射处理
藻培养物中加入组合抗生素(5 mg/L N+5 mg/L Gm)处理, 同时分别进行5、10、20min UV照射处理。对照组加入等量的抗生素。然后置于UV灯下照射, 分别在照射5、10 和20min后取样分析细菌, 并培养藻细胞。整个操作过程中抗生素的处理时间为1h。
1.6 数据统计
实验设置1个对照组, 3个实验平行组, 取平均值作为实验结果(Mean±SD)。用Origin 8.0进行差异显著性分析, T-test检验对照组与实验组之间的差异。
2 结果
2.1 微囊藻培养过程中细菌含量的变化
在微囊藻的液体培养物中, 细菌的数量随着藻的生长而同步增加(图 1)。在藻生长对数期, 细菌的增殖也处于旺盛阶段。由于处于快速生长阶段的细菌通常对毒害条件更敏感, 因此, 采用对数生长期的藻培养物(第 6天到第10天)进行作为除菌材料应更有利。

图1 液体培养微囊藻XW01的生长曲线和培养物中细菌含量Fig. 1 The growth curve of M. aeruginosa XW01 and bacteria number in culture liquid
2.2 抗生素处理的效果
通过稀释涂布平板法培养, 从微囊藻中分离出 4株优势菌株。对其进行16S rDNA 测序比对鉴定。4株菌分别为 B1: 单胞菌(Pseudomonas sp.)、B2: 鞘氨醇单胞菌(Sphingomonas sp.)、B3: 鞘脂单胞菌(Sphingomonas sp.)、B4: 门多萨假单胞菌(Pseudomonas mendocina), 对这4株菌进行抗生素抑菌实验结果如表2。

表2 分离细菌的抗生素抑菌实验结果Tab.2 Antibiotic sensitivity of bacterial isolation
从表2的结果可见, 只有Km、Gm和N对4株菌均有抑制作用, Amp对4株菌均无作用, TE仅对B3有一定的作用。3种有明显抑菌效果的抗生素对不同的菌株抑制效果也各不相同。可见如果采用单种抗生素除菌, 很难有效除去所有细菌。因此选择了N、Km、Gm进行组合纯化微囊藻XW01。
经过预实验, 抗生素浓度为 5 mg/L较为合适, 更高的浓度容易杀死藻细胞。比较了 3个不同的抗生素组合: 5 mg/L N、5 mg/L N+5 mg/L Gm、5 mg/L N+5 mg/L Km+ 5 mg/L Gm, 处理后微囊藻细胞密度后细菌数量如图2所示。
由图2结果可见: 处理24h后, 5 mg/L N的藻液中菌落数为 15个/mL, 说明单一的 N 未能完全杀灭细菌; 5 mg/L N+5 mg/L Gm组合抗生素除菌率为100%; 但在5 mg/L N+5 mg/L Gm的基础上, 再加入5 mg/L Gm抑菌效果反而降低, 不能将藻液中的细菌完全排除。其原因可能是抗生素之间存在相互拮抗, 这与林伟利用抗生素纯化微藻结果一致[12]。延长抗生素作用时间可提高杀菌效果, 但同样也对藻细胞的活力产生伤害, 第3天藻细胞数量开始减少。经抗生素处理超过24h时, 虽然显微镜下藻细胞形态未见明显变化, 但大部分藻细胞已不能再生长繁殖, 藻细胞逐渐死亡。经5 mg/L N+5 mg/L Gm组合处理后, 经过一个月左右的培养, 藻细胞培养存活情况见表3。
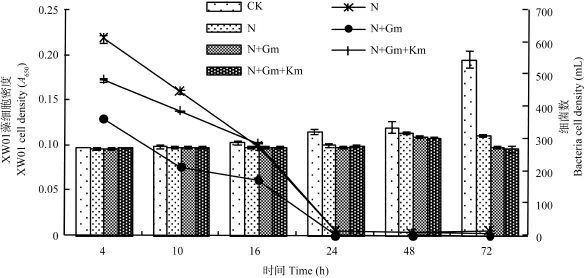
图2 不同处理时间不同组合抗生素对细菌的影响Fig. 2 The effect of different treating time and different antibiotic combinations on the amount of bacteria

表3 组合抗生素处理XW01藻细胞和细菌的生长情况Tab. 3 The survive of XW01 cell and bacteria after treatment of mixed antibiotics
经5 mg/L N+5 mg/L Gm处理24h后的藻液初步测定已无菌化。取出上层漂浮的 XW01藻细胞经过两次洗涤后, 分别接入BG11固体和液体培养基中培养。经抗生素伤害后的藻细胞长势均很缓慢, 固体培养基上一个月左右才出现单藻落, 液体培养基中 25d左右明显可见藻生长。处理48h、72h的藻液在两种培养基上均未见生长。实验过程中抗生素处理 24h后再培养的无菌藻大部分不再存活, 仅通过大量重复才获得无菌藻株。
2.3 UV辐射除菌结果
对藻液进行不同时间UV照射处理后的菌落个数见图3, 微囊藻培养物中细菌数量与UV照射处理时间成反比。

图3 不同UV照射时间藻液中细菌数量Fig. 3 The amount of bacteria under different treating times with UV radiation
在照射30min时, 除菌率已达到了99.97% (P<0.01)。但继续增加处理时间(40和50min), 除菌率则基本不再下降(差异不显著P>0.05)。UV处理30 min时, 细菌个数约122个/mL, 处理 50min时, 细菌数约 40个/mL, 但大于30 min的UV照射后藻细胞也基本全部被杀死, 难以再培养。因此, UV照射的时间不能超过30min。
2.4 抗生素结合UV照射的除菌效果
为有效获得无菌藻株, 将 UV照射和抗生素处理相结合同时处理对微囊藻进行了除菌纯化。将含有 5 mg/L N+5 mg/L Gm的藻液经不同UV照射时间处理的除菌结果见图 4: 未经 UV处理的 XW01藻液中细菌数为 844个/mL, 添加组合抗生素的藻液在UV照射5min时, 细菌数量就迅速减少到了8个/mL, 处理10min时, 藻液中细菌已完全除去。
再培养的 XW01藻细胞和细菌的生长情况见表 4:经过10min联合处理的藻液, 细菌已全部杀灭, 藻细胞依然有部分存活; 但处理 20 min的藻, 却无法再培养出藻细胞。

图4 抗生素结合UV照射除菌效果Fig. 4 The sterilization effect of mixed antibiotics combined with UV radiation
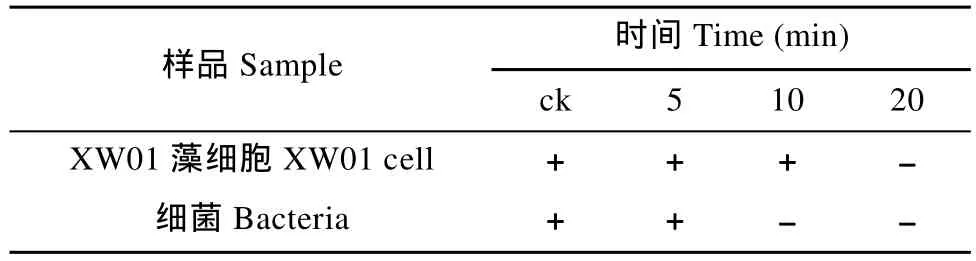
表4 抗生素-UV联合处理后再培养的XW01藻细胞和细菌的生长结果Tab. 4 The survive of XW01 cell and bacteria after treatment of mixed antibiotics combined with UV radiation
3 讨论
对于可产生气囊漂浮于水面的蓝藻, 获得无菌藻株的经典方法是通过离心洗涤去除细菌, 或(和)通过平板稀释划线获得无菌藻株, 这两种方法运用于单细胞藻是有效的, 但对于微囊藻这样很多细胞形成的群体则难以奏效。其原因可能是群体中丰富多糖裹挟的细菌, 通过简单的洗涤和稀释难以使菌藻分离。Sensen, et al.利用流式细胞仪分离出了无菌的单细胞蓝藻[13]。Makoto, et al.运用1.4%的UV低温凝胶处理一个月, 分离出了7株无菌的蓝藻[14]。Ichiro, et al.设置了20—30 μmol/(m2·s)的灯光利用藻细胞的上浮性获得无菌藻株[15]。这些方法都是利用了微藻与细菌的某些不同特征得到无菌藻株, 但这些方法单一的处理对群体的微囊藻而言并不能分离出无菌藻株。
不同的抗生素可通过不同的途径抑制细菌的繁殖,可作为藻培养物除菌的有效工具[16]。本文通过比较附生的细菌对抗生素敏感性不同, 选择5 mg/L N和5 mg/L的Gm混合加入到处于生长期的XW01藻液中可分离纯化出无菌藻株。实验发现, 组合抗生素处理藻液 24h, 除菌效果即可达到最佳状态, 处理时间越短对藻细胞活性影响越小, 这与Droop, et al.研究得一致[17]。但是本研究也发现, 仅仅采用抗生素处理的方法, 很难在清除细菌和保留微囊藻活性间找到平衡点, 这与Sakami, et al.对具毒冈比甲藻(Gambierdiscus toxicus)两个分离株生长结果相似[18]。可能是因为蓝藻(蓝细菌)与其他细菌具有类似的细胞结构和生理代谢过程, 超过藻类阈值的抗生细素浓度会对藻细胞造成伤害, 破坏藻细胞, 抑制藻细胞组成成分的形成[19]。本研究经过一年时间多次重复尝试后才获得无菌藻株。
在自然环境下, 蓝藻常常暴露在高强度的 UV辐射下, 并且拥有一套完整的自我保护机制[20]。蓝藻细胞在阳光的诱导下合成了抗氧化相关的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)、促进胞外多糖的产生并形成较大的群体[21]、并形成伪枝藻素(Scy)、类菌胞素氨基酸(MAAs)等UV屏障物质来抵抗UV的伤害[22,23], 因此, 蓝藻具有较强的抗UV能力。但绝大多数细菌的抗UV保护机制远弱于蓝藻, 在UV下更易受到伤害。这为消除蓝藻附生细菌提供了一条可用的途径。Gerloff, et al.就采用UV杀菌获得了无菌聚球藻[24], 本研究运用组合抗生素联合 UV照射方法纯化群体微囊藻, 加入5 mg/L N和5 mg/L Gm结合UV处理10min时即可无菌化XW01藻株, 藻培养存活的机率大大高于抗生素长时间处理。N和Gm都为氨基糖苷类抗生素, 主要与细菌核糖体30S亚单位结合, 抑制细菌蛋白质的合成。在加入组合抗生素后, 杀灭细菌效率大大提高, 这可能与细菌产生的一种R因子使细菌对UV辐射抗性减弱有关[25]。本研究最终获得无菌藻株结果表明, 选择合适的抗生素结合一定的UV照射是获得无菌微囊藻的有效方法。
[1] Bittencourt-Oliveira M C. Detection of potential microcystinproducing cyanobacteria in Brazilian reservoirs with a mcy B molecular maker [J]. Harmful Algae, 2003, 2: 51—60
[2] Reynolds C S. The Ecology of Fresh Water Phytoplankton [M]. Cambridge Studies in Ecology. London: Cambridge University Press. 1984
[3] Wang X, Lu X G, Zhang X L. Isolation of axenic strain of Microcystis Aeruginosa in Songhua Lake and its growth feature [J]. China Environment Science, 2004, 24(5): 579—583 [王霞, 吕宪国, 张学林. 松花湖铜绿微囊藻无菌株的分离及生长特征. 中国环境科学, 2004, 24(5): 579—583]
[4] Jiang L L, Wen X B, Geng Y H, et al. A newly selected lipid-rich microalgae strain and its molecular identification [J]. Acta Hydrobiologica Sinica, 2013, 37(4): 606—612 [江丽丽, 温小斌, 耿亚洪, 等. 一株产油微藻的筛选及分子鉴定. 水生生物学报, 2013, 37(4): 606—612]
[5] Wang B F, Zhang L X, Ye J, et al. The research development of aseptic purification technique of Microalgaes [J]. Microbiology, 2007, 34(2): 363—366 [汪本凡, 赵良侠, 叶霁, 等. 微藻无菌化技术的研究进展. 微生物学通报, 2007, 34(2): 363—366]
[6] Zhao P, Wang X Q, Zhu C F, et al. Study of three commonly antibiotics in the axenic culture of Marine-Microalgae [J]. Journal of Tianjin Normal University (Natural Science Edition), 2007, 27(2): 27—30 [赵培, 王雪青, 朱潮峰, 等. 3种常用抗生素应用于海洋微藻无菌化培养的研究. 天津师范大学学报(自然科学版), 2007, 27(2): 27—30]
[7] Gan X H, Tang X Y, Liu G J, et al. Purificaton of Spirulina sp. [J]. Microbiology, 2005, 32(2): 1—4 [甘旭华, 唐欣昀,刘广金, 等. 螺旋藻的纯化. 微生物学通报, 2005, 32(2): 1—4]
[8] Zobell J, Long C E. Studies on the isolation of bacterial-free culture of marine phytoplankton [J]. Journal of Marine Research, 1938, 1: 328—333
[9] Waterbury J B. The cyanobacteria-isolation, purification and identification [J]. Prokaryotes, 2006, 4 :1053—1073
[10] Fang X R, Li G W, Shen P. Microbiology Experiments [M]. Beijing: Higher Education Press. 1997 [范秀荣, 李广伍, 沈萍. 微生物学试验. 北京: 高等教育出版社. 1997]
[11] Su B, Kang J P, Huang J, et al. Identification of one strain of bacillus using 16S ribosomal DNA sequence [J]. Food and Fermentation Technology, 2010, 46(5): 1—3 [苏波, 康建平,黄静, 等. 16S rDNA 序列分析鉴定一株芽孢杆菌. 食品与发酵科技, 2010, 46(5): 1—3]
[12] Lin W. Axenization of several marine Microalgal cultures [J]. Marine Sciences, 2000, 24(10): 4—6 [林伟. 几种海洋微藻的无菌化培养. 海洋科学, 2000, 24(10): 4—6]
[13] Sensen C W, Heiman K, Melkonian M. The production of clonal and axenic cultures of microalgae using fluorescenceactivated cell sorting [J]. European Journal of Phycology, 1993, 28: 93—97
[14] Makoto M N, Watanabe M, Masayuki K, et al. Purification of freshwater picoplanktonic cyanobacteria by pour-plating in ultra-low-gelling-temperature agarose [J]. Phycological Research, 1998, 46(Suppl.): 71—75
[15] Imax I, Yamaguchi M. A simple technique for establishing axenic cultures of phytoflagellates [J]. Bulletin of Japanese Society of Microbial Ecology, 1994, 9: 15—17
[16] Wang H B, Cheng M, Yang Y Y, et al. The responses of algae Pavlova viridis and Karenia mikimotoi to three conventional antibiotics stress [J]. Fisheries Science, 2012, 31(6): 329—332 [王洪斌, 成明, 杨艳艳, 等. 绿色巴夫藻和米氏凯伦藻对 3种常见抗生素胁迫的响应研究. 水产科学, 2012, 31(6): 329—332]
[17] Droop M R. Marine Station, A procedure for routine purification of algalcultures with antibiotics [J]. British Phycological Bulletin, 1967, 3(2): 295—297
[18] Sinha R P, Klisch M, Gröniger A, et al. Responses of aquatic algae and cyanobacteria to solar UV-B [J]. Plant Ecology, 2001, 154: 221—236
[19] Jiang L, Chen S Y, Yin D Q. Effects of Tetracycline on photosynthesis and antioxidant enzymes of Microcystis aeruginosa [J]. Journal of Ecology and Rural Environment, 2010, 26(6): 564—567 [姜蕾, 陈书怡, 尹大强. 四环素对铜绿微囊藻光合作用和抗氧化酶活性的影响. 生态与农村环境学报, 2010, 26(6): 564—567]
[20] Sinha R P, Klisch M, Gröniger A, et al. Mycosporine-like amino acids in the marine red alga Gracilaria cornea-effects of UV and heat [J]. Environmental and Experimental Botany, 2000, 43: 33—43
[21] Wang Y, Li S S, Li J H, et al. Physiological response of Microcystis to solar UV radiation [J]. Acta Ecologica Sinica, 2011, 31(21): 6532—6539 [汪燕, 李珊珊, 李建宏, 等. 铜绿微囊藻对紫外辐射的生理代谢响应. 生态学报, 2011, 31(21): 6532—6539]
[22] Zudaire L, Roy S. Photoprotection and long-term acclimation to UV radiation in the marine diatom Thalassiosira weissflogii [J]. J Photochem Photobiol B, 2001, 62: 26—34
[23] Meckes M C. Effect of UV light disinfection on antibiotic-resistant coliforms in wastewater effluents [J]. Applied and Environmental Microbiology, 1982, 43(2): 371—377
[24] Gerloff G C, Fitzgerald G P, Skoog F. The isolation, purification, and culture of blue-green algae [J]. American Journal of Botany, 1950, 37: 216—218
[25] Marsh E B, Smith D H. R factors improving survival of Escherichia coli K-12 after ultraviolet irradiation [J]. Bacteriol, 1969, 100: 128—139
PREPARATION OF AN AXENIC MICROCYSTIS STRAIN WITH ANTIBIOTICS AND UV IRRADIATION
LI Jing, LI Jian-Hong and LI Wen-Bin
(College of Life Sciences, Nanjing Normal University, Nanjing 210023, China)
微囊藻; 无菌株; 抗生素; 紫外照射
Microcystis; Axenic strains; Antibiotic; Ultraviolet radiation
Q-33
A
1000-3207(2014)03-0592-05
10.7541/2014.84
2013-12-03;
2014-03-01
国家自然科学基金(31370217); 江苏省优势学科建设工程项目; 国家基础科学人才培养基金(J1103507)资助
李静(1988—), 女, 湖北黄冈人; 硕士研究生; 主要专业方向为藻类学。E-mail: lj5633258@163.com
李建宏(1963—), 教授; 主要研究方向为藻类学。E-mail: lijianhong@njnu.edu.cn
