体外培养大鼠心肌微血管内皮细胞缺氧模型的建立1)
2014-03-29马培泽宋宪波姜月华戴国华
马培泽,宋宪波,刘 宁,姜月华,戴国华
缺血性心脏病已成为威胁人类生命健康的主要杀手,而心肌微血管内皮细胞(CMECs)功能障碍一直是缺血性心脏病病因、发病机制及其防治研究领域中的热点[1]。在体CMECs的功能受多种因素的影响,而体外培养的CMECs能否耐受缺氧,以及缺氧对CMECs活力及凋亡的影响还未明确。本研究通过大鼠CMECs培养,建立体外缺氧CMECs模型,观察了缺氧对大鼠CMECs活力及凋亡的影响。
1 材料与方法
1.1 实验动物 健康SPF级雄性SD大鼠,山东中医药大学实验动物中心,SCXK(鲁)2011 0003,体重220 g~280 g,普通基础饲料饲喂。
1.2 主要仪器 倒置相差显微镜(德国Zeiss公司),CO2培养箱(美国Heraeus公司),三气培养箱(美国an eppendorf公司),流式细胞仪(德国BECKMAN公司),低温高速离心机(美国Thermo Scientific公司),酶联免疫检测仪(美国BIO-TEK公司)。
1.3 主要试剂 DMEM高糖培养基(美国Gibco公司),0.25%胰蛋白酶(北京Solarbio公司),胎牛血清(浙江天杭生物科技有限公司),PBS平衡液(上海碧云天生物技术有限公司),噻唑蓝(MTT,北京Solarbio公司),二甲基亚枫(DMSO,美国Amresco公司),Annexin V-FITC细胞凋亡检测试剂盒(杭州联科生物有限公司)。
1.4 实验方法
1.4.1 大鼠CMECs培养和鉴定 组织植块法[2]。选用雄性SD大鼠,10%水合氯醛0.3 m L/100 g腹腔注射麻醉,75%乙醇浸泡消毒5 min。开胸、无菌剪下心脏,置于无菌培养皿中,去除大血管、左右心房、右心室、室间隔,眼科剪剪碎约2 mm3,滴加1 mL胎牛血清,均匀接种于2个培养瓶中,置37℃、5%CO2、饱和湿度的细胞孵育箱培养4 h让组织块贴牢,追加2 m L含20%胎牛血清的DMEM高糖培养基,24 h后换液一次,培养72 h左右组织块周围有大量细胞长出,去除组织块,继续培养,3 d换液一次。免疫细胞化学SABC法检测Ⅷ因子相关抗原、CD31抗体免疫染色。胞浆中呈棕色着色,胞膜呈现黄褐色颗粒,表明培养的细胞为 CMECs[3]。
1.4.2 体外缺氧CMECs模型建立 将原代培养的CMECs进行无血清处理12 h以使细胞同步化,然后继续置于无血清培养液中,在1%O2-94%N2-5%CO2低氧气体环境中培养24 h制备低氧损伤模型。
1.4.3 实验分组 低氧气体环境中培养24 h的CMECs作为缺氧组(L组),以无血清常氧培养CMECs作为对照组(N组)。
1.4.4 倒置相差显微镜观察细胞形态 倒置相差显微镜100倍视野下观察缺氧前后CMECs形态变化及贴壁情况。
1.4.5 MTT比色法检测细胞活力 两组CMECs分别用含10%胎牛血清的培养液重悬,制成单细胞悬液,按每孔4 000个接种于2个96孔板中,每孔体积200 L,每组设6个复孔,并设置对照孔,加同等体积培养液,向每孔加入 MTT溶液(5 g/L)20 L,37℃继续孵育4 h,终止培养。吸弃孔内培养上清液,每孔加入150 L DMSO,振荡10 min,酶联免疫检测仪于490 nm波长测定吸光度。
1.4.6 流式细胞仪检测细胞凋亡 0.25%胰酶分别消化收集两组细胞,将每个样本细胞数调整为1~5×106个,1 000/min离心5 min,弃上清,PBS洗涤2次,1 000/min离心5 min,弃上清,每个样本用约500μL的1×Binding Buffer重悬细胞;每个样本中分别加入5μL的Annexin V-FITC和10μL的PI;避光摇均后黑暗中室温孵育5 min;1 h内上流式细胞仪检测分析结果,总凋亡率为早期凋亡与晚期凋亡之和。
1.4.7 统计学处理 采用SPSS 17.0软件分析。计量资料以均数±标准差±s)表示;两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠CMECs的形态观察 倒置相差显微镜下,细胞刚从组织块游离出密度较低时呈星形或多边形(见图1A),当细胞生长至亚融合状态,接近铺满培养瓶底壁时,呈短梭形并呈铺路石状生长(见图1B),在部分区域可见管腔样(见图1C)或血管网络状结构(见图1D)。表明培养的细胞具备微血管内皮细胞特征。
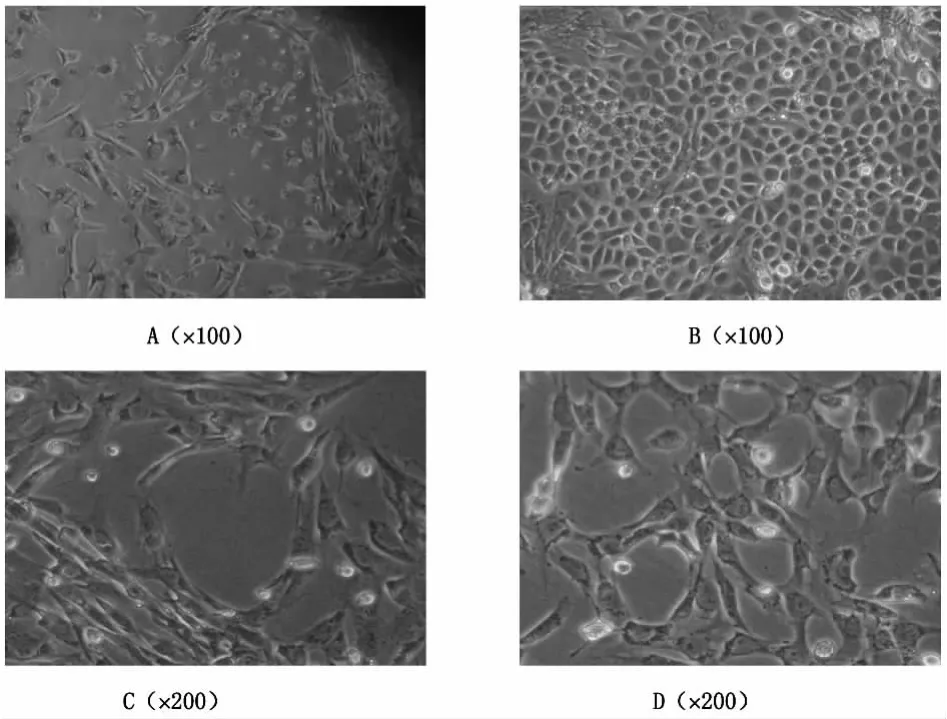
图1 CMECs形态学特征
2.2 Ⅷ因子、CD31相关抗原免疫细胞化学染色鉴定 免疫细胞化学染色显示,第Ⅷ因子相关抗原染色后,胞浆中呈棕色着色,核周染色最强(见图2A)。CD31相关抗原免疫染色后,显微镜下可见内皮细胞胞膜呈现黄褐色颗粒(见图2B),阴性对照组未显色(见图2C)。证明所培养的细胞为微血管内皮细胞。

图2 免疫细胞化学鉴定
2.3 倒置相差显微镜观察缺氧前后细胞形态 与缺氧前相比,缺氧后细胞形态未见明显改变,细胞贴壁良好,很少有漂浮细胞。
2.4 缺氧对CMECs活力的影响 L组CMECs活力(0.53±0.025),N组CMECs活力(0.46±0.055),与 N 组比较,L组CMECs活力明显增加(P<0.05)。详见表1。
2.5 缺氧对CMECs凋亡的影响 流式细胞仪检测主要将每组测试细胞群区分为四个细胞亚群:左下象限Annexin V-FITC和PI染色均为阴性(即FITC-/PI-),代表正常细胞;左上象限PI单染(即FITC-/PI+)代表坏死细胞;晚期凋亡坏死的细胞表现为右上象限Annexin V-FITC和PI染色均阳性(即FITC+/PI+);右下象限 Annexin V-FITC单染阳性(即FITC+/PI-),为早期凋亡的细胞。本实验分析的是早期凋亡、晚期凋亡和总凋亡率。与N组相比,L组总凋亡率降低(P<0.05),其中早期凋亡降低最明显(P<0.01)。详见表1,见图3。

表1 大鼠CMECs活力、细胞凋亡率(x±s) %
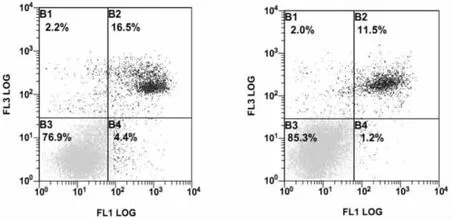
图3 流式细胞仪检测细胞凋亡
3 讨 论
随着缺血性心脏病发病率的升高,CMECs缺氧模型的体外培养也越来越受到学者的关注,但是以往的研究大多围绕CMECs缺氧复氧模型展开,单纯缺氧对CMECs的影响未见报道。本研究采用无血清培养液处理CMECs,置于三气培养箱中,制作1%O2-94%N2-5%CO2低氧气体环境,培养24 h成功制备了CMECs缺氧模型。三气培养箱能够通过控制氧气和氮气的输入量,用传感器来实现对氧含量的控制,进行O2、N2和CO2三气控制,达到供氧减少的目的。该模型控制精确,可以设定不同的缺氧程度,而且由于进气装置有过滤膜,不易污染,是目前国际公认的制作细胞缺氧模型设备[4]。
在形态学上细胞核的形态变化为凋亡最典型的特征,也是判断凋亡的最基本、最直接的指标之一[5]。对CMECs而言,形态学变化包括胞膜回缩、漂浮等表现。本研究镜下观察缺氧24 h对细胞形态没有明显影响,但是通过MTT测定细胞活力发现缺氧24 h CMECs活力明显高于常氧组,表明CMECs能够耐受短时间缺氧,这与刘健等[6]的研究结果一致,其研究发现缺氧24 h使肺动脉内皮细胞活力增加,并认为其机制可能是缺氧通过代偿引起线粒体增多,线粒体脱氢酶类活性增加所致。流式细胞仪检测结果发现,缺氧组细胞凋亡率较常氧组细胞明显降低,并且以早期凋亡减少为主。这与缺氧复氧CMECs活力及凋亡检测的研究结果相反,CMECs缺氧复氧后细胞活力降低,凋亡增加[7]。本研究结果的原因可能是缺氧后改变了CMECs增殖相关蛋白激酶和细胞凋亡相关分子的表达,从而调节其细胞活力和凋亡,而缺氧复氧对细胞的损伤较单纯缺氧更为严重。虽然本实验结果发现缺氧后CMECs活力增加,凋亡减少,但是反映其血管生成功能的增殖、迁移、成管的能力还未明确,有待进一步观察。
此外,本实验仅观察了缺氧24 h对CMECs的影响,随着缺氧时间的延长,CMECs活力及凋亡会发生怎样的变化,目前还未明确;单纯缺氧与缺氧复氧对CMECs活力及凋亡影响的区别也有待进一步研究;不同缺氧时间对CMECs增殖与凋亡相关基因和蛋白表达的影响将进一步揭示缺氧状态下CMECs增殖与凋亡的分子机制,随着一系列相关研究的开展,CMECs在缺血性心脏病中的作用将会逐渐明确,并最终为缺血性心脏病的治疗提供新的思路与方法。
[1] 陈修,陈维洲,曾贵云.心血管药理学[M].第3版.北京:人民卫生出版社,2002:192.
[2] 冯兵,何作云,王德文,等.心肌微血管内皮细胞培养及生物学特性的初步观察[J].微循环学,2000,10:19-21.
[3] 唐标,曹苏,康焕菊,等.大鼠心肌微血管内皮细胞的体外培养[J].江苏医药,2010,36:941-942.
[4] 龚敏,李树清.体外培养细胞缺氧模型及特点[J].临床合理用药,2011,4:157-158.
[5] Choi DW,Maulucci GM,Kriegstein AR,et al.Glutamate neurotoxicity in cortical cell cuhure[J].J Neurosci,1987,7:357-368.
[6] 刘健,王培勇,罗德成,等.缺氧时体外培养的肺动脉内皮细胞增殖和活力的改变[J].中国病理生理杂志,1998,14:583-586.
[7] 张彩峰,张靓,曹苏,等.缺氧-复氧损伤大鼠心肌微血管内皮细胞PI3K、Akt、HIF-1αmRNA的表达[J].江苏医药,2011,37:1748-1750.
