结肠癌合并结肠息肉73例分析
2014-03-26
结肠癌是世界上常见的恶性肿瘤之一,在我国随着饮食结构的改变,结肠癌发病率逐年上升[1]。肠息肉是结肠癌的癌前病变之一,尤其管状腺瘤、绒毛状腺瘤或者混合性腺瘤合并腺体异型增生时,其发展为结肠癌的概率极大[2]。在临床肠镜检查中,经常发现结肠癌患者肿瘤与息肉并存,尽管目前对于合并结肠癌的息肉倾向于采取积极的手术或内镜切除,但相关临床数据鲜有报道。我们对南京医科大学第一附属医院消化内镜中心近五年来的相关病例进行了总结,报道如下。
1 对象与方法
1.1 研究对象 选择江苏省人民医院消化内镜中心2009年5月至2014年5月经肠镜检查发现的结肠癌合并肠息肉的病例。所有病例肿瘤活检标本均证实为腺癌,结肠息肉标本为通过黏膜下切除(EMR)或黏膜下剥离(ESD)内镜手术所获得的全部息肉标本。所有病例均经病理学确诊,再由2名高年资病理科医师复核息肉的病理类型及不典型增生分级。内镜资料从内镜工作站所存储的文字和图片资料获得。根据肿瘤与息肉的镜下位置关系,按两者镜下距离<5 cm(癌旁),5~15 cm和>15 cm将息肉分成3组,分析不同距离与息肉病理类型与不典型增生的关系;同时分别根据息肉直径<1 cm和≥1 cm、扁平和带蒂息肉进行分组,比较组间不典型增生发生率的差异。
1.2 统计学方法 所有数据应用SPSS 17.0统计软件包进行统计分析,卡方检验分析组间发生率的差异,P<0.05为差异有统计学意义。
2 结果
2.1 结肠息肉的一般情况 经过内镜资料数据库共筛选获得73例结肠癌合并结肠息肉病例,其中男48例,女25例,年龄34~80岁,平均(62.5±10.0)岁。73例结肠癌患者中共获得具有完整病理和内镜资料的结肠息肉150枚。肿瘤与息肉以左半结肠多发,尤其在直肠和乙状结肠最为多见,具体肿瘤与息肉分布位置见表1。150枚结肠息肉中管状腺瘤44个、绒毛状腺瘤45个、混合性息肉35个、增生性息肉26个,未发现错构瘤和炎性息肉。其中存在腺体不典型增生124个(82.7%),而中至重度不典型增生或高级别上皮内瘤变达76个(50.6%)。
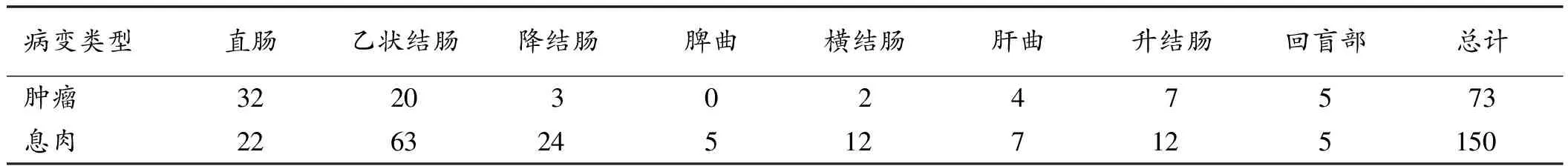
表1 73例结肠癌合并结肠息肉患者的肿瘤与息肉分布(n)
2.2 不典型增生程度与息肉与肿瘤镜下距离的关系 根据肿瘤与息肉的镜下距离不同分为3组,67.3%的息肉位于距肿瘤>15 cm组。组间比较分析发现,<5 cm组息肉不典型增生率为95.5%(21/22),5~15 cm组为74.1%,>15 cm组为81.2%,3组间比较没有统计学差异(P>0.05),见表2。
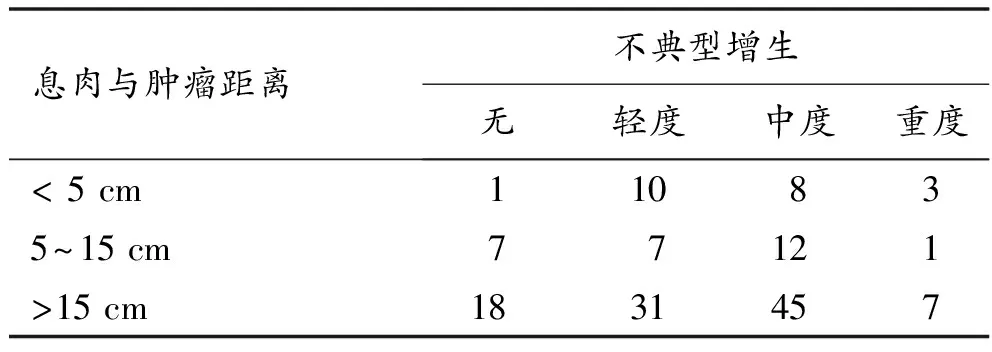
表2 肿瘤-息肉镜下距离与息肉不典型增生的关系(n)
2.3 息肉大小、形态与病理分级的关系 进一步分析息肉大小、形态与病理分级的关系发现,直径≥1 cm的息肉不典型增生发生率为100%,显著高于小息肉(直径<1.0 cm)的81.3%(P=0.024),见表3。扁平息肉与带蒂息肉(包括粗蒂和长蒂息肉)相比,带蒂息肉不典型增生发生率为88.8%(71/80),高于扁平息肉的75.7%(53/70),P=0.035。
3 讨论
结肠癌发病机制目前尚未完全阐明,临床病理学资料认为大多数结肠腺癌源于结肠息肉癌变。结肠息肉是常见病、多发病。美国多项流行病学调查发现其发病率达到7.9%~17.2%[3]。国内尚缺乏相关大样本调查数据,根据近期部分医疗单位的报道,门诊就诊患者中息肉检出率达8.86%~18.0%[4-5]。息肉的发病率随着年龄的增长而增高,美国一项研究发现,50岁前腺瘤性息肉的检出率为17%,50~59岁为35%,60~69岁为56%,>70岁为63%[6]。

表3 息肉直径与不典型增生的关系(n)
腺瘤性息肉具有较高的恶变潜能,根据病理学分为管状腺瘤、绒毛状腺瘤、混合性腺瘤(或绒毛管状腺瘤)。按照结肠腺瘤——结肠癌的序贯学说,认为存在正常结肠黏膜→管状腺瘤→绒毛管状腺瘤→绒毛腺瘤→结肠癌发展过程[7],即由管状腺瘤逐步发展至绒毛状腺瘤和恶变,但也存在管状腺瘤或绒毛管状腺瘤直接发展至腺癌的可能,这主要决定于腺上皮不典型增生的程度,中重度不典型增生的出现预示腺癌发生的速度和概率明显增大[8]。
临床中往往出现肿瘤与息肉并存的现象,一般的治疗原则是根治肿瘤的同时兼顾处理息肉。肿瘤旁息肉一般会在根治术中一并切除,远离肿瘤部位的息肉可以通过肠镜下采用直接电凝、氩气刀凝切[9]、EMR[10]或者ESD[11]等方法处理。但也有部分病例忽视了并存息肉的治疗,导致结肠癌的再发。
本研究主要收集了明确结肠癌合并结肠息肉患者的资料,为了防止息肉活检标本对息肉整体病理结果的误判,纳入研究的均为通过EMR或ESD术完整切除的息肉标本。研究数据证实,肿瘤和息肉的分布仍以左半结肠为主,这与国内外相关研究结果一致[12-13]。从病理类型而言,腺瘤性息肉占82.7%,且均伴有腺体不典型增生,其中有中重度不典型增生者占所有息肉的50.6%,这提示合并有肿瘤的息肉存在较高的恶变潜能。非腺瘤性息肉中,仅发现增生性息肉26例,均无腺体不典型增生。增生性息肉一般认为恶变概率极低,甚至具有自限性,但也有体积较大的或者侧向发育的增生性息肉出现腺体异型增生(如锯齿性腺瘤)[14]。
根据肿瘤与息肉的距离不同,我们分别对比了距离肿瘤<5 cm的癌旁息肉与>5 cm的息肉病理类型及不典型增生的程度,结果发现虽然癌旁息肉腺体的不典型增生发生率稍高于远距离息肉,但无统计学差异。这提示结肠癌合并结肠息肉时,远癌息肉的病理类型并非优于癌旁息肉。研究证实直径≥1 cm息肉中重度不典型增生的发生率要显著高于直径<1 cm的息肉,与扁平息肉相比,带蒂息肉(包括宽蒂和长蒂息肉)具有更高的腺体不典型增生发生率。
该研究给我们带来以下启示:(1)结肠癌合并结肠息肉时,结肠息肉以腺瘤性息肉多见,且存在较高的不典型增生发生率;(2)肿瘤与息肉的距离远近不能作为判断息肉病理及是否需要治疗的依据;(3)镜下息肉形态和大小对于判断病理具有辅助作用。因此这也表明对于合并肿瘤的结肠息肉需要采取更为积极的治疗措施,尤其对于较大和带蒂息肉需要尽快切除。
[参考文献]
[1] Giacosa A, Frascio F, Munizzi F. Epidemiology of colorectal polyps[J]. Tech Coloproctol, 2004,8 (Suppl 2):s243-s247.
[2] Paty PB, Cohen AM. The adenoma carcinoma sequence in colorectal neoplasia[J]. Gastroenterologist, 1993,1(4):274-286.
[3] Neugut AI, Jacobson JS, Rella VA. Prevalence and incidence of colorectal adenomas and cancer in asymptomatic persons[J]. Gastrointest Endosc Clin N Am, 1997,7(3):387-399.
[4] 韩方征. 大肠息肉606例临床分析[J]. 医学论坛杂志,2012,33(10):57-58.
[5] 唐保东,陈志娜,孙玉立. 大肠息肉824例发病情况及内镜特点分析[J]. 实用医学杂志, 2013,29(4):569-571.
[6] Diamond SJ, Enestvedt BK, Jiang Z, et al. Adenoma detection rate increases with each decade of life after 50 years of age[J]. Gastrointest Endosc, 2011,74(1):135-140.
[7] Tierney RP, Ballantyne GH, Modlin IM. The adenoma to carcinoma sequence[J]. Surg Gynecol Obstet, 1990,171(1):81-94.
[8] Bouvier AM, Manfredi S, Lejeune C. The natural history of colorectal cancer revisited[J]. Gastroenterol Clin Biol, 2002,26(5 Suppl):B56-B61.
[9] Neneman B, Gasiorowska A, Malecka-Panas E. The efficacy and safety of argon plasma coagulation (APC) in the management of polyp remnants in stomach and colon[J]. Adv Med Sci, 2006,51:88-93.
[10] Kim MN, Kang JM, Yang JI, et al. Clinical features and prognosis of early colorectal cancer treated by endoscopic mucosal resection[J]. J Gastroenterol Hepatol, 2011,26(11):1619-1625.
[11] Bialek A, Pertkiewicz J, Karpiska K,et al. Treatment of large colorectal neoplasms by endoscopic submucosal dissection: a European single-center study[J]. Eur J Gastroenterol Hepatol, 2014, 26(6):607-615.
[12] Deen KI, de Silva HJ. Colorectal polyps[J]. Ceylon Med J, 1999,44(1):6-10.
[13] Bai Y, Xu C, Zou DW, et al. Diagnostic accuracy of features predicting lower gastrointestinal malignancy: a colonoscopy database review of 10,603 Chinese patients[J]. Colorectal Dis, 2011,13(6):658-662.
[14] Qiu Y, Fu X, Zhang W, et al. Prevalence and molecular characterisation of the sessile serrated adenoma in a subset of the Chinese population[J]. J Clin Pathol, 2014,67(6):491-498.
