2A肽介导猪PID1与CuZnSOD双基因真核共表达载体的构建与细胞表达
2014-03-25李同明曾勇庆徐正刚房国锋王守栋楚青惠
张 哲, 李同明, 曾勇庆, 陈 伟, 徐正刚, 杨 云, 房国锋, 王守栋, 楚青惠
(山东农业大学动物科技学院 动物遗传育种学实验室, 山东 泰安 271018)
近年来猪肉品质受到消费者和生产者的广泛重视,生产优质高档猪肉已经成为生产者追求的目标,其中肌内脂肪含量与抗氧化性能是影响猪肉品质的重要性状。钱源等克隆猪磷酸酪氨酸互作结构域1(phosphotyrosine interaction domain containing1,PID1)基因,分析其表达与肌内脂肪的含量存在正相关[1-2]。杨伦等构建靶向小鼠RNA干扰沉默PID1基因表达载体,进一步揭示PID1基因影响猪的肌内脂肪沉积[3]。铜锌超氧化物歧化酶(CuZnSOD)是超氧化物歧化酶(SODs)的一类,能转移性的清除超氧阴离子自由基,抑制脂质氧化反应进行。2010年杜金芳等对猪CuZnSOD基因克隆表达,分析其在多种组织中表达,其表达显著提高商品猪的抗氧化性能,改善商品猪的肉质[4]。本实验室成功构建PID1和CuZnSOD真核表达载体,在真核细胞中成功表达,通过精子载体法获得的转基因兔,经性能测定肌内脂肪含量与肉质抗氧化性能显著提高[5-6]。日常屠宰后肌内脂肪含量高的猪肉极易氧化,影响了猪肉品质,而猪肉抗氧化性能的提高正好解决此问题。目前研究也着力于对PID1与CuZnSOD基因的单独研究。本研究构建PID1与CuZnSOD基因共表达载体,不仅提高了转基因效率,同时表达两种内源基因,而且在获得高肌内脂肪含量猪肉品质的同时,提高了猪肉的抗氧化性能,为进一步制备肌内脂肪显著提高并兼备高抗氧化性能的转基因猪等育种新材料奠定基础。
多基因共表达技术在生物医药和农业研究中占有重要位置,多顺反子载体构建以其表达高效而被广泛应用[7]。构建多顺反子载体常用方法:多启动子表达载体、mRNA剪接、融合基因表达、内部核糖体进入位点(IRES)、 2A剪切。其中2A肽介导的多顺反子载体已被证明是同时多基因表达的优选[8]。2A肽被称为“顺式作用水解酶元素”(CHYSEL),属小核糖核酸病毒[9]。2A肽调控“核糖体跳过”,在保守区2A脯氨酸和2B甘氨酸之间发生断裂,完成多蛋白独立表达共翻译过程[10]。目前研究已经证实2A介导多转基因的共表达可行性[11-12],其介导多因素共同诱导多能干细胞产生获得巨大成功[13-14]。在哺乳动物上已经证实2A肽介导多个外源荧光报告基因共表达,但在转与动物性状相关联的内源基因的应用研究为空白。本研究利用2A肽同时介导与肉质性状关联的内源基因PID1基因与CuZnSOD基因,在细胞水平上证实双基因蛋白表达高效独立,提高了转基因效率,为应用于转多基因育种新材料的制备在分子水平上奠定基础。
1 材料与方法
1.1 材料
莱芜猪耳组织样品,限制性内切酶、TaqDNA聚合酶、T4连接酶等分子试剂购自TaKaRa公司。DNA纯化回收试剂盒、质粒提取试剂盒购自天根生物科技有限公司。空载体pIRES2-AcGFP1(Clontech),转染试剂X-tremeGENE HP (Roche),DMEM-F12培养基、胎牛血清购自Gibco公司。大肠杆菌DH5α与PK15细胞系均由本实验室保存。
1.2 方法
1.2.1 真核表达载体构建
取100 mg莱芜猪耳组织样品使用Trizol法提取总RNA,所得RNA利用核酸蛋白测定仪进行浓度及纯度检测,采用1%琼脂糖凝胶电泳验证完整性,分装后置于超低温冰箱中-80 ℃保存。取耳组织RNA 2 μL,按PrimeScriptTM RT-PCR (TaKaRa)试剂盒进行,去除RNA样品中残留的基因组DNA,反转录反应合成cDNA。
根据NCBI基因数据库中猪PID1基因与CuZnSOD基因序列,设计合适的引物。2A肽接头经上海生工合成并克隆于PUC57载体上。2A序列: CCGGAATTCGGCAGTGGAGAGGGCA GAGGAAGTCTGCTAACATGCGGTGACGTCGAGGAGAATCCTGGCCCAGTCGAC。PCR扩增体系:PID1/CuZnSOD1 μL,10×Taq Buffer 2 μL,dNTPs (2.5 mmol/L) 4 μL,DNA聚合酶0.5 μL,P1/P2,S1/S2 (10 μmol/mL) 1 μL,灭菌双蒸水15.5 μL。反应条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环,72 ℃补延伸10 min。
PCR产物经DNA纯化试剂盒纯化,用BglII/EcoR I双酶切CuZnSOD,并同时酶切空载体pIRES2-acGFP1,对酶切产物进行纯化回收后用T4连接酶连接。将连接产物转化到大肠杆菌里,用卡那抗性的培养平板均匀涂板,37℃恒温培养进行抗性筛选。提取阳性克隆质粒,利用酶切与测序鉴定得到质粒pIRES2-CuZnSOD。用SalI/HindIII双酶切P1/P2扩增的PID1产物,亚克隆至质粒PUC57-2A,克隆转化得到质粒PUC57-2A-PID1。质粒PUC57-2A-PID1经EcoR I/SacII双酶切,纯化回收片段2A-PID1,克隆入质粒pIRES2-CuZnSOD中,转化后得到pIRES2-CuZnSOD-PID1载体。

表1 CuZnSOD基因与PID1基因引物设计
1.2.2 PK15细胞培养与转染
PK15细胞用完全培养液(DMEM-F12+10% FBS),在37 ℃,5% CO2恒温培养箱培养。将处于对数生长期的细胞以1×105密度接种于6孔板,待细胞生长至70%~90%密度后进行细胞转染。将构建pIRES2-CuZnSOD-PID1载体、空载体转染到细胞中,每组设3个重复。每孔按0.8 μg质粒、 2 μL脂质体加样。培养48 h后,观察荧光拍照后收集细胞。
1.2.3 Real-time PCR检测mRNA表达
向每孔细胞中加入1 mL Trizol提取总RNA,测定其浓度与纯度,按PrimeScriptTM RT-PCR Kit (TaKaRa)说明书合成cDNA。采用SYBR Green染料法,以GAPDH为内参基因,分析PID1基因与CuZnSOD基因表达量。反应体系为:P3/P4,S3/S4 (10 μmol/mL)各0.5 μL,2 μL cDNA,12.5 μL SYBR Green,0.5 μL Plus Solution,补ddH2O至25 μL。反应条件:95 ℃预变性30 s,95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸20 s,35个循环,最后72 ℃延伸10 min。检测每个待测样品设置3个重复, 2-△△t的方法计算基因的表达水平。
1.2.4 Western blot检测蛋白表达
将构建pIRES2-CuZnSOD-PID1载体、空载体转染至细胞中,每组设3个重复,以转染空载体细胞为阴性对照,未转染的细胞为空白对照。收集转染48 h细胞至1.5 mL离心管中,加入细胞裂解液,收集细胞总蛋白。再进行电泳分离、转膜、封闭、I抗及II抗孵育后,曝光洗片,用Image J软件分析灰度值[6],应用统计软件分析蛋白表达量。
1.2.5 数据分析
各组表达数据表示为平均值±标准误,计算各基因相对表达量,应用SAS 8.2软件统计分析,以P<0.05为差异具有显著性。
2 结果与分析
2.1 PCR扩增PID1基因与CuZnSOD基因结果
以合成的cDNA为模板,扩增PID1基因与CuZnSOD基因编码区,大小分别为654 bp与462 bp,经琼脂糖凝胶电泳分析,PCR产物条带大小与预期相同且无杂带,如图1所示。
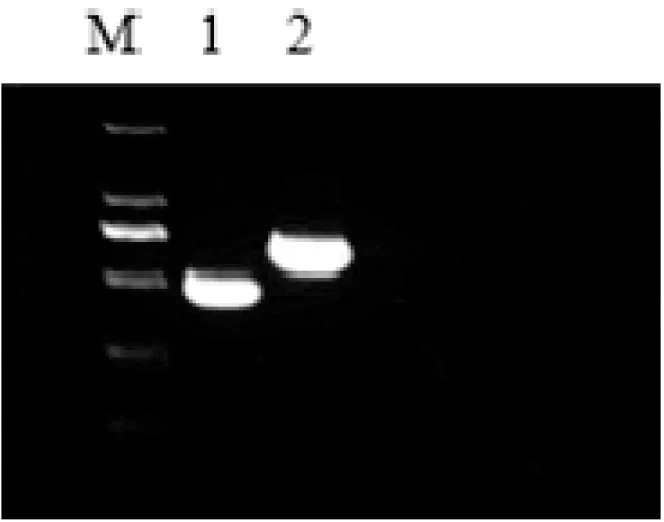
图1 PCR扩增PID1基因与CuZnSOD基因CDS区
M—2000 bp; 1—CuZnSOD; 2—PID1。
2.2 载体pIRES2-CuZnSOD-PID1构建
构建的pIRES2-CuZnSOD-PID1载体分别经BglII/EcoR I、SalI/SacII双酶切,酶切产物经琼脂糖凝胶电泳显示,片段大小与PID1基因与CuZnSOD基因相一致,如图2所示。对酶切鉴定正确的重组载体,进行克隆转化测序。测序结果证实插入的基因碱基序列与GenBank中的PID1、CuZnSOD、2A序列完全一致,表明重组表达载体构建成功。构建成功的pIRES2-CuZnSOD-PID1重组质粒图谱如图3所示。
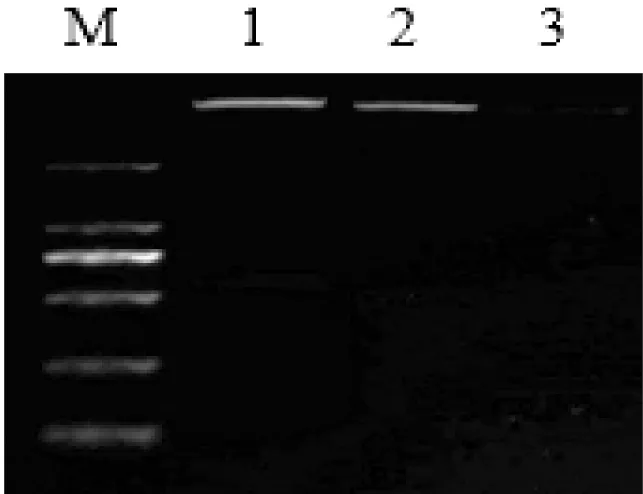
图2 重组载体pIRES2-CuZnSOD-PID1酶切鉴定结果
M—2000 bp; 1—双酶切产物PID1; 2—双酶切产物CuZnSOD; 3—单酶切产物。

图3 构建成功的重组质粒简图
2.3 重组质粒转染PK15细胞
将重组质粒按X-tremeGENE HP说明书转染至PK15细胞,培养48 h后使用倒置荧光显微镜观察并拍照。如图4所示,pIRES2-CuZnSOD-PID1载体所携带的荧光蛋白基因在细胞内高效表达,其中(a)为转染前在普通显微镜下拍到细胞照片;(b)为荧光显微镜下拍到荧光出现。
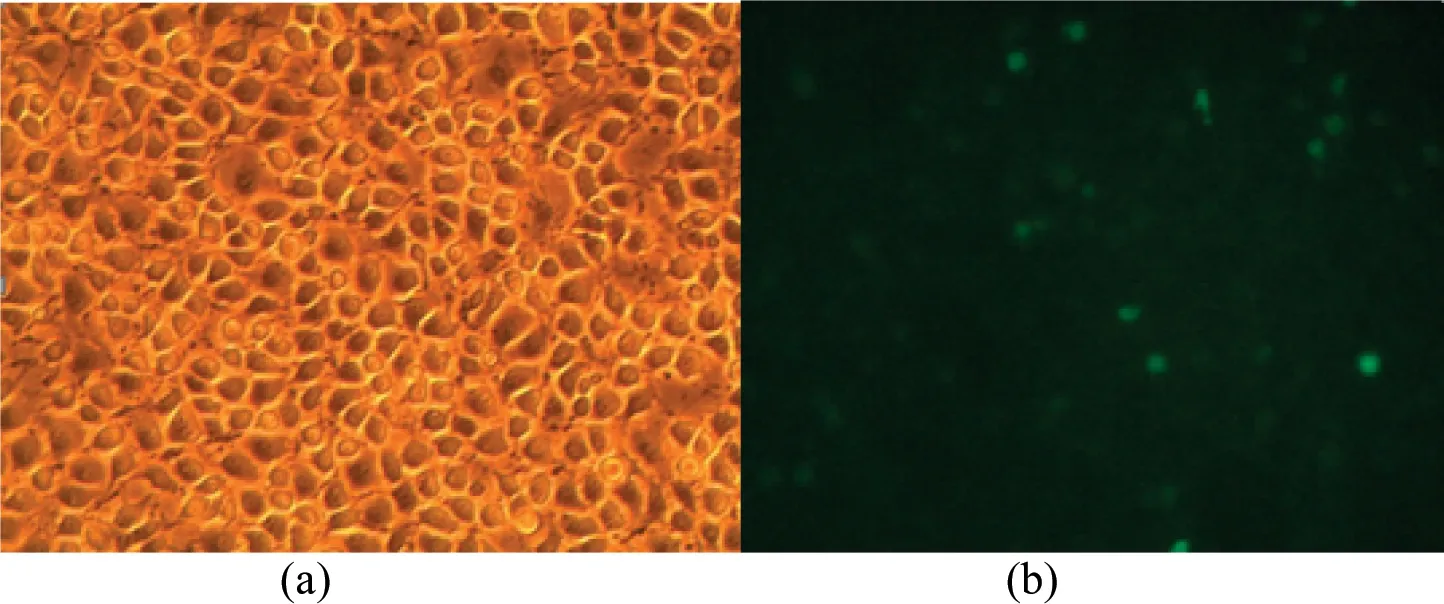
图4 质粒pIRES2-CuZnSOD-PID1在PK15细胞中表达
2.4 转染重组质粒细胞CuZnSOD基因与PID1基因定量表达
2.4.1 重组载体中CuZnSOD基因的表达
定量结果显示(图5),载体转染对CuZnSOD基因的表达量的差异显著,具体表现为pIRES2-CuZnSOD-PID1载体>空白细胞>pIRES2-AcGFP1空载体。其中转染pIRES2-CuZnSOD-PID1载体的CuZnSOD基因表达量(1.995±0.012),明显高于阴性对照组(0.937±0.037)与空白组(0.952±0.039),差异显著(P<0.05)。

图5 转染质粒48 h后CuZnSOD基因的mRNA表达量Fig 5 The mRNA levels of CuZnSOD gene of vectors transfected after 48 h
1—pIRES2-CuZnSOD-PID1; 2—pIRES2-AcGFP1; 3—空白。
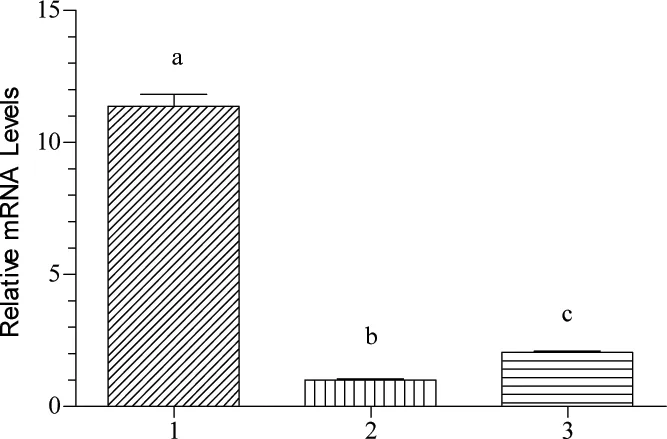
图6 转染质粒48 h后PID1基因的mRNA表达量Fig 6 The mRNA levels of PID1 gene of vectors transfected after 48 h
1—pIRES2-CuZnSOD-PID1; 2—pIRES2-AcGFP1; 3—空白。
2.4.2 重组载体中PID1基因的表达
定量结果显示(图6),载体转染对PID1基因的表达量差异显著,具体表现为pIRES2-CuZnSOD-PID1载体>空白细胞> pIRES2-AcGFP1空载体。其中转染pIRES2-CuZnSOD-PID1载体的PID1基因表达量(11.382±0.424)明显高于阴性对照组(1.002±0.046)与空白组(2.039±0.049),差异显著(P<0.05)。
2.5 转染重组质粒细胞CuZnSOD蛋白与PID1蛋白表达
重组质粒转染PK15细胞48 h后,Western blot检测CuZnSOD蛋白与PID1蛋白表达量(图7),用Image J软件分析比较条带灰度值发现,阳性组的CuZnSOD蛋白与PID1蛋白表达量较阴性组和空白对照组有显著提高(P<0.05),见图8和图9,结果表明CuZnSOD蛋白与PID1蛋白得到稳定有效表达。

图7 转染质粒48 h后CuZnSOD蛋白与PID1蛋白表达情况
1—pIRES2-CuZnSOD-PID1; 2—pIRES2-AcGFP1; 3—空白。

图8 CuZnSOD蛋白的表达水平Fig 8 Expression levels of CuZnSOD protein
1—pIRES2-CuZnSOD-PID1; 2—pIRES2-AcGFP1; 3—空白。

图9 PID1蛋白的表达水平Fig 9 Expression levels of PID1 protein
1—pIRES2-CuZnSOD-PID1; 2—pIRES2-AcGFP1; 3—空白。
3 讨论
猪肌内脂肪(IMF)是影响猪肉品质重要的性状之一,它是由多基因控制的性状。研究发现,PID1基因表达与脂类代谢相关,且与肌内脂肪含量存在正相关,提示PID1基因影响肌内脂肪沉积表达[1-2]。张春梅[15]等研究发现,PID1基因过表达通过下调胰岛素刺激的GLUT4的转位而减少脂肪细胞的葡萄糖摄取率,降低对胰岛素的敏感性,调节脂肪代谢。石元[16]等通过构建双荧光素酶报告基因重组载体,分析CuZnSOD核心启动子区的活性,揭示CuZnSOD影响抗氧化性能。因此,在控制瘦肉率与背膘厚的条件下,PID1基因表达提高肉质风味,同时CuZnSOD基因表达提高抗氧化水平,为生产优质猪肉提供思路,为获得分子育种材料提供分子依据。本研究成功构建PID1与CuZnSOD共表达载体,独立表达两基因,对于同时提高猪肌内脂肪含量和抗氧化性能,提高猪肉品质具有重要意义。
IRES是在单启动子的控制下,实现多基因独立共表达的常用方法[17]。然而,IRES因自身序列较大以及前后连接基因表达不平衡而存在缺陷[18-19]。2A肽自身具有裂解活性,平均长度短,而且相对平衡了上下游基因的表达,成为IRES介导表达很好的替代。有报道称,增强型绿色荧光的表达蛋白(EGFP)在MGMT-2A-EGFP双顺反子载体比在IRES介导表达高约3倍[20]。2A肽介导共表达技术表现出广泛的应用前景。Trichas等利用2A肽介导获得红色与绿色荧光蛋白共表达的转基因小鼠,介导的基因已整合到染色体并获得稳定遗传[21]。本研究利用2A肽高效共表达,构建内源双基因共表达模型,构建的真核双表达载体pIRES2-CuZnSOD-PID1在PK15细胞上验证PID1基因与CuZnSOD基因分别稳定有效表达。在细胞水平上证明2A肽介导PID1与CuZnSOD基因共表达载体成功构建,能够完成哺乳动物内源双基因共翻译过程。
本文通过2A肽构建PID1与CuZnSOD内源双基因载体,验证在PK15真核细胞中重组载体成功独立表达,研究结果在细胞水平上证实内源双基因共表达,为同时表达PID1与CuZnSOD基因,改善肉质性状提供方法支持,为进一步制备肌内脂肪显著提高并兼备高抗氧化性能的转基因猪等育种新材料奠定分子基础。
参考文献:
[1]钱 源, 曾勇庆, 杜金芳, 等. 猪PID1基因CDS区的克隆及其mRNA表达与肌内脂肪沉积关系[J]. 遗传, 2010, 32(11): 1153-1158.
[2]钱 源, 曾勇庆, 崔景香, 等. 莱芜猪PID1基因的功能分析及表达谱研究[J]. 畜牧兽医学报, 2011, 42(5): 621-628.
[3]杨 伦, 徐正刚, 王 慧, 等. RNA干扰沉默PID1基因在C2C12细胞中表达的研究[J]. 山东大学学报:理学版, 2013, 48(1): 36-42.
[4]杜金芳, 曾勇庆, 陈 伟, 等. 猪CuZnSOD基因的克隆、表达及功能分析[J]. 遗传, 2010, 32(10): 1037-1042.
[5]石 元. 猪CuZnSOD基因核心启动子鉴定及精子介导法制备CuZnSOD转基因肉兔的研究[D]. 泰安:山东农业大学, 2013.
[6]祝洪磊. 睾丸注射法制备携带猪PID1基因的转基因兔的研究[D]. 泰安:山东农业大学, 2013.
[7]孙全喜. 多基因植物表达载体构建方法的研究[D]. 泰安:山东农业大学, 2008.
[8]Tang W, Ehrlich I, Wolff S B, et al. Faithful expression of multiple proteins via 2A-peptide self-processing: a versatile and reliable method for manipulating brain circuits[J]. J Neurosci, 2009, 29: 8621-8629.
[9]Ryan M D, King A M, Thomas G P. Cleavage of foot-and-mouth disease virus polyprotein is mediated by residues located within a 19 amino acid sequence[J]. J Gen Virol, 1991, 72: 2727-2732.
[10]Ryan M D, Drew J. Foot-and-mouth disease virus 2A oligopeptide mediated cleavage of an artificial polyprotein[J]. EMBO J, 1994, 13: 928-933.
[11]Furler S, Paterna J C, Weibel M, et al. Recombinant AAV vectors containing the foot and mouth disease virus 2A sequence confer efficient bicistronic gene expression in cultured cells and rat substantia nigra neurons[J]. Gene Ther, 2001, 8: 864-873.
[12]Klump H, Schiedlmeier B, Vogt B, et al. Retroviral vector-mediated expression of HoxB4 in hemato poietic cells using a novel co-expression strategy[J]. Gene Ther, 2001, 8: 811-817.
[13]Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors[J]. Science, 2008, 322: 949-953.
[14]Carey B W, Markoulaki S, Hanna J, et al. Reprogramming of murine and human somatic cells using a single polycistronic vector[J]. Proc Natl Acad Sci USA, 2009, 106: 157-162.
[15]张春梅, 邱 洁, 陈小慧, 等. NYGGF4基因过表达对脂肪细胞胰岛素敏感性及分泌功能的影响[J]. 中国当代儿科杂志, 2009, 11(10): 846-849.
[16]石 元, 陈 伟, 曾勇庆, 等. 猪CuZnSOD基因启动子的克隆鉴定及分析[J]. 生物工程学报, 2014, 30(2): 213-222.
[17]Pelletier J, Sonenberg N. Internal initiation of translation of eukaryotic mRNA directed by a sequence derived from poliovirus RNA[J]. Nature, 1988, 334(6180): 320-325.
[18]Mizuguchi H, Xu Z, Ishii-Watabe A, et al. IRES-dependent second gene expression is significantly lower than cap-dependent first gene expression in a bicistronic vector[J]. Mol Ther, 2000, 1: 376-382.
[19]Zhou Y, Aran J, Gottesman M M, et al. Co-expression of human adenosine deaminase and multidrug resistance using a bicistronic retroviral vector[J]. Gene Ther, 1998, 9: 287-293.
[20]Chinnasamy D, Milsom M D, Shaffer J, et al. Multicistronic lentiviral vectors containing the FMDV 2A cleavage factor demonstrate robust expression of encoded genes at limiting MOI[J]. Virol J, 2006, 3:14.
[21]Trichas G, Begbie J, Srinivas S. Use of the viral 2A peptide for bicistronic expression in transgenic mice[J]. BMC Biol, 2008, 6: 1-13.
