2种小球藻在鱼糜加工废水处理过程中的生长和油脂积累规律
2014-03-25陆海波胡慧慧徐年军
陆海波, 胡慧慧, 徐年军, 孙 雪
(宁波大学 海洋学院 教育部应用海洋生物技术重点实验室, 浙江 宁波 315211)
随着社会经济的迅猛发展,在能源过度消耗的同时也间接地造成了许多环境问题,世界原油和天然气储量据推测分别在40年和64年后消耗完[3]。因此,进行新型能源研究具有长远的意义。利用微藻生产生物能源具有可再生、可降解、同时吸收空气中CO2等优点,倍受人们的青睐[4]。但是微藻培养过程中要消耗大量的淡水,投入大量氮磷等营养成分[5],这些导致的高培养成本占到生物柴油生产总成本的70%以上,是目前微藻培养领域的世界性难题[6]。
小球藻(Chlorella)是一种可工厂化培养的微藻,它不但可以去除水体中的氮磷等物质,还可以净化水质,因为小球藻的快速生长需要消耗大量的氮磷等物质,用富含氮磷的水来大规模培养小球藻在很大程度上可以减少对淡水的消耗,减少培养基中无机盐的用量等,从而减少培养成本。目前关于利用工业废水养殖微藻的相关研究比较多,但利用微藻养殖清除水产品加工废水的研究未见报道。本文研究了2种小球藻在鱼糜加工废水中的生长和油脂变化规律。
1 材料与方法
1.1 藻种与培养
实验中所用蛋白核小球藻(C.pyrenoidsa)F-9由本实验室分离获得;普通小球藻(C.vulgaris)HYS-2从中国科学院海洋研究所购买。鱼糜加工废水取自宁波飞日水产实业有限公司,为鱼糜加工过程产生的废水,未经过化学处理。目前该工艺产生的废水主要是氮磷营养超标,其中硝氮浓度为9.65 mg/L, 氨氮浓度为40.22 mg/L,磷浓度为7.50 mg/L。对照组为f/2培养基[7],其硝氮浓度为12.71 mg/L,磷浓度为1.21 mg/L,氨氮未添加。
实验前先用f/2培养基对小球藻进行为期7 d的培养,分别接种到f/2培养基和鱼糜加工废水中。实验在光照培养箱中进行,500 mL三角瓶自养培养,培养箱温度25℃,光照强度60 μmol/s,光照比12 h∶12 h,整个实验过程严格执行无菌操作。为防止藻细胞附壁或下沉,每隔2 h摇瓶1次,实验进行15 d,每2 d取藻液1次,离心收集藻体,测定水体中氮磷含量。
1.2 方法
1.2.1 生长速率测定
每次取50 mL藻液,8000 r/min离心并冷冻干燥后对离心管进行称重,小球藻生长速率用离心管前后重量之差表示。
1.2.2总脂含量测定
总脂含量测定采用香草醛比色法[8]。取2 mg小球藻粉,加3 mL CHCl3∶CH3OH 2∶1(v/v)混合溶液进行抽提。之后加蒸馏水1 mL,剧烈振荡后离心分层,下层氯仿层为总脂提取液。藻粉残渣重提1次,合并2次提取液。取0.1 mL提取液加入0.5 mL浓硫酸,混合均匀,沸水浴10 min,冷却,加入1.978 mg/mL香草醛磷酸试剂2.5 mL,均匀混合,反应2 h,测定OD528。
1.2.3 小球藻脂肪酸分析方法
脂肪酸提取参照文献[9]。取藻粉5 mg放入密闭玻璃试管中,加入50 μL的19∶0内标(0.3 μg/mL)与1 mL饱和氢氧化钾-甲醇溶液,充氮气,75 ℃水浴皂化10 min。冷却,随即加入2 mL的盐酸-甲醇溶液(1 mol/L),使溶液体系pH值<2.0,混匀,75 ℃水浴10 min,冷却,分别加入1 mL石油醚和蒸馏水,振荡,8000 r/min离心5 min,上层石油醚经干燥后氮气吹干,色谱纯正己烷定容后上GC-MS进行分析(日本Shimadzu GC-MS QP2010),色谱及MS条件参照文献[10]。
1.2.4 氨氮、硝氮和磷酸盐含量的测定
小球藻藻液离心,收集上清液,采用EasyChem全自动间断化学分析仪(意大利Systea)进行氨氮、硝氮和磷酸盐含量的测定。氨氮、硝氮和磷酸盐含量分别采用酚盐自动比色法、镉柱还原自动比色法、抗坏血酸自动比色法进行测定,依照公式:Ei=(C0-Ci)/C0×100%(C0为起始浓度,Ci为最终浓度)计算水体中氨氮、硝氮和磷酸盐的去除效率。
1.2.5 数据统计分析
采用SPSS18.0软件对数据的差异显著性进行分析,其中P<0.05为差异显著,P<0.01为差异极显著。所有实验进行3个平行样,采用Office 2003中的Excel软件进行平均值和方差分析作图。
2 结果与分析
2.1 鱼糜加工废水和f/2培养基对2种小球藻细胞干重的影响

图1 鱼糜加工废水和f/2培养基对2种小球藻细胞干重的影响
由图1可见,2种小球藻在鱼糜加工废水中的生长速率远大于f/2培养基,差异极显著(P<0.001)。F-9和HYS-2的相对生长速率分别为0.366和0.417,生物量积累达0.293 g/L和0.276 g/L。在f/2培养基中,2种小球藻的生长情况与工业废水中相类似,但生物量大约为鱼糜加工废水中的0.4~0.6倍,到第15天时,生物量分别达到了0.122 g/L和0.17 g/L。2种小球藻在不同培养基中的生长速度也表现出较大的差异,F-9在鱼糜加工废水中相对生长速率比HYS-2大,但在f/2培养基中比HYS-2生长慢。
2.2 鱼糜加工废水和f/2培养基对2种小球藻油脂积累的影响
由图2可见,F-9在鱼糜加工废水和f/2培养基中培养,实验中前5天由于小球藻生长速度较快,油脂含量呈下降趋势,到第11天时油脂含量开始迅速上升,到第13天时油脂含量达到最大值,此时油脂含量分别占细胞干重的17.87%和20.05%。HYS-2的油脂变化规律,前5天与F-9相一致,到第5天时油脂含量开始增加,第7天时油脂积累速度加快,在第11天时达到最大值。HYS-2在鱼糜加工废水和f/2培养基中的油脂分别占小球藻细胞干重的28.49%和36.22%。小球藻HYS-2在鱼糜加工废水和f/2培养基中的油脂含量显著高于F-9培养基(P<0.05),且油脂含量在11 d达到最高。

图2 鱼糜加工废水和f/2培养基对小球藻F-9(a)和HYS-2(b)油脂积累的影响Fig 2 The effects of surimi processing wastewater and f/2 medium on the lipid accumulation of Chlorella of F-9(a) and HYS-2(b)
2.3 鱼糜加工废水和f/2培养基对2种小球藻脂肪酸含量的影响
小球藻F-9和HYS-2在鱼糜加工废水和f/2培养基中培养15 d后的脂肪酸变化情况如表1所示。实验结果表明,小球藻F-9在实验第1天的总脂肪酸含量占干重的10.46%,其中主要是C16∶0、C18∶2和C18∶3 3种脂肪酸,含量为8.44%。培养15 d后,2种培养基中小球藻脂肪酸含量都呈下降态势,其f/2培养基中脂肪酸含量下降幅度比较小,总脂肪酸含量占干重的8.04%,3种脂肪酸C16∶0、C18∶2和C18∶3的含量也降低不少,从第1天的4.38%、1.90%和2.16%分别下降到2.80%、1.41%和1.27%,不过增加了脂肪酸C16∶3,含量为0.92%。鱼糜加工废水和f/2培养基中小球藻脂肪酸变化趋势大致相同,只不过小球藻在鱼糜加工废水中增加了C16∶1和C16∶3 2种脂肪酸,其含量分别达到了0.14%和0.75%。
小球藻HYS-2在培养15 d后脂肪酸含量也发生了较大变化。在鱼糜加工废水和f/2培养基中,脂肪酸总量由第1天的16.24%分别下降至9.03%和14.18%。脂肪酸类型主要由C16∶0、C16∶1、C18∶1和C20∶5,其中C20∶5含量分别由第1天的1.70%上升至2.42%和2.28%。脂肪酸是总脂质量的重要指标,2种小球藻中总脂肪酸含量虽然不同,但在培养过程中均有下降,在鱼糜加工废水中下降幅度较大,可能是由于小球藻处于旺盛生长期,脂肪酸含量下降。
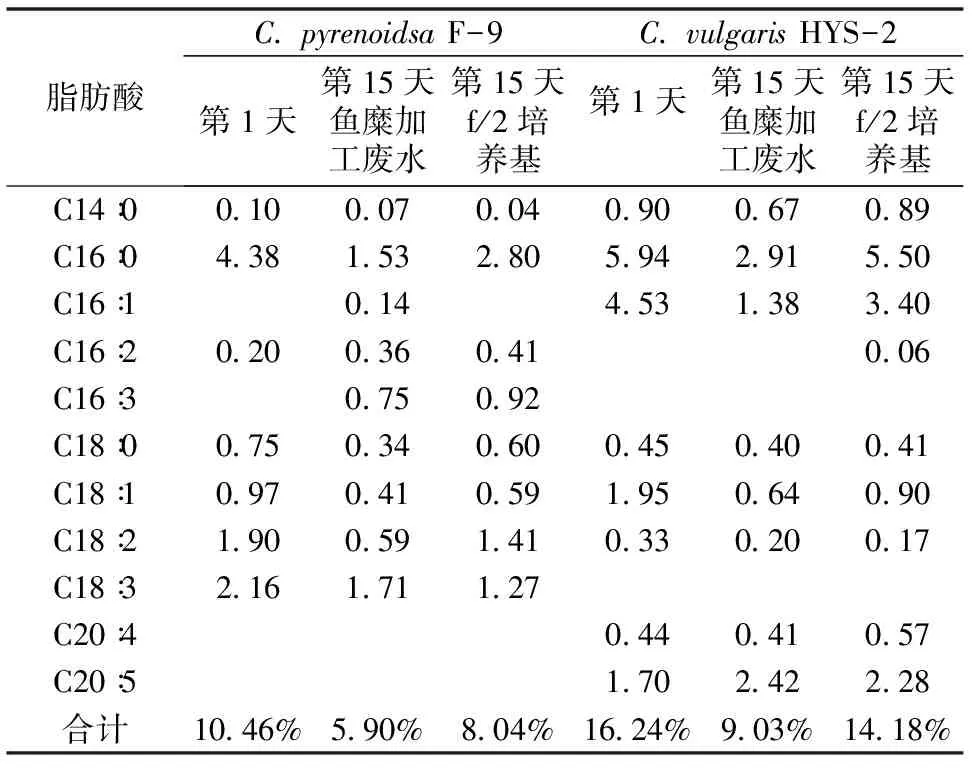
表1鱼糜加工废水和f/2培养基中2种小球藻的脂肪酸含量(细胞干重%)Table 1 The fatty acid composition of two species of Chlorella in surimi processing wastewater and f/2 medium(dry weight%)
2.4 2种小球藻对氮磷的去除作用

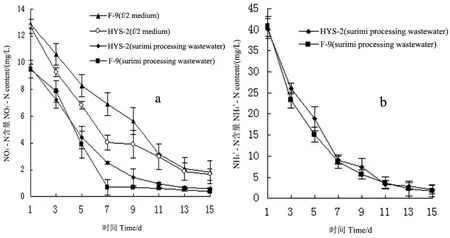
图3 2种小球藻对鱼糜加工废水和f/2培养基中和的去除作用Fig 3 The removal effect of (a) and (b) in surimi processing wastewater and f/2 medium by two species of Chlorella
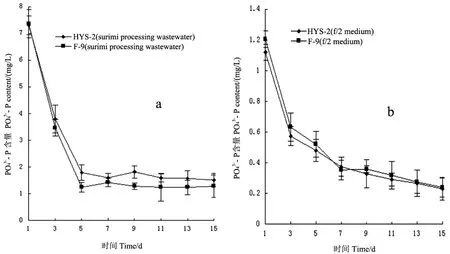
图4 2种小球藻对鱼糜加工废水(a)和f/2培养基(b)中的去除效果Fig 4 The effect of two species of Chlorella on the removal in surimi processing wastewater(a)and f/2 medium(b)
3 讨论
水资源和能源问题是两个重要的社会环境经济问题,地球水资源的短缺和富营养化是制约人类社会发展的一大瓶颈,污水再利用已成为当今世界研究的热点。许多工业废水均含有大量的氮、磷元素,可以满足微藻培养过程中所需要的营养[11]。所以利用工业废水进行微藻培养可以有效地解决培养成本过高的问题。
研究表明,工业废水是一种很好的微藻替代培养基。Cho等[12]用市政污水处理厂的废水进行微藻培养,结果利用厌氧消化罐AD:污泥浓缩罐和脱水设施CR (10∶90,v/v)组合废水可以得到最高的生物量(3.01 g/L),是BG-11培养基的1.72倍,同时用初级沉淀池出水(PS)培养细胞易于从培养物中分离,且可以提高细胞的油酸等油脂含量。周连宁等[13]发现豆制品废水很适合小球藻的培养,在利用豆制品废水进行小球藻培养过程中,只需适量添加镁、氮和磷元素。不同来源的工业废水其成分不同,有的含有大量的有机质,微藻可以进行兼性生长,而不同处理阶段的工业废水的成分也不同。本实验中鱼糜工业废水是工厂通过简单的物理方法处理的污水,主要是氮磷等营养成分超标。
微藻在工业废水中养殖具有较高的生长速率和细胞浓度。Yang等[14]利用木薯制乙醇的废水培养蛋白核小球藻,培养末期,细胞干重达到了3.73 g/L。Zhou等[15]用浓缩市政废水培养经过兼性异养微藻,结果这些藻株有最高生长率(0.455~0.498/d)和油脂产率(74.5~77.8 mg/L·d)。曲春波等[16]用啤酒废水对小球藻进行异养培养,结果利用由废水配制含10 g/L葡萄糖的基本培养液培养蛋白核小球藻15-2070获得了5.3 g/L藻细胞。吕素娟等[17]在气泡柱式光反应器中培养栅藻,结果在优化的生活废水培养基(仅补充无机氮、磷、柠檬酸铁铵以及微量元素)中微藻细胞浓度可达8.0 g/L左右,远高于BG-11培养基5.0 g/L的水平。本实验中直接利用鱼糜加工排放的工业废水养殖2种小球藻,结果发现,小球藻在未添加其它营养源的废水中比在f/2培养基中生长快,而且生物量分别达到了0.293 g/L和0.276 g/L,并且是f/2培养基培养条件下的2.4倍和1.6倍,但比文献中报告的添加其它营养液、或兼性培养条件下的最终细胞浓度低。分析其可能原因是工业废水中氮磷营养比较丰富,但营养不均衡,特别是缺乏微量元素等。
微藻在工业废水中养殖具有较快的生长和油脂积累。Woertz等[18]发现在奶制品废水中,废水浓度的不同影响着微藻的含油量(14~29%),其中最大生产量可达到17 mg/(L·d)。Kothari等[19]用乳制品废水对衣藻Chlamydomonaspolypyrenoideum进行培养,结果乳制品废水比BG-11培养基更适合微藻生长,在乳制品废水中培养到第10天和第15天的微藻油脂含量分别为1.6 g和1.2 g,而BG-11培养基中微藻油脂含量分别为1.27 g和1.0 g,其对废水中的硝氮、氨氮和磷的去除率分别为90%,74%和70%。Farooq等[20]发现在单一的光合自养条件下,野生型小球藻的最大生物量和油脂含量分别是1.5 g/L和18%,而通过光合自养和光合异养这两个阶段,生物量可增加到了3.5 g/L,油脂生产力从31.1 mg/(L·d)增加到了108.0 mg/(L·d)。曹海等[21]发现在未经处理的啤酒废水中添加KNO3、MgSO4和Na2HPO4,调整pH值至8.0的改良培养基更加适于培养小球藻,在此培养基中小球藻细胞浓度达0.948 g/L,为对照组的2.69倍;油脂产率达11.84 mg/(L·d),为对照组的1.97倍。刘建强等[22]用市政污水培养普通小球藻,结果小球藻的生长率在培养8 d后达到最大,OD680为2.856,日均最大积累速率为0.01 g/L,油脂含量为干质量的18%,油脂的平均日产量为0.001 g/L。本实验中小球藻HYS-2在工业废水中油脂含量最高可达36.22%,为f/2培养基中的1.27倍,F-9在工业废水中的油脂含量为17.89%,为f/2培养基中的0.89倍。说明不同藻种对工业废水的利用有一定的差异,鱼糜工业废水有利于小球藻HYS-2中的油脂积累。
微藻的生长可以消耗大量的氮、磷元素,并能移除重金属物质,以及一些有毒有机化合物,不会导致二次污染[22]。利用微藻培养进行工业废水处理也凸显其经济价值,然而,利用微藻产油并净化废水需要解决几个核心问题:1)藻种筛选,目标藻种必须在废水中生长速度快、油脂产量高,同时又能起到净化废水的效果,因此,需要通过现代生物技术开发出符合要求的“工程微藻”;2)微藻光生物反应器的开发与设计,综合考虑微藻生长的光照、pH值、温度等要素,研发高效、低成本、可规模化运转的光合生物反应器;3)开发微藻废水处理与生物质能源生产耦合系统,在该系统中,藻细胞的采收是其生物质得以利用及保证废水处理厂出水水质的基础[24]。
本实验中2种小球藻在自养条件下对鱼糜加工废水中氮、磷营养盐的去除效果十分显著,可以快速将鱼糜加工废水处理至排放标准。同时,本实验是首次用小球藻培养处理水产品加工工业废水,结果用未经任何化学处理的鱼糜加工废水养殖小球藻在综合生长速率上远远大于f/2培养基,说明其具有较好地发展潜力,可以实现微藻的低成本养殖。
参考文献:
[1]Mallick N. Biotechnological potential of immobilized algae for wastewater N, P and metal removal: a review[J]. Biometals, 2002, 15: 377-390.
[2]Dalrymple O K, Halfhide T, Udom I, et al. Wastewater use in algae production for generation of renewable resources: a review and preliminary results[J]. Aquatic Biosystems, 2013, 9(1): 2.
[3]Vasudevan P T, Briggs M. Biodiesel production-current state of the art and challenges[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35: 421-430.
[4]Williams P. Biofuel: microalgae cut the social and ecological costs[J]. Nature, 2007, 450(7169): 457-584.
[5]胡洪营, 李 鑫. 利用污水资源生产微藻生物柴油的关键技术及潜力分析[J]. 生态环境学报, 2010, 19(3) : 739-744.
[6]Behzadi S, Farid M M. Review: examining the use of different feedstock for the production of biodiesel[J]. Asia-Pacific Journal of Chemical Engineering, 2007(2): 480-486.
[7]Guillard R R L, Ryther J H. Studies of marine planktonic diatoms. I.CycloterllananaHustedt andDetonulaconfervacea(Cleve) Gran[J]. Canadian Journal of Microbiology, 1962(8): 229-239.
[8]丛 峰,孙 雪,徐年军. 几种小球藻油脂含量检测方法的比较及优化[J].宁波大学学报:理工版, 2012, 25(1): 20-23.
[9]Xu N J, Zhang X C, Fan X, et al. Effects of nitrogen source and concentration on growth and fatty acid composition ofEllipsoidionsp. (Eustigmatophyta)[J]. Journal of Applied Phycology. 2001, 13(6): 463-469.
[10]Zheng L, Yan X J, Xu J L, et al. Fatty acids and alkaloid metabolites produced by marine spongeHymeniacidonperleveassociated bioactive bacteriumPsuedomonassp. NJ6-3-1[J]. Applied Biochemistry and Microbiology, 2005, 41(1): 35-39.
[11]杨 静, 蒋剑春, 张 宁, 等. 利用工农业废弃物培养微藻的研究进展[J]. 化工进展, 2010, 29(S2): 282-287.
[12]Cho S, Lee N, Park S, et al. Microalgae cultivation for bioenergy production using wastewaters from a municipal WWTP as nutritional sources[J]. Bioresource Technology, 2013, 131: 515-520.
[13]周连宁, 王 波, 吴属连, 等. 利用豆制品废水培养小球藻的研究[J]. 广东农业科学, 2012(19): 182-184.
[14]Yang C F, Ding Z Y, Zhang K C. Growth ofChlorellapyrenoidosain wastewater from cassava ethanol fermentation[J]. World Journal of Microbiology and Biotechnology, 2008, 24(12): 2919-2925.
[15]Zhou W G, Li Y C, Min M, et al. Local bioprospecting for high-lipid producing microalgal strains to be grown on concentrated municipal wastewater for biofuel production[J]. Bioresource Technology, 2011, 102(13): 6909-6919.
[16]曲春波, 史贤明. 利用啤酒废水小球藻异养培养[J]. 微生物学报, 2009,49(6):780-785.
[17]吕素娟, 张 维, 彭小伟, 等. 城市生活废水用于产油微藻培养[J]. 生物工程学报, 2011, 27(3): 445-452.
[18]Woertz I, Feffer A, Lundquist T, et al. Algae grown on dairy and municipal wastewater for simultaneous nutrient removal and lipid production for biofuel feedstock[J]. Journal of Environmental Engineering, 2009, 135(11): 1115-1122.
[19]Kothari R, Prasad R, Kumar V, et al. Production of biodiesel from microalgaeChlamydomonaspolypyrenoideumgrown on dairy industry wastewater[J]. Bioresource Technology, 2013, 144: 499-503.
[20]Farooq W, Lee Y C, Ryu B G, et al. Two-stage cultivation of twoChlorellasp. strains by simultaneous treatment of brewery wastewater and maximizing lipid productivity[J]. Bioresource Technology, 2013, 132: 230-238.
[21]曹 海, 张馨允, 孔维宝, 等. 利用啤酒废水培养普通小球藻生产微藻生物质和油脂[J]. 中国油脂,2012, 37(9): 65-69.
[22]刘建强, 刘玉环, 阮榕生, 等. 利用市政污水培养Chlorellavulgaris生产生物柴油[J]. 生物加工过程, 2011, 9(1): 10-14.
[23]Abdel-Raouf N, Al-Homaidan A A, Ibraheem I B M. Microalgae and wastewater treatment[J]. Saudi Journal of Biological Sciences, 2012(19): 257-275.
[24]McGinn P J, Dickinson K E, Bhatti S, et al. Integration of microalgae cultivation with industrial waste remediation for biofuel and bioenergy production: opportunities and limitations[J]. Photosynth Research, 2011, 109(1-3): 249.
