一种双核钴配合物的结构及其生物活性研究
2014-03-25李健君李梅瑜高恩军沈光海
李健君, 李梅瑜, 高恩军, 沈光海
(1.延边大学 药学院, 吉林 延吉 133000; 2.沈阳化工大学 应用化学学院, 辽宁 沈阳 110142;3.沈阳市无机分子基材料化学(国际)重点实验室, 辽宁 沈阳 110142)
钴是一种重要的生命元素,具有很多重要的生理活性.近年来,钴配合物的生物活性引起广大生物化学家、配位化学家、药物化学家的关注,并在这一领域进行了很多研究工作[1-4].DNA快速且没有节制地复制是造成细胞癌变的起因,作为抑制肿瘤药物的各种分子,无论它在体内的代谢路径和作用机理是怎样的,最终都是以DNA分子作为重要靶向,所以研究药物分子与DNA之间的相互作用、探讨其作用机理是研究开发各种新型抗癌药物的重中之重[5-7].而金属配位化合物,尤其是过渡金属配位化合物多以DNA为靶向,因此研究过渡金属配位化合物与DNA的作用机理是目前人们关注的热点.本文采用水热法以1-氢-1,2,3-三氮唑-4,5-二羧酸(Htda)为配体,合成[Co2(Htda)2(H2O)6·5H2O]双核钴配合物,并使用X-射线单晶衍射法结合绘图软件对其结构进行研究.使用荧光光谱法,初步研究钴配合物与DNA的作用机理.运用琼脂糖凝胶电泳研究配合物对pBR322 DNA切割作用,证实配合物[Co2(Htda)2(H2O)6·5H2O]具有潜在药用价值.
1 实验部分
1.1 试剂和仪器
六水合硝酸钴:分析纯,国药试剂;1-氢-1,2,3-三氮唑-4,5-二羧酸(Htda):分析纯,济南恒化;CT-DNA:国药试剂;pBR322 DNA、上样缓冲液、TAE缓冲溶液和Marker:生化试剂,大连TAKARA.
电子分析天平:Sartorius BS224S;精密数显酸度计:上海雷磁PHS-25; pH复合电极:E-201-C;磁力搅拌器:金坛大地CJJ-6;电热鼓风干燥箱:北京科伟101-2; X-射线单晶衍射仪:Bruker Smart CCD;晶体结构分析:SHELX-97软件包;荧光分光光度计:Perkin Elmer LS55;电泳仪:上海培青JS-250;自动凝胶图像分析仪:JS-380A.
1.2 配合物的合成
使用电子分析天平称取0.029 g(0.1 mmoL)六水合硝酸钴、0.016 g(0.1 mmoL) 1-氢-1,2,3-三氮唑-4,5-二羧酸(Htda)混合放于反应釜中,加10 mL水溶解,搅拌下,用0.1 mol/L的KOH溶液调pH值至6.6.置于120 ℃烘箱中恒温反应3 d后,每1 h降温10 ℃反应至室温.取出,发现粉红色透明晶体,产率为55 %.使用X-射线单晶衍射仪测定所得配合物的晶体结构为[Co2(Htda)2(H2O)6·5H2O].运用晶体结构分析软件确定为目标产物.
2 配合物的晶体结构
配合物[Co2(Htda)2(H2O)6·5H2O]的简要分子结构如图1所示(省略氢原子和结晶水分子).中心原子Co和配体的配位形式是六配位、扭曲八面体构型.中心原子Co1分别与O5、O12、O13、O14、N2和N4以配位键连接.其中Co1与O5、N4的连接形式为螯合.中心原子Co2分别与O4、O9、O10、O11、N3和N5以配位键连接,其中Co2与O4、N3的连接形式为螯合.配合物[Co2(Htda)2(H2O)6·5H2O]的三维结构如图2所示(图中虚线表示氢键).由图2可以看出,配合物的三维结构由配体、配位水、结晶水之间的氢键构成.
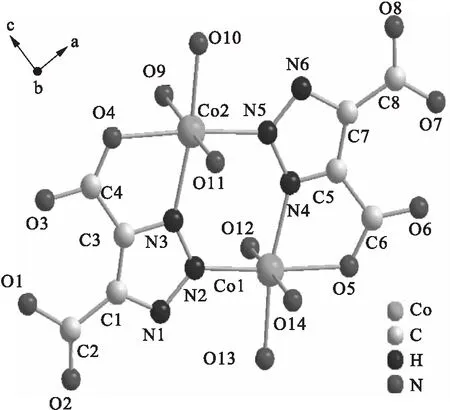
图1 配合物[Co2(Htda)2(H2O)6·5H2O] 的分子结构简图
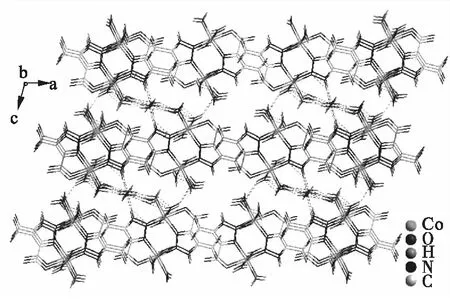
图2 配合物[Co2(Htda)2(H2O)6·5H2O] 三维结构示意图
3 配合物与DNA的作用
3.1 荧光光谱分析
应用荧光光谱法研究配合物与小牛胸腺DNA(CT-DNA)的作用形式.溴化乙锭(EB)是一种分子荧光探针,被广泛应用于配合物与DNA作用的研究领域[8].EB作为一种共轭的芳香平面分子,本身的荧光强度很低,但当EB插入DNA双螺旋结构的碱基对之间,并形成EB和DNA的复合物(EB-DNA复合物)以后,EB-DNA复合物的荧光强度较EB本身的荧光强度会增强几十倍甚至几百倍.配合物加入到体系中后,会与EB竞争插入DNA,EB就会被配合物从DNA碱基对之间挤出来,此时体系的荧光强度就会比配合物加入之前弱.根据已报道过的荧光筛选法标准:如果配合物使EB-DNA体系荧光强度减弱程度超过50 %,且配合物与DNA的摩尔比不超过100,即可认为配合物对DNA发生了显著作用[9-10].由斯特恩·沃尔默(Stern Volmer)方程[9]:I0/I=1+Ksq·r(I0/I:存在和不存在配合物时复合物荧光强度之比;r:配合物与所加入的DNA的浓度比;Ksq:配合物的荧光猝灭常数),可说明配合物对DNA插入作用的强弱.Ksq值越大,配合物对DNA插入作用则越强.配合物对CT-DNA作用的荧光光谱法谱图见图3,配合物对CT-DNA插入作用荧光猝灭常数见图4.从图3可以看出:随着配合物浓度的增加,EB-DNA复合物体系的荧光强度会相应减弱.配合物对CT-DNA作用的荧光光谱法结果中可以看到猝灭现象,从图4中可以看出配合物的猝灭常数Ksq=0.043 6,对CT-DNA具有一定的插入能力.
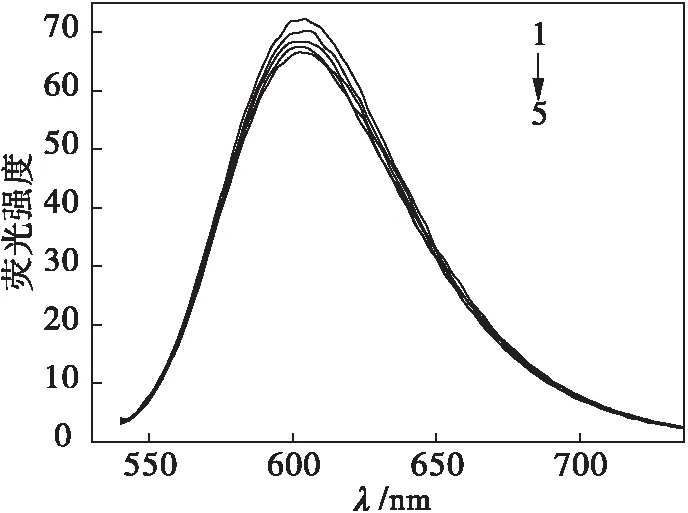
1c=0 2c=2.5×10-6mol/L 3c=5.0×10-6mol/L 4c=7.5×10-6mol/L 5c=1.0×10-5mol/Lc(DNA)=1×10-5mol/Lc(EB)=2×10-6mol/L
图3 不同浓度的配合物与DNA作用的荧光光谱
Fig.3 Fluorescence spectra of complexc
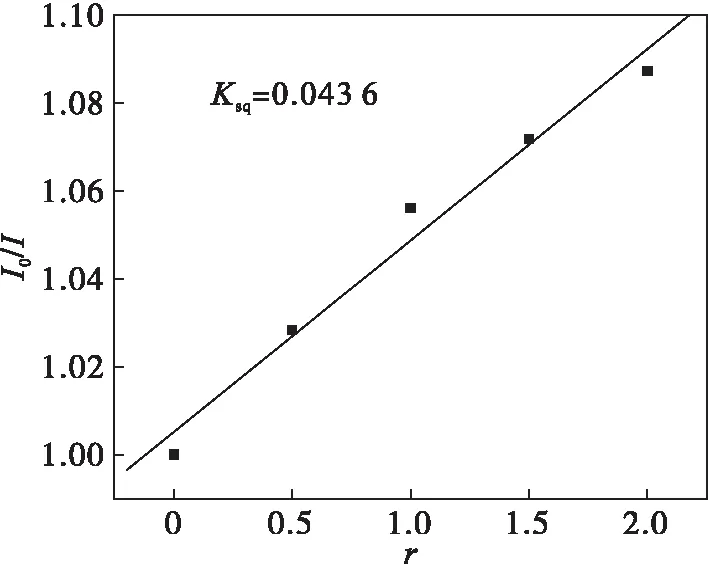
图4 配合物对EB-DNA复合物体系的荧光猝灭常数
3.2 凝胶电泳分析
电泳,即在外电场作用下,带电小颗粒会向与其电荷相反电极移动的现象.在一定pH值条件下,DNA也会带有负电荷,电泳测定时会向电泳槽的正极移动.电泳现象是分离、鉴定和纯化DNA片段的主要方法[11-12].
在DNA电泳实验中,主要作用力有2种:即对DNA产生引力的电场力和DNA与电泳基质(本文使用琼脂糖凝胶)间的摩擦力.而DNA通过电泳基质速率的主要影响因素有:DNA分子大小及其构型,电泳基质浓度,电泳槽两端的电压等.本文以琼脂糖凝胶电泳实验,并对实验结果进行光密度扫描来定性的研究配合物对pBR322 DNA的切割作用.
琼脂糖凝胶电泳实验方法如下:购买的pBR322 DNA保存在零下20°C环境中.将pBR322 DNA和一定浓度的配合物混合后,在室温有氧条件下避光静置2 h,加入上样缓冲液.使用微量进样器,把经过上述步骤处理后的样品和空白对照,缓慢注入到事前准备好的琼脂糖凝胶(琼脂糖含量8 g/L)的孔洞中,加入TAE缓冲溶液,放入JS-250电泳仪中,使用120 V的直流电,电泳时间1 h,取出,放入JS-380A自动凝胶图像分析仪中,拍照保存.结果见图5和图6.
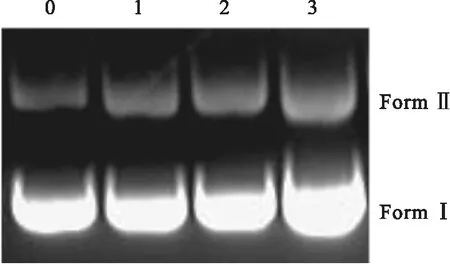
图5 配合物对质粒pBR322 DNA切割的 电泳实验结果
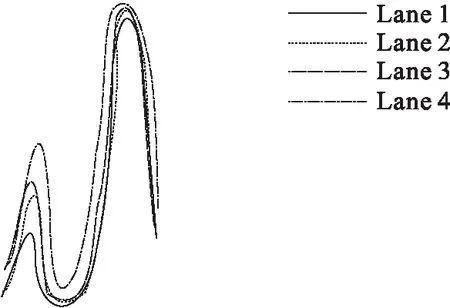
图6 配合物对pBR322 DNA的切割 电泳光密度扫描图
图5是配合物对pBR322 DNA切割的实验结果.Lane 0是纯的DNA,Lane 1~3为配合物与DNA在空气中反应2 h之后的样品(Lane 1~3中配合物浓度分别为13.2、6.6、3.3 μmol/L).从图5可以看出,随着配合物浓度的增大,配合物使pBR322 DNA的共价闭环带(Form Ⅰ)逐渐减少,明显的开环双链环状带(Form Ⅱ)出现.通过对配合物进行琼脂糖凝胶电泳实验可知:配合物对pBR322 DNA细胞具有一定的切割能力,并且随着配合物浓度的增加,切割活性也相应增强.图6是由图5经过光密度扫描所得,由图6可以更明显地看出配合物浓度不同,对pBR322 DNA的切割程度不同,配合物浓度逐渐增加时,条带的峰值依次降低,表明配合物浓度越大时DNA碱基对所剩越少,因此配合物浓度越大对pBR322 DNA的切割越好.
4 结束语
采用水热合成法制备了1个钴(Ⅱ)配合物,分子式为[Co2(Htda)2(H2O)6·5H2O].用X-射线单晶衍射技术测定上述配合物的晶体结构,并对其分子间弱作用力进行了讨论.配合物对CT-DNA作用的荧光光谱法结果表明:不同浓度的配合物加入到EB-DNA复合物之中后均可见荧光猝灭现象,说明配合物在各个浓度下均能以插入的方式与DNA结合.配合物的凝胶电泳实验结果及其光密度扫描结果表明:配合物在各个浓度下对pBR322 DNA均有一定的切割能力,且配合物浓度越大对pBR322 DNA的切割越好.以上荧光光谱实验和凝胶电泳实验结果表明配合物[Co2(Htda)2(H2O)6·5H2O]在分子水平对DNA具有一定的生物活性,具有潜在的药用价值,其细胞水平的生物活性尚有待研究.
参考文献:
[1] Zheng F K,Wu A Q,Li Y,et al.Copper(Ⅱ),Niclel(Ⅱ) and Cobalt(Ⅱ) Complexes of 4-cyanobenzonic Acid:Syntheses,Crystal Structures and Spectral Properties[J].J.Mol.Struct.,2005,740(1/3):147-157.
[2] Li Q Y,Tang X Y,Zhang W H,et al.Constructions of a Set of Novel Hydrogen-bonded Supramolecules from Reactions of Cobalt(Ⅱ) Salt with Bis(3,5-dimethylpyrazolyl)methane and Different Carboxylic Acids[J].J.Mol.Struct.,2008,879(1/3):119-129.
[4] 宋玉民,康敬万,高锦章,等,钴(Ⅲ)配合物与DNA作用研究[J].无机化学学报,2000,16(1):54-57.
[5] 唐宏武,沈昊宇.吖啶橙-细胞DNA荧光抑制法初步筛选抗癌药物的研究[J].武汉大学学报:自然科学版,1997,43(6):711-716.
[6] Gao Enjun,Zhu Mingchang,Yin Hongxi,et al.Synthesis,Characterization,Interaction with DNA and Cytotoxicity in Vitro of Dinuclear Pd(Ⅱ) and Pt(Ⅱ) Complexes Dibridged by 2,2′-Azanediyldibenzoic Acid[J].Journal of Inorganic Biochemistry,2008,102(10):1958-1964.
[7] 王蕾,吴琼,朱明昌,等.配合物[M2(PDB)3·4H2O]n的合成、表征及其与DNA作用研究[J].沈阳化工学院学报,2009,23(3):198-202.
[8] 郭茂林,杨频,杨斌盛,等.以溴化乙锭为荧光探针研究二氯二茂铁与DNA作用方式[J].科学通报,1995,40(13):1187-1190.
[9] 李志良,毕琼斯,李俊忠,等.荧光法用于新型抗癌配合物[Pd(tcd)(NO3)2]初步筛选及作用机制研究[J].化学通报,1997,60(6):52-55.
[10] 林辉祥,毕琼斯,彭华,等.钯铂抗癌配合物初步筛选的荧光法研究[J].高等学校化学学报,1992,13(4):443-446.
[11] José R,Julia L,Laura S C,et al.Palladium(Ⅱ) and Platinum(Ⅱ) Organometallic Complexes with the Model Nucleobase Anions of Thymine,Uracil,and Cytosine:Antitumor Activity and Interactions with DNA of the Platinum Compounds[J].Journal of Inorganic Chemistry,2006,45(16):6347-6360.
[12] Gao E J,Gao X N,Guan F,et al.Synthesis and Crystal Structure of Two New Dinuclear Cobalt(Ⅱ) Complexes Interaction with HeLa Cells[J].Eur.J.Med.Chem.,2011,46(1):160-167.
