壳聚糖固定化脲酶生物传感器选择性测定铜离子
2014-03-11曾宪冬张资平
曾宪冬,柳 洁,张资平,孔 舒
(1.深圳市南山区疾病预防控制中心,广东深圳518054)
(2.烟台大学生命科学学院,山东烟台264005)
0 引言
铜离子是一种重要的环境污染物,超过一定的浓度就会对环境和人体造成危害。检测环境、生物及其它实际样品中的铜离子是非常重要的[1~3]。目前用于测定铜离子的通用方法有原子吸收光谱法(AAS)[4~6]、电感耦合等离子体质谱法(ICP-MS)[7]等。这些方法存在仪器昂贵、运行费用高、不易携带等缺点,在连续监测及现场检测等方面受到很大限制。生物传感器作为一种新的检测手段,具有灵敏度高、稳定性好、成本低廉、能在复杂的体系中快速检测等特点。由于重金属离子对许多酶的活性具有抑制作用,因此,构建用于检测重金属离子的酶抑制型生物传感器引起了广泛研究关注[8~10]。酶抑制型生物传感器常用的酶包括脲酶、过氧化物酶、黄嘌呤氧化酶、葡萄糖氧化酶和乙酰胆碱脂酶等。其中脲酶由于廉价易得,故而使用最广泛。但是酶的活性往往可以受到多种重金属离子的抑制,因此如何改善酶抑制型生物传感器的选择性,实现特定重金属离子的检测,成为这一研究领域的重要课题。
壳聚糖(CS)是一种线性的亲水性多聚糖,一般通过天然的甲壳素脱乙酰获得。由于其具有很好的生物相容性和极好的成膜特性,广泛用于酶生物传感器的构建[11~13]。同时,壳聚糖对于重金属离子具有吸附富集作用[14],用壳聚糖作为固定载体,有利于提高重金属离子检测的灵敏度。该研究工作利用壳聚糖将脲酶固定于pH 电极表面,构建了用于Cu2+检测的传感器,通过优化实验条件,实现了Cu2+的选择性检测。
1 实验部分
1.1 仪器和试剂
PXJ-1B型数字式离子计 (江苏电分析仪器厂),E-901型pH 平面复合电极 (上海罗素科技有限公司),X-7 电感耦合等离子体质谱仪(美国赛默飞世尔公司)。
壳聚糖(脱乙酰度>75%)、洋刀豆脲酶(EC 3.5.1.5,50~100 unit/mg)购自Sigma 公司,重金属标准溶液(1 000 μg/mL)购自中国计量研究院,使用时,用0.05 mol/L pH6.0 的磷酸盐缓冲液(PBS)稀释至一定浓度作为酶抑制剂。尿素(>99.5%)购自阿拉丁试剂有限公司,将其溶解于0.05 mol/L pH6.0 的PBS 中配成5 mmol/L 的溶液做为酶促反应的底液。其余试剂均为分析纯。
1.2 生物传感器的构建
壳聚糖用1%(V/V)醋酸溶解,搅拌大约4 h,使壳聚糖固体完全溶解然后过滤除去可能存在的不溶性杂质,所配壳聚糖溶液浓度为2%(W/V)。称取适量的脲酶,加入到pH6.0 的磷酸盐缓冲液(PBS)中,配制成10%的脲酶溶液。为获得好的响应性能,对脲酶溶液与壳聚糖溶液的比例进行了优化,最优条件为1 体积的脲酶溶液与5 体积的壳聚糖溶液进行混合。然后用微量注射器取10 μL 混合液滴于处理好的pH 电极表面,再用一个烧杯盖在电极上面,使溶剂缓慢挥发以得到均匀的膜层。制备好的生物传感器在使用前,先浸泡在pH6.0 的PBS 中1 h 后用纯水冲洗,以便酶修饰层溶胀和除去残留的醋酸。
1.3 Cu2+的检测
首先将制备好的生物传感器置于尿素溶液中,测定经过一定时间酶促反应引起的电位变化ΔE,然后用缓冲溶液冲洗电极,使其电位回复至初始电位。将生物传感器浸入含Cu2+的溶液一段时间,使酶的活性受到抑制,再将其置于尿素溶液中,经过一定时间酶促反应引起的电位变化为ΔE′。通过抑制前后电位变化的差异可以计算出Cu2+对脲酶活性的抑制率,计算公式为:
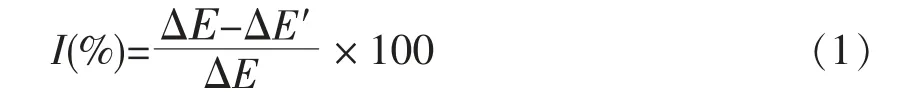
根据不同浓度Cu2+下抑制率的变化,可获得抑制率与重金属离子浓度间的响应曲线。
2 结果与讨论
2.1 生物传感器的电位响应
将制备好的脲酶生物传感器置于尿素溶液中,pH 电极的电位响应如图1中a所示,由于固定于pH 电极表面的脲酶催化作用,尿素溶液发生水解,引起pH 电极的电位发生变化。而将脲酶生物传感器先浸入含Cu2+的溶液一段时间后,再将其置于尿素溶液中,电位响应如图1中b所示,可以看到,电位变化的趋势与a 相似,但是电位变化值远远小于前者,这一现象说明,Cu2+能明显抑制脲酶的活性。
2.2 生物传感器测定条件的优化
2.2.1 酶促反应时间的选择
从图1中可以看出,在开始的5 min 里,随着尿素的酶催化水解反应发生,生物传感器的电位响应逐渐增大,5 min 后,由于水解反应接近平衡,电位响应也趋于稳定,因此,酶促反应的时间选定为5 min。
2.2.2 抑制时间的影响
酶与Cu2+溶液的接触时间会影响到其对酶活性的抑制效果。不同抑制时间下,脲酶活性的抑制率如图2所示,从图中可以看出,在30 min 以内随着抑制时间的延长,抑制率逐渐增大;30 min 后,抑制率不再发生明显变化。这是由于在30 min 后,Cu2+与酶活性位点的结合达到了平衡,因而其对酶活性的抑制率也不在发生变化,因此,在该试验中,酶抑制的时间选定为30 min。
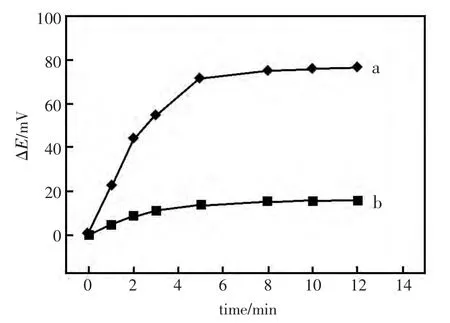
图1 生物传感器在5 mmol/L 的尿素溶液中电位响应:(a)酶未被抑制,(b)酶被0.2 μg/mL Cu2+抑制30 min 后Fig.1 The potential response curve of the biosensor in 5 mmol/L urea solution:(a)the activity of urease was not inhibited,(b)the activity of urease was inhibited by 0.2 μg/mL Cu2+for 30 min
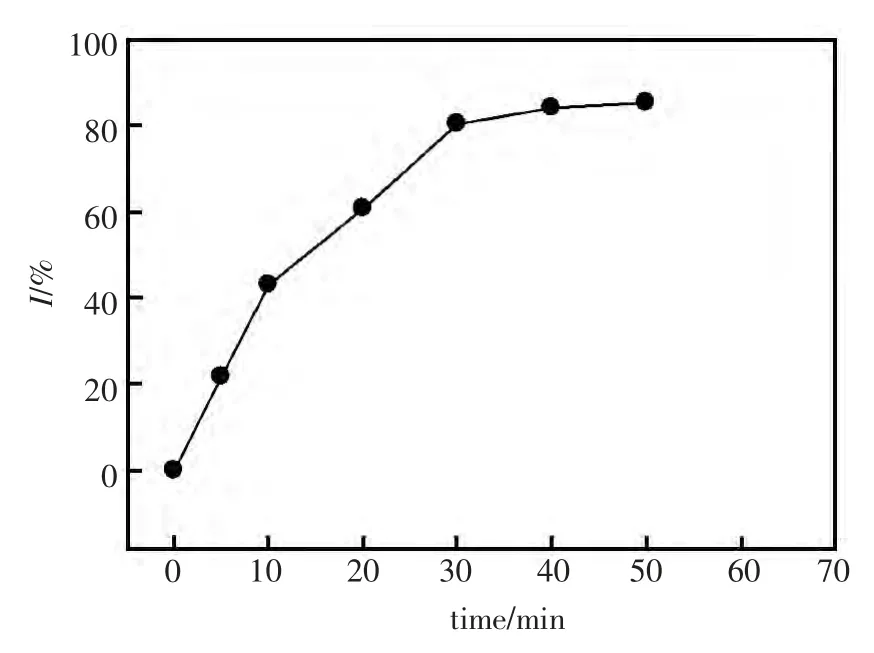
图2 抑制时间对酶活性抑制率的影响Fig.2 Dependence of inhibition rate(I)on inhibition time
2.2.3 生物传感器选择性的改善
除了Cu2+以外,其他重金属离子,尤其是Hg2+与Ag+,对于脲酶的活性也具有很强的抑制作用,因此这些离子对Cu2+的测定具有交叉干扰。在上述测定条件下1 μg/mL 浓度的Cu2+、Hg2+、Ag+对脲酶的抑制率分别为96.43%、98.54%和100%,三种离子对脲酶的抑制影响较为相似。为了消除干扰,选择性检测Cu2+,必须对实验条件进行优化,提高该生物传感器选择性。在溶液中添加某种阴离子,与Hg2+及Ag+生成难溶盐,是降低它们对脲酶活性的影响的一种有效途径。通过实验比较,确定NaI 作为一种有效的添加剂来消除Hg2+和Ag+的影响,加入浓度为5 mmol/L NaI 后,Hg2+和Ag+浓度在1 μg/mL 以内均对脲酶的活性没有影响(抑制率<10%)。同时,实验结果表明,加入的NaI 对于Cu2+的检测灵敏度没有明显的影响。
2.3 生物传感器对Cu2+的检测性能
2.3.1 线性范围及检出限
在最优检测条件下,不同浓度的Cu2+对脲酶活性的抑制率如图3所示,从图中可以看出,脲酶活性的抑制率随着Cu2+浓度的增加逐渐增加,在0.005~0.5 μg/mL 的Cu2+浓度范围内,脲酶活性的抑制率与Cu2+浓度的对数呈良好的线性响应关系,相关系数r2=0.999 9。以脲酶受到明显抑制,及抑制率>10%计,该生物传感器对Cu2+的检出限为0.002 μg/mL。当Cu2+浓度大于1 μg/mL时,脲酶的活性几乎完全被抑制(抑制率>95%)。
2.3.2 生物传感器的再生及其重现性、稳定性
为了考察所制备的生物传感器的重现性和稳定性,首先要对生物传感器的再生进行研究。EDTA 是一种高效的Cu2+螯合剂,因此,可以利用EDTA 来去除与酶活性中心结合的Cu2+使酶的活性得到恢复,从而使生物传感器得到再生。实验研究表明,EDTA 浓度0.5 mmol/L,再生时间5 min,生物传感器可以获得最佳再生效果,酶活性可以恢复至初始状态的95%。
在上述再生条件,用同一生物传感器重复测定0.5 μg/mL 的Cu2+溶液8次,其相对标准偏差为3.6%,这一结果说明该生物传感器具有很好的精密度。
将新制备的生物传感器浸泡在4℃,pH6.0的PBS溶液中,通过每天测定其对同一浓度Cu2+溶液的响应考察了该生物传感器的稳定性,实验结果表明,该生物传感器表现出很好的稳定性,在30 d 内灵敏度没有明显下降。
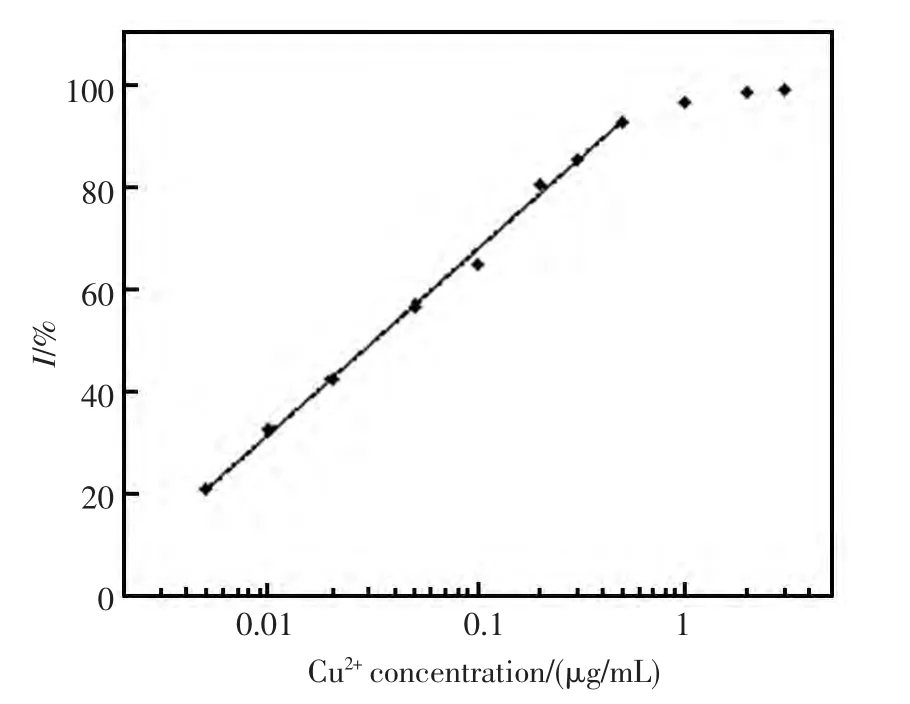
图3 生物传感器对Cu2+检测的校正曲线Fig.3 Calibration curve for Cu2+determination by the proposed biosensor
2.3.3 实际样品的测定
为了进一步考察该生物传感器在实际样品检测中的应用价值,采集了两份工业废水样品,同时用所制备的生物传感器及ICP-MS 进行分析对比,两种方法对两份水样中Cu2+浓度测定结果的相对偏差分别为5.1%和4.2%,两种方法的测定值具有很好的一致性,从而证明该生物传感器能用于实际样品中Cu2+的检测。
3 结论
以壳聚糖作为载体,将脲酶固定于pH 电极表面,成功制备出可灵敏检测Cu2+的生物传感器。在样品溶液中加入NaI,可以消除Hg2+和Ag+对Cu2+测定的干扰。同时,该生物传感器具有良好的再生能力,能重复利用,且重现性好、稳定性高,能用于实际样品的检测。
[1]Chan Y H,Chen J X,Liu Q S,et al.Ultrasensitive Copper(Ⅱ) Detection Using Plasmon-Enhanced and Photo-Brightened Luminescence of CdSe Quantum Dots[J].Anal.Chem.,2010,82(9):3 671~3 678.
[2]Brown DR,Kozlowski H.Biological inorganic and bioinorganic chemistry of neurodegeneration based on prion and Alzheimer diseases[J].Dalton.Trans.,2004,13:1 907~1 917.
[3]Xia B,Zhang W,Shi J,et al.Fluorescence quenching in luminescent porous silicon nanoparticles for the detection of intracellular Cu2+[J].Analyst,2013,138 (13):3 629~3 632.
[4]Cassella R J,Magalhães O I B,Couto M T,et al.Synthesis and application of a functionalized resin for flow injection/F AAS copper determination in waters[J].Talanta,2005,67(1):121~128.
[5]Llobat-Estellés M,Mauri-Aucejo A R,Marin-Saez R.Detection of bias errors in ETAAS:Determination of copper in beer and wine samples[J].Talanta,2006,68(5):1 640~1 647.
[6]Chen X W,Huang L L,He R H.Silk fibroin as a sorbent for on-line extraction and preconcentration of copper with detection by electrothermal atomic absorption spectrometry[J].Talanta,2009,78(1):71~75.
[7]Wu J,Boyle E A.Low Blank Preconcentration Technique for the Determination of Lead,Copper,and Cadmium in Small-Volume Seawater Samples by Isotope Dilution ICPMS[J].Anal.Chem.,1997,69(13):2 464~2 470.
[8]Malitesta C,Guascito M R.Heavy metal determ ination by biosensors based on enzyme immobilised by electropolymerisation[J].Biosens.Bioelectron.,2005,20(8):1 643~1 647.
[9]Tadeusz K,Malgorzata M,Trojanowicz M.Inhibitive determination of mercury and other metal ions by potentiometric urea biosensor[J].Biosens.Bioelectron.,2000,15(11-12):681~691.
[10]Volotovsky V,Nam Y J,Kim N.Urease-based biosensor for mercuric ions determination[J].Sensors and Actuators B,1997,42(3):233~237.
[11]江丽萍,吴霞琴,龚翠萍,等.壳聚糖修饰电极的电化学行为及其在生物传感器中的应用[J].化学传感器,2002,22(4):18~23.
[12]Luo X L,Xu J J,DuY.A glucose biosensor based on chitosan–glucose oxidase–gold nanoparticles biocomposite formed by one-step electrodeposition [J].Anal.Biochem.,2004,334(2):284~289.
[13]Zhang M G,Smith A,Gorski W.Carbon nanotube-chitosan system for electrochemical sensing based on dehydrogenase enzymes[J].Anal.Chem.,2004,74(19):5 045~5 050.
[14]Wu F,Tseng R,Juang R.A review and experimental verification of using chitosan and its derivatives as adsorbents for selected heavy metals[J].Journal of Environmental Management,2010,91(4):798~806.
