雷帕霉素栓剂的制备及质量评价
2014-03-23朱雁林傅红兴周伟忠吴岚岚刘成洋朱丹李慧李校堃
朱雁林,傅红兴,周伟忠,吴岚岚,刘成洋,朱丹,李慧,李校堃
(1.温州医科大学 药学院,浙江 温州 325035;2.义乌市中医医院 药剂科,浙江 金华 322000)
·技术与方法·
雷帕霉素栓剂的制备及质量评价
朱雁林1,傅红兴1,周伟忠2,吴岚岚2,刘成洋1,朱丹1,李慧1,李校堃1
(1.温州医科大学 药学院,浙江 温州 325035;2.义乌市中医医院 药剂科,浙江 金华 322000)
目的:制备一种含雷帕霉素的聚乙二醇栓剂,并对其质量进行评价。方法:以雷帕霉素为原料药,聚乙二醇2000和聚乙二醇4000为主要基质,热熔法工艺制备含药栓剂,并对其药物含量、重量差异、融变时限、药物溶出等进行评价。结果:雷帕霉素聚乙二醇栓剂外观呈白色半透明状,室温下保持较好的硬度,药物含量、重量差异和融变时限均符合栓剂要求,药物在释放介质中约25 min释放达到75%以上。结论:本研究制备的雷帕霉素聚乙二醇栓剂符合中国药典栓剂质量检测要求,有望开发成雷帕霉素的一种新剂型。
雷帕霉素;聚乙二醇;栓剂;质量评价
雷帕霉素(rapamycin)是一种新型大环内酯类免疫抑制剂,现主要运用于肾移植的抗排异治疗,其通过抑制白细胞介素-2从而阻碍激活T细胞及B细胞来抑制免疫,并与环孢霉素A(CsA)和他克莫司(FK506)等免疫抑制剂有良好的协同作用,是一种疗效好,低毒,无肾毒性的新型免疫抑制剂[1-2]。
雷帕霉素临床常用剂型为片剂、口服液,但对于一些疾病引起的进食障碍会造成服药困难;栓剂通过直肠给药,药物可不经过肝脏直接吸收进入体循环,吸收效率高[3]。为了使腹部器官移植术后患者达到有效的免疫抑制,避免口服给药存在的缺陷,本研究制备了一种含雷帕霉素的水性基质栓剂,并对其质量进行评价,为该免疫抑制药物栓剂剂型的开发提供参考。
1 试剂和仪器
1.1 试剂雷帕霉素原料药(纯度98.0%,广州亿邦医药科技有限公司);雷帕霉素标准品(纯度>98%,编号:MB1197-S,大连美仑生物技术有限公司);聚乙二醇2000、聚乙二醇4000(PEG 2000、PEG 4000,上海精细化工科技有限公司);甘油(国药集团化学试剂有限公司);雷帕霉素标准品(华北制药厂新药研究所);乙腈(色谱纯,德国默克公司),其余试剂均为分析纯。
1.2 仪器子弹型栓剂模型(长沙市岳麓区常宏制药机械设备厂);融变时限仪(WZ-50CZ,浙江大学医学仪器有限公司);D-800LS智能药物溶出仪(天津大学无线电厂);Agilent高效液相色谱仪,VWD检测器。
2 实验方法
2.1 雷帕霉素栓剂的制备
2.1.1 处方:根据前期预实验摸索,得到雷帕霉素栓剂的配方如下:PEG 2000 0.8 g,PEG 4000 19.2 g,甘油3 g,蒸馏水2 mL,雷帕霉素72.8 mg。
2.1.2 制备工艺:采用热熔法制备工艺[3]。称取PEG 2000、PEG 4000至50 mL烧杯中,用水浴加热溶化,分次加入甘油和水搅匀,待温度降至约50 ℃,加入药物粉末,迅速搅拌均匀至近凝,注入含少量液体石蜡为脱模剂的栓模中,冷却凝固,切去溢出部分,脱模即得。每粒栓剂中含药物雷帕霉素约5 mg。
2.2 栓剂的质量评价
2.2.1 药物含量的测定:参考文献[4]报道,采用HPLC法测定药物的含量。
(1)色谱条件:Agilent高效液相色谱仪,色谱柱:Agilent Eclips XDB-C18 4.6×250 mm,5 μm;柱温:40 ℃;流动相:100%乙腈;流速:1 mL/min;紫外检测器检测波长:278 nm;进样量:20μ L,在此条件下,雷帕霉素能与其他成分较好地分离。
(2)标准曲线的制备:对照品溶液的配制:精密称取雷帕霉素标准品10.0 mg,置于25 mL容量瓶中,加乙腈适量,振荡使对照品溶解,用乙腈稀释至刻度浓度为400 μ g/mL,摇匀,作为对照品储备液。
精密量取对照品储备液0.1、0.2、0.5、1.0、2.0、5.0 mL用乙腈稀释至25 mL,配制成浓度为1.6、3.2、8.0、16、32、80 μ g/mL的工作液,按上述色谱条件进样,记录色谱图,以峰面积对照品溶液浓度进行线性回归,求得标准曲线方程C=0.0147A+0.5293,相关r=0.9999,C:μ g/mL。雷帕霉素在1.6~80μ g/mL范围内呈良好线性关系。
(3)精密度试验:取标准曲线制备中的浓度为1.6、16和80μ g/mL雷帕霉素对照液各3份,按上述色谱条件,重复进样6次,进样量为20 μL,记录峰面积,计算RSD值分别为1.75%、2.36%、1.19%,说明测定方法精密度良好。
(4)稳定性试验:取标准曲线制备中的浓度为16 μ g/mL的雷帕霉素对照液,在1、2、4、8、12、 16、24 h分别按上述色谱条件进样,进样量为20 μL,记录峰面积,计算RSD值为1.48%,未见分解峰。说明测定过程中,雷帕霉素检测样品24 h内稳定。
(5)回收率试验:精密称取一定量标准品9份至25 mL容量瓶中,分别加入空白PEG栓剂粉末,每份0.6 g,加乙腈振荡溶解;制备相当于样品溶液浓度的80%、100%、120%的溶液,每一浓度各3份,0.45 μ m微孔滤膜过滤,精密量取续滤液,按上述色谱条件进样20 μL,记录峰面积,以外标法计算其含量,计算加样回收率。
(6)栓剂中药品含量的测定:切碎6粒含药栓剂,混合后精密称取6份栓剂粉末(每份含药物约0.5 mg)置于25 mL容量瓶中,加入乙腈振荡溶解,0.22μ m滤膜过滤,取续滤液HPLC进样检测,峰面积代入标准曲线,计算药物浓度和栓剂中的药物含量。
2.2.2 重量差异检查:应符合《中国药典》2010年版有关项下规定[7]。取栓剂10粒,精密称定总重量,求得平均粒重后,再分别精密称定各粒的重量。每粒重量与平均粒重相比较,超出限度的药粒不得多于1粒,并不得超出限度一倍。
2.2.3 融变时限:取栓剂3粒,按《中国药典》2010年版融变时限检查装置和检查方法检查,水溶性基质的栓剂应在60 min内全部溶解[7]。如有1粒不合格应另取3粒复试,应符合规定。
2.2.4 药物溶出试验:参考文献[5-6]报道,采用中国药典二部附录溶出度测定第一法。分别取1 000 mL硼砂缓冲液(pH=8)作为释放介质,含0.5%的十二烷基硫酸钠,温度(37.0±0.5)℃,转速100 r/min,取含药栓剂6粒,分别放入转篮中,于2、3、4、7、10、15、20、25、30、40、50 min定时取样5 mL(同时补充等量新鲜介质),0.8μ m微孔滤膜滤过,续滤液用HPLC法检测药物浓度,以溶出介质为空白,测定峰面积,代入标准曲线方程计算药物累积溶出百分率(Q)。
2.3 统计学处理方法采用SPSS 17.0统计软件进行分析。所有数据以±s表示。
3 结果
3.1 雷帕霉素PEG栓剂制备结果雷帕霉素PEG栓剂外观呈白色半透明状,表面光滑,在室温25 ℃下成型性较好,有一定的硬度,如图1所示。

图1 雷帕霉素PEG栓剂
3.2 栓剂中的药物含量测定结果
3.2.1 回收率测定结果:雷帕霉素药物在空白栓剂基质中的加样回收率结果如表1所示。

表1 雷帕霉素栓剂含量检测方法回收率测定结果(n=3)
由表1制剂中的药品回收率测定结果表明,药品雷帕霉素在该检测条件下的回收率结果良好。
3.2.2 栓剂中雷帕霉素含量测定结果:经含量测定,药物雷帕霉素PEG栓剂药物含量平均为(5.15 ±0.26)mg,符合药品含量标准。
3.3 重量差异结果本实验制备的雷帕霉素PEG栓剂重量为(1.73±0.01)g,重量差异限度<7.5%,符合重量差异限度要求。
3.4 融变时限结果本实验制备的雷帕霉素PEG栓剂融变时间为(26.4±1.6)min,水性基质栓剂融变时限为<60 min[7],因此本栓剂符合融变时限要求。
3.5 药物溶出试验结果经不同的时间抽取药物溶出液,进样测定后,所得雷帕霉素PEG栓剂中药物的累积释放百分率结果如图2所示。
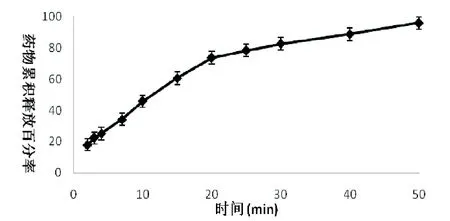
图2 雷帕霉素PEG栓剂体外随时间的药物累积释放百分率
由图2结果可见,药物在20~25 min内溶出较快,在25 min左右药物释放达到75%,然后药物溶出有所减慢;此现象可能与25 min内栓剂基质的全部溶解有关,当基质溶解后,药物的溶出变成了难溶性药物在溶出介质中的扩散,因此速度有所减慢。
4 讨论
栓剂在常温下为固体,塞入腔道后,在体温下能迅速软化熔融或溶解于分泌液,逐渐释放药物而产生局部或全身作用[3]。因雷帕霉素药物在水中和油中的溶解性均较差,采用DMSO溶解后与熔融的PEG混合时亦析出片状沉淀,因此本实验中采用药物细粉直接与熔融的基质混合,但注意尽量加速搅拌使其分散均匀;采用PEG水溶性栓剂基质,该基质与药物不相互溶,能促使雷帕霉素药物快速释放。
雷帕霉素作为一种免疫抑制药物,其剂量的准确性在维持移植物的功能上至关重要。栓剂给药适合于腹部外科移植后或吞咽困难的移植患者使用,可弥补口服给药的缺陷。雷帕霉素在体内的半衰期约为60 h,且95%分布于红细胞内,游离状态的药物极少,因此本栓剂在体内给药时进行血药浓度监测也尤显必要。
[1]Soleimani AR, Kamkar I, Nikoueinejad H, et al. Comparison of cyclosporine and sirolimus effects on serum creatinine level over five years after kidney transplantation[J]. Transplant Proc, 2013, 45(4): 1644-1647.
[2]Flechner SM, Gurkan A, Hartmann A, et al. A randomized, open-label study of sirolimus versus vyclosporine in primary de novo renal allograft recipients[J]. Transplantation, 2013, 95(10): 1233-1241.
[3]崔福德. 药剂学[M]. 北京: 人民卫生出版社, 2011: 301-307.
[4]魏静, 徐国旭, 龚铠, 等. 雷帕霉素眼膏的制备及其含量测定[J]. 中国现代医药杂志, 2010, 6(12): 11-14.
[5]刘春艳. 尼美舒利栓剂和中空栓剂研制及其药代动力学研究[D]. 石家庄: 河北医科大学, 2003.
[6]Kauss T, Gaubert A, Boyer C, et al. Pharmaceutical development and optimization of azithromycin suppository for paediatric use[J]. Int J Pharm, 2013, 441(1-2): 218-226.
[7]国家药典委员会. 中华人民共和国药典(二部) [M]. 北京: 化学工业出版社, 2010: 附录.
(本文编辑:吴健敏)
Preparation and quality evaluation of rapamycin suppository
ZHU Yanlin1, FU Hongxing1, ZHOU
Weizhong2, WU Lanlan2, LIU Chengyang1, ZHU Dan1, LI Hui1, LI Xiaokun1.1.School of Pharmacy, Wenzhou Medical University, Wenzhou, 325035; 2.Yiwu Chinese Medicine Hospital, Jinhua, 322000
Objective: To prepare rapamycin suppository, and to evaluate its quality.Methods:Rapamycin was used as active ingredient, polyethylene glycol 2000 and polyethylene glycol 4000 were used as main substrates. The suppositories were made using hot melt process method, and the drug content, weight difference, melting time, drug release with time were evaluated.Results:Polyethylene glycol suppository with rapamycin appeared white and translucent. Good hardness could be maintained at room temperature. The drug content, weight variation and melting time limit matched the requirements for the suppository. More than 75% of the loaded drug in the suppositories was released at about 25 min in the medium.Conclusion:This preparation of rapamycin polyethylene glycol (PEG) suppository can reach the quality requirements of Chinese pharmacopoeia, and may be developed as a new formulation of rapamycin.
rapamycin; polyethylene glycol; suppository; quality evaluation
R944
B
1000-2138(2014)02-0148-03
2013-07-04
国家自然科学基金资助项目(81071277);浙江省自然科学基金资助项目(Y 2 0 80 9 1 5);义乌市科技攻关项目(13-3-28)。
朱雁林(1989-),男,安徽铜陵人,硕士生。
李校堃,教授,Email:xiaokunli@163.com。
