年龄与线粒体DNA A1555G突变所致的听力损失关系的研究
2014-03-23王延藏张琼敏朱翌
王延藏,张琼敏,朱翌
(1.温州医科大学,浙江 温州 325035;2.温州医科大学附属第一医院 耳鼻咽喉科,浙江 温州 325015)
·论 著·
年龄与线粒体DNA A1555G突变所致的听力损失关系的研究
王延藏1,张琼敏2,朱翌2
(1.温州医科大学,浙江 温州 325035;2.温州医科大学附属第一医院 耳鼻咽喉科,浙江 温州 325015)
目的:分析线粒体DNA A1555G突变致聋的患者其发病年龄及病程长短与听力损失是否有相关性,为临床上预测其病情发展提供依据。方法:将154例线粒体DNA A1555G突变致聋的患者,按其发病年龄分为三组(≤1岁,>1岁且≤3岁,>3岁),分别对各组耳聋患者的听力损失程度进行统计学分析;将156例患者按其病程长短分为三组(≤10年,>10年且≤20年,>20年),分别对各组耳聋患者的听力损失程度进行统计学分析。结果:发病年龄≤1岁和>1岁且≤3岁的患者,其听力损失为极重度的所占比例较高(分别为85.7%和72.2%)(P=0.000);病程长短为>10年且≤20年及>20年的患者,其听力损失为极重度的所占比例较高(分别为74.1%和70.3%)(P=0.000)。结论:线粒体DNA A1555G突变致聋的患者,其听力损失与发病年龄、病程长短有关,发病越早,病程越长,其听力损失越重,发病越晚,病程越短,其听力损失越轻。
听力损失;线粒体;A1555G基因突变;年龄
耳聋是人类的常见疾病之一,给语言学习及交流带来障碍,严重影响人类的生活质量。遗传因素和环境因素均可引起耳聋,研究发现每1 000个新生儿中就有1个是耳聋患儿,而其中约有一半患儿的耳聋是由遗传因素引起的[1]。在一些国家,线粒体DNA突变是导致感音神经性耳聋的重要原因之一,而这些突变多数发生在线粒体12S rRNA和tRNA基因上[2-3]。A1555G突变是线粒体12S rRNA基因上最常见的致聋相关突变,然而携带该突变者听力可表现为正常以及不同程度的损失。研究表明,氨基糖甙类药物、核修饰基因及线粒体单体型等与线粒体A1555G突变所致听力损失有关[4-6],那么年龄是否也与其有关?随着年龄的增长,线粒体A1555G突变所致的听力损失是否也随之改变?为此,我们对线粒体A1555G突变所致耳聋患者的听力损失程度及年龄进行了相关性研究。
1 对象和方法
1.1 对象自2005年7月至2013年6月间在温州医科大学附属第一医院耳鼻咽喉科确诊为除外合并有急性或慢性中耳炎、晚期梅尼埃病、听神经瘤、脑膜脑炎、药物、外伤等有明确原因致聋的耳聋,并在浙江省医学遗传学重点实验室检测出携带有线粒体A1555G突变的耳聋患者。经筛选共有156例符合要求,其中男76例,女80例,年龄7~68岁,平均26.4岁。以上受检者在检查前均按照温州医科大学伦理委员会管理规定签署知情同意书。
1.2 方法
1.2.1 线粒体全基因组突变分析:采集患者静脉外周血,使用Universial DNA分离试剂盒[购自宝生物工程(大连)有限公司]提取血液基因组DNA,以此为模板PCR扩增含有整个线粒体12S rRNA基因片段,引物位于mtDNA 618-635(正向)和1988-2007(正向)[7]。在PCR产物经过纯化后,用BigDye末端循环测序反应试剂盒在ABI 3700 DNA自动测序仪上直接测序,将测序结果与经过校正的剑桥标准序列(GenBank:NC_001807)进行比对[8]。
1.2.2 纯音测听:采用经零级校正的丹麦Madsen Voyager 502型听力计,在本地噪声低于25 dB的测听室内,按照标准纯音测听步骤对受试者进行听力测试。使用退10进5的方法,每个频率重复3次,其中有2次刚好能听到测试声处所对应的声音强度即为该频率听阈。PTA采用WHO-1997标准,以500 Hz、1 000 Hz、2 000 Hz和4 000 Hz的平均听阈为准,听力损失26~40 dB为轻度聋,41~60 dB、61~80 dB和>81 dB依次为中度聋、重度聋和极重度聋。气导听阈≤25认为其听力正常。双侧耳聋的听力损失程度不同时,以听力损失较轻的一侧为准。
1.3 统计学处理方法使用PASW Statistics 18.0统计学软件,利用卡方检验分别对线粒体A1555G突变耳聋患者的听力损失程度在不同发病年龄及病史时间组中的构成比进行统计学分析。P<0.05为差异有统计学意义。
2 结果
将154例线粒体A1555G突变致聋的患者按其发病年龄分为三组(≤1岁,>1岁且≤3岁,>3岁),分别对各组耳聋患者的听力损失程度进行统计学分析(见表1)。其中,发病年龄是患者及其家人发觉其耳聋,并行客观听力学检查确诊为耳聋,或某些轻度听力损失患者主观上未感觉听力损失,但患者接受客观听力学检查时发现耳聋的时间。
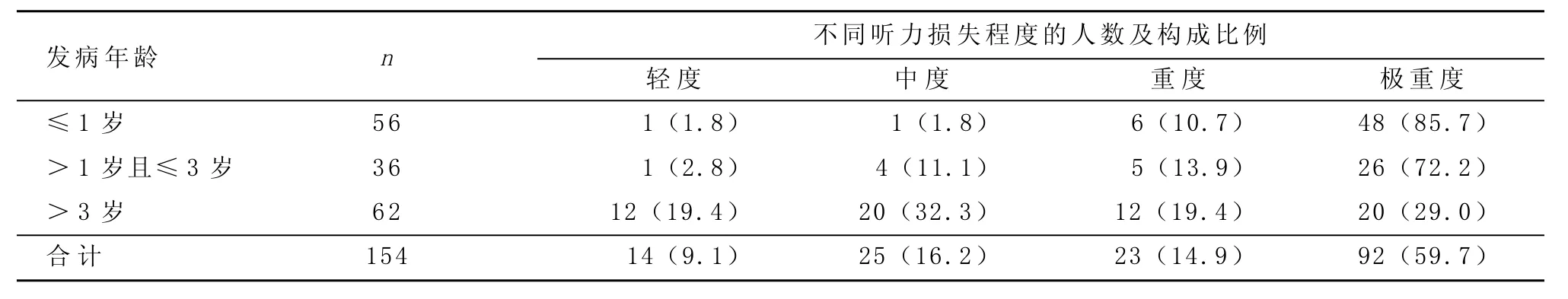
表1 发病年龄对听力损失程度的影响 [n(%)]
如表1显示,在线粒体A1555G突变致聋的患者中,大部分患者的听力损失程度为极重度(占59.7%),0~3岁发病的患者,极重度耳聋所占比例高于72.2%。由表1我们可以看出,不同发病年龄段的听力损失程度的构成比不同,差异具有统计学意义(x2=48.195,P=0.000),因此,对于线粒体A1555G突变致聋的患者,其发病年龄与听力损失程度具有相关性,发病年龄越小,其听力损失程度越重。
经过筛查,所研究的耳聋患者中,有病程时间及听力损失程度的共有156例,我们将这156例耳聋患者按其病程长短分为下列三组:≤10年,>10年且≤20年,>20年,然后分别对各组耳聋患者的听力损失程度进行统计学分析(见表2)。其中,病程是首次客观听力学检查发现患者耳聋至本研究中进行听力学检查的时间。
如表2所示,病程有10年以上的,其听力损失程度以极重度占多数(所占比例高于70.3%),其次依次为重度、中度、轻度听力损失。不同病程组中,其听力损失程度的构成比不同,差异有统计学意义(x2=40.468,P=0.000),所以我们可得知线粒体A1555G突变致聋的患者,其病程长短与听力损失程度有相关性,病史越长,其听力损失程度越重,因此线粒体A1555G突变所致的听力损失是呈渐进性的。
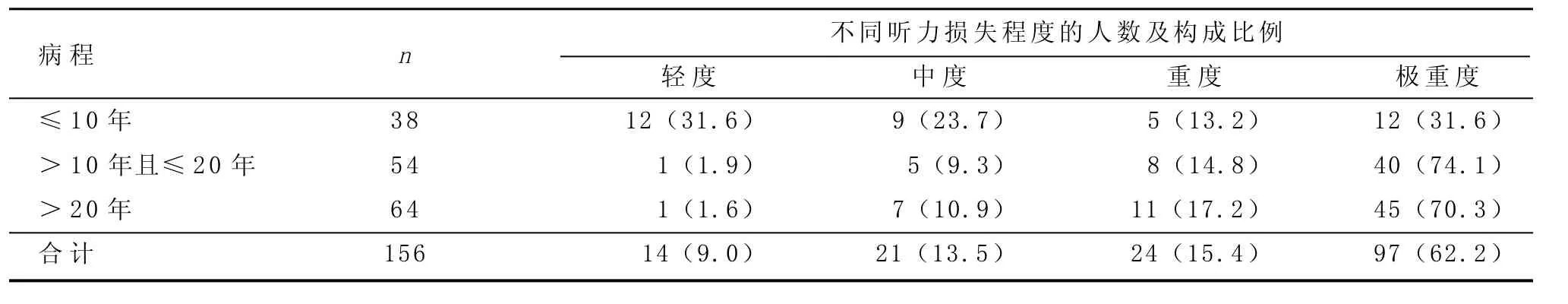
表2 病程对听力损失程度的影响 [n(%)]
3 讨论
A1555G突变是线粒体12S rRNA基因上最常见的致聋相关突变,可导致线粒体蛋白质合成异常并随之引起细胞的呼吸功能异常,进一步引发耳聋。然而携带A1555G突变的个体其听力变化范围较大,有些表现为正常,有些则表现为从轻度到极重度的听力损失,这表明线粒体A1555G突变本身并不足以引发耳聋,还有其他一些因素影响其致病性。在以往的研究中,发现氨基糖甙类药物会导致或加重携带线粒体A1555G突变个体的听力损失[9];吕建新等[10]发现在线粒体A1555G突变致聋的患者中,线粒体单体型D所占比例最高,同时也高于正常人群对照组,而线粒体单体型是B的耳聋患者其家族耳聋外显率相对较高,且听力损失相对也较重,这提示线粒体A1555G突变易发生在线粒体单体型D个体中,而线粒体单体型B可导致或加重携带线粒体A1555G突变个体的听力损失。然而对年龄与线粒体A1555G突变所致的听力损失相关性方面的研究甚少。本研究中我们发现线粒体A1555G突变所致的耳聋多数为极重度耳聋,占59.7%,尤其是发病年龄在≤1岁,>1岁且≤3岁的,其听力损失程度为极重度的所占比例分别高达85.7%和72.2%(见表1),这一结果表明携带线粒体A1555G突变耳聋患者,婴幼儿期出现耳聋的,以后其听力损失多数较重;而发病较晚的,其听力损失相对较轻。因此我们得出这一结论:线粒体A1555G突变致聋的患者,其听力损失程度与发病年龄呈负相关性,即发病越早,其听力损失越重,发病越晚,其听力损失越轻。从表2中我们可以看出,发病10年以上的,其听力损失程度的构成比和发病10年以下的截然不同,发病10年以下的,其听力损失为轻度的占31.6%,极重度占31.6%,而发病10年以上的,其听力损失为轻度的所占比例不到2%,极重度却高达70%以上,表2的结果提示随着时间的推移,线粒体A1555G突变所致的听力损失会越来越严重。综上所述,我们可以得出这一结论:线粒体A1555G突变所致的耳聋患者,其发病越早,病程越长,其听力损失越严重。之所以会出现这一结果,可能是由于以下这些原因:①线粒体是细胞内的动力站,细胞生命活动中需要的能量约有80%来自于线粒体,是细胞进行生物氧化和能量转换的场所。同时,线粒体也是人体内产生自由基的主要场所,线粒体不仅为细胞提供能量,还与细胞凋亡和自由基代谢有密切关系。随着时间的推移,线粒体渐渐开始出现衰老、凋亡,导致其功能缺陷越来越重,能量供给不足,影响细胞的新陈代谢,进而加重其听力损失。②婴幼儿期,患儿的生长发育未完善,免疫力低下,一旦线粒体A1555G突变致病,其结果是严重的;另外,一些患儿是由于服用了氨基糖甙类药物后出现的耳聋,婴幼儿期患儿对药物耐受能力较差,对药物剂量较敏感,抵抗力不足,故病情较重。
本研究不足之处在于:首先,人类正常交流的语言频率为500~3 000 Hz,当其他频率出现听力损失,或患者仅有轻度听力损失时,由于患者所处的地域、患者或家长的重视程度、文化程度等不同,有些患者可能并未发觉自身听力损失,可能在准确的发病年龄上及病程上存在误差;其次,许多患者病史较长,以前的客观听力检查报告单已丢失,我们只通过询问检查发现耳聋的时间,可能存在一定的误差。但是,“线粒体A1555G突变所致的耳聋患者,其发病越早,病程越长,其听力损失越严重”这一结论,可以为临床上粗略预测此类耳聋患者的病情发展趋势提供依据。
[1]Guan MX. Mitochondrial 12S rRNA mutations associated with aminoglycoside ototoxicity[J]. Mitochondrion, 2011,11(2): 237-245.
[2]Pierce SB, Chisholm KM, Lynch ED, et al. Mutations in mitochondrial histidyl tRNA synthetase HARS2 cause ovarian dysgenesis and sensorineural hearing loss of Perrault syndrome[J]. Proc Natl Acad Sci, 2011, 108(16): 6543-6548.
[3]Lu J, Li Z, Zhu Y, et al. Mitochondrial 12S rRNA variants in 1642 Han Chinese pediatric subjects with aminoglycosideinduced and nonsyndromic hearing loss[J]. Mitochondrion, 2010, 10(4): 380-390.
[4]DiMauro S, Davidzon G. Mitochondrial DNA and disease [J]. Annals of medicine, 2005, 37(3): 222-232.
[5]Guan MX, Fischel-Ghodsian N, Attardi G. Nuclear background determines biochemical phenotype in the deafnessassociated mitochondrial 12S rRNA mutation[J]. Hum Mol Genet, 2001, 10(6): 573-580.
[6]Kong QP, Bandelt HJ, Sun C, et al. Updating the East Asian mtDNA phylogeny: a prerequisite for the identification of pathogenic mutations[J]. Hum Mol Genet, 2006, 15(13): 2076-2086.
[7]Li RH, Xing GQ, Yan M, et al. Cosegregation of C-insertion at position 961 with the A1555G mutation of the mitochondrial 12S rRNA gene in a large Chinese family with maternally inherited hearing loss[J]. Am J Med Genet, 2004, 124(2): 113-117.
[8]Young WY, Zhao LD, Qian YP, et al. Extremely low penetrance of hearing loss in four Chinese families with the mitochondrial 12S rRNA A1555G mutation[J]. Biochem Bioph Res Co, 2005, 328(4): 1244-1251.
[9]伍越, 郑静, 郑斌娇, 等. 氨基糖苷类抗生素耳毒性的保护和修饰[J]. 中华耳科学杂志, 2012, 10(2): 260-269.
[10]Lu J, Qian Y, Li Z, et al. Mitochondrial haplotypes may modulate the phenotypic manifestation of the deafnessassociated 12S rRNA 1555A>G mutation[J]. Mitochondrion, 2010, 10(1): 69-81.
(本文编辑:吴健敏)
Study on the relationship between age and hearing loss induced by mtDNA A1555G mutation
WANG
Yancang1, ZHANG Qiongmin2, ZHU Yi2.1.Wenzhou Medical University, Wenzhou, 325035; 2.Department of Otorhinolaryngology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To analyze the relevance among patient’s age of onset, duration of disease and their hearing loss whose deafness was caused by the mitochondrial DNA A1555G mutation, to provide a basis for predicting the progression of their disease.Methods:One hundred and fifty-four patients were divided into three groups according to their age of onset (≤1, >1 and≤3, >3), to analyze the degree of their hearing loss with statistical separately;and 156 patients were divided into three groups according to their duration of disease (≤10, >10 and≤20, >20), to analyze the degree of their hearing loss with statistical separately too.Results:The patients whose age of onset was under age 1 and between 1 and 3 years old had severe hearing loss in a high proportion (respectively 85.7% and 72.2%) (P=0.000); the patients, duration of disease was between 10 and 20 years and more than 20 years had severe hearing loss in a high proportion (respectively 74.1% and 70.3%) (P=0.000).Conclusion:The patient’s age of onset, duration of disease and their hearing loss whose deafness is caused by the mitochondrial DNA A1555G mutation are relevant, the earlier onset and longer duration, the more severe hearing loss, on the contrary, the less.
hearing loss; mitochondria; A1555G mutation; age
R764.43
A
1000-2138(2014)02-0083-04
2013-10-10
国家自然科学基金资助项目(810 7079 4)。
王延藏(1984-),女,河南南阳人,硕士生。
朱翌,主任医师,副教授,硕士生导师,Em ai l:otomito@gmail.com。
