14-3-3γ表达载体的构建及其对子宫肌瘤细胞增殖和凋亡的影响
2014-03-23沈奇张文文陶雪娇段萍朱雪琼
沈奇,张文文,陶雪娇,段萍,朱雪琼
(温州医科大学附属第二医院 妇产科,浙江 温州 325027)
·论 著·
14-3-3γ表达载体的构建及其对子宫肌瘤细胞增殖和凋亡的影响
沈奇,张文文,陶雪娇,段萍,朱雪琼
(温州医科大学附属第二医院 妇产科,浙江 温州 325027)
目的:构建一种稳定、高表达的14-3-3γ基因真核表达质粒载体,并探索其抗子宫肌瘤的作用。方法:提取子宫肌瘤细胞总RNA,反转录后通过RT-PCR扩增14-3-3γ,并将扩增的目的基因片段插入pCMVN-Flag真核表达质粒,构建重组质粒14-3-3γ-pCMV-N-Flag,重组体经限制性内切酶酶切分析及测序鉴定后,用脂质体转染技术导入子宫肌瘤细胞。应用Western Blot法检测14-3-3γ蛋白的表达,应用CCK-8检测细胞增殖变化,应用Annexin V-FITC/PI双染色法经流式细胞术检测细胞凋亡。结果:①构建的14-3-3 γ-pCMV-N-Flag真核表达载体经酶切后电泳和DNA测序,显示载体构建正确;②子宫肌瘤细胞转染重组体后的14-3-3γ表达明显高于转染前(P<0.05);③子宫肌瘤细胞转染重组体后,细胞增殖抑制率为52.90%(P<0.05);④转染重组体后肌瘤细胞的凋亡率明显高于转染前(P<0.05)。结论:本研究成功构建14-3-3γ-pCMV-N-Flag真核表达质粒载体,14-3-3γ在子宫肌瘤细胞内高表达后可抑制细胞的增殖和促进细胞凋亡。
子宫肌瘤;载体构建;增殖;凋亡
14-3-3蛋白是一类高度保守的酸性蛋白家族,目前已发现14-3-3蛋白在哺乳动物中有七种亚型,分别为:β、γ、ε、η、ζ、σ和τ。该蛋白能够与细胞内200多种蛋白质结合,参与细胞信号传导、周期调控、凋亡、分化、恶性转化、迁移等多种细胞生命活动,在肿瘤的发生发展中发挥多方面的作用[1]。
子宫肌瘤是女性生殖器官最常见的肿瘤,虽是良性肿瘤,却是导致生育年龄妇女子宫切除的首位原因[2],严重危害了妇女的生殖健康。在我们的前期研究中,率先应用双向凝胶电泳和电喷雾串联质
谱技术研究子宫肌瘤和周围正常肌层组织的差异蛋白质,并采用RT-PCR技术和免疫印迹(Western Blot)法进一步验证,发现14-3-3 γ在子宫肌瘤中的表达明显低于正常子宫肌层组织[3],但14-3-3 γ在子宫肌瘤发生发展中的具体作用机制尚不明确。为此,本研究拟通过质粒转染技术,构建人子宫肌瘤14-3-3γ高表达载体,探讨14-3-3 γ对子宫肌瘤细胞增殖、凋亡的影响,为治疗子宫肌瘤提供新思路和实验依据。
1 材料和方法
1.1 材料
1.1.1 子宫肌瘤和质粒:标本取自2012年4月至2013年4月本院妇科因子宫肌瘤而住院行子宫全切或次全切除术的患者共10例。术后病理证实为普通型平滑肌瘤。本研究经本院伦理委员会批准,每例纳入实验的患者均签署知情同意书。空载体pCMV-NFlag购自碧云天生物技术有限公司。
1.1.2 工具酶及主要试剂:内切酶BamHI、EcoRI及T4 DNA连接酶均购自美国Thermo公司。PCR产物纯化试剂盒及质粒大提试剂盒购自美国Generay公司。反转录试剂盒、Lipofectamin 2000及Annexin VFITC/PI凋亡试剂盒购自美国Invitrogen公司。 II型胶原酶、DMEM培养基购自美国Gibco公司。鼠抗人14-3-3γ一抗购自美国Santa Cruz公司。CCK-8试剂购自日本同仁化学研究所。
1.1.3 引物:根据GenBank数据库中14-3-3γ的全基因组序列,利用Primer Premier 5.0软件设计有酶切位点的上、下游引物,由上海桑尼生物科技有限公司合成。14-3-3 γ基因引物序列为,上游:5’-CGCGGATCC ATGGTGGACCGCGAGCAACTG-3’(BamHI),下游:5’-CCGGAATTC TTAATTGTTGCCTTCGCCGC-3’(EcoRI),加线部分分别为BamHI和EcoRI酶切位点。
1.2 方法
1.2.1 重组14-3-3γ载体的构建:①14-3-3γ基因的获得:提取子宫肌瘤细胞总RNA。按反转录试剂盒提供的方法合成14-3-3 γcDNA第l链,然后以cDNA为模板,扩增14-3-3γ基因片段。PCR反应条件:扩增14-3-3γ基因片段,94 ℃预变性2 min;94 ℃变性20 s,60 ℃退火30 s,68 ℃延伸l min,35个循环;68 ℃终延伸4 min,产物进行电泳分析。②14-3-3γ基因与pCMV-N-Flag质粒的连接:纯化PCR产物,双酶切PCR产物和pCMV-N-Flag质粒,去磷酸化,用T4 DNA连接酶连接,将连接产物转化感受态大肠埃希菌DH5α,然后进行抗生素筛选,摇菌,提取质粒,酶切鉴定,测序鉴定。
1.2.2 人子宫肌瘤细胞原代培养:①术中无菌操作取子宫肌瘤组织约2 cm3,立即置于冰浴的DMEM中,迅速送至实验室。②无菌PBS和DMEM培养基反复冲洗,剪碎后加入含0.2%的I I型胶原酶的DMEM培养基,于37 ℃振荡消化3~5 h。 ③加完全培养基终止消化,1 000 r/min离心5 min,弃上清液,再次加完全培养基,1 000 r/min离心5 min,弃上清液。 ④再加入适量完全培养基,轻轻吹打成细胞悬液,以2×105个/mL密度接种,置37 ℃、饱和湿度、5% CO2环境下培养,隔天换液,5~7 d以1:2传代。
1.2.3 细胞转染:①细胞培养:取6孔培养板,向每孔中加入2 mL含1×105~2×105个细胞培养液,37 ℃ CO2培养至40%~60%融合。②转染液制备:在EP管中制备以下两液(为转染每一个孔细胞所用的量)。A液:用不含血清培养基稀释1~10μ g DNA,终量100 μL;B液:用不含血清培养基稀释2~10 μL脂质体(Lipofectamine 2000),终量100μL。轻轻混合A、B液,室温中置15~20 min。③转染准备:用2 mL不含血清培养液漂洗两次,再加入2 mL不含血清培养液。④转染:把A/B复合物缓缓加入培养液中,摇匀,37 ℃温箱置6 h,吸除无血清转染液,换入正常培养液继续培养。
1.2.4 Western Blot法检测14-3-3γ蛋白的表达:①用细胞裂解液裂解细胞,二喹啉甲酸法(BCA法)测定蛋白含量。②用12% SDS-PAGE(15μ L/道)将蛋白质电转移到聚偏二氟乙烯(pol-yvinylidene fluoride,PVDF)膜上,5%脱脂奶粉封闭后,加入一抗(14-3-3γ,1:1 000;内参Tubulin,1:2 000),4 ℃过夜。③TBST洗膜15 min×3次,加入辣根过氧化物酶标记的二抗孵育2 h,TBST洗膜15 min ×3次,ECL试剂与膜作用1 min后,用美国Bio-Rad公司的图像摄取系统保存图像并分析。④计算14-3-3 γ与Tubulin产物吸光度积分的比值,作为14-3-3γ蛋白的表达水平。每例实验重复3次,取平均值。
1.2.5 CCK-8检测细胞增殖:①在96孔板中分三组,第一组、第二组每孔均配置100μ L的子宫肌瘤细胞悬液,细胞数为5 000个/100μ L,第三组每孔仅配置不含细胞的培养基。将培养板在培养箱预培养(37 ℃,5% CO2)24~48 h,至细胞80%融合。采用脂质体转染技术,向第一组、第二组细胞分别转染重组体和空载体,继续培养24 h。②向每孔加入10μL CCK-8溶液。③将培养板在培养箱内孵育4 h。用酶标仪测定在450 nm处的吸光度。每组设5个复孔,独立实验重复3次,取均值。
1.2.6 Annexin V-FITC/PI双染色法经流式细胞术检测细胞凋亡:①用不含EDTA的胰酶消化收集子宫肌瘤细胞,离心,微量离心机转速1 000 r/min,离心时间5 min,弃培养基。②用预冷的磷酸盐缓冲液洗涤细胞两次(1 000 r/min,离心5 min收集细胞)。③用400 μL 1×Binding Buffer悬浮细胞,浓度大约为1×106cells/mL。④在细胞悬浮液中加入5μL Annexin V-FITC和1μL 100μ g/mL PI轻轻混匀后于2~8 ℃避光条件下孵育15 min。⑤在1 h内用流式细胞仪检测。每组设3个重复样本,独立实验重复3次,取均值。
1.3 统计学处理方法采用SPSS17.0统计软件对数据进行统计学分析。各组资料均为正态分布资料,因此数据以±s表示。两组均数间比较采用配对t检验。多均数比较采用方差分析,均数间两两比较采用LSD-t法。P<0.05表示差异有统计学意义。
2 结果
2.1 重组质粒14-3-3γ-pCMV-N-Flag的构建与鉴定
重组14-3-3γ-pCMV-N-Flag经EcoRI单酶切后可见约5 048 bp长度的片段,与重组基因长度相符,经BamHI/EcoRI双酶切后电泳可见约745 bp和4 303 bp长度的片段,与目的基因和空载体长度相符,见图1。委托上海英俊生物有限公司对重组基因从正反两个方向进行测序,通过Blast软件分析测序结果,证实插入片段为14-3-3γ扩增片段,且插入方向正确,截取部分正向链和反向链序列图,见图2。
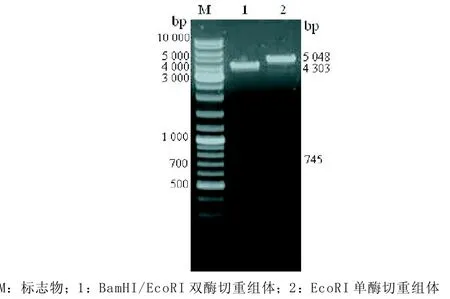
图1 单酶切与双酶切14-3-3γ-pCMV-N-Flag的鉴定结果
图2 截取部分基因测序的正向链和反向链序列图
2.2 转染后子宫肌瘤细胞14-3-3 γ蛋白表达的变化
采用脂质体转染技术,将重组质粒14-3-3 γ-pCMVN-Flag转入体外原代培养的子宫肌瘤细胞,36 h后提取细胞蛋白,检测14-3-3γ蛋白表达水平,经t检验,差异有统计学意义(P<0.05),转染后14-3-3γ蛋白表达水平较转染前升高,表明转染成功,见图3。

图3 Western Blot法检测子宫肌瘤细胞转染前后14-3-3γ蛋白表达的变化
2.3 转染后子宫肌瘤细胞增殖的变化子宫肌瘤细胞转染14-3-3 γ-pCMV-N-Flag体外培养24 h后,细胞增殖抑制率为52.90%(P<0.05)。表明14-3-3γ经转染在子宫肌瘤细胞内表达增高后,有抑制肌瘤细胞增殖的作用。
2.4 转染后子宫肌瘤细胞凋亡的变化图4为重组体转染子宫肌瘤细胞后的双变量流式细胞仪的散点图,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。经统计,未转染的子宫肌瘤细胞有0.201±0.011处于凋亡状态,转染空载体的细胞有0.325±0.009处于凋亡状态,转染重组体的细胞有0.394±0.010处于凋亡状态。与未转染组相比,转染重组体与转染空载体的子宫肌瘤细胞的凋亡率明显增高,差异有统计学意义(P<0.01)。转染重组体子宫肌瘤细胞的凋亡率明显高于转染空载体组(P<0.01),表明转染14-3-3γ重组体后,子宫肌瘤的细胞凋亡率增高。

图4 流式细胞仪检测重组体转染后子宫肌瘤细胞的凋亡情况
3 讨论
近年来,子宫肌瘤患病率有逐年增加的趋势[2,4]。其发生与雌、孕激素密切相关[5],但其发生发展的分子机制尚未明确。因此,深入探讨子宫肌瘤发生发展的分子机制,将为有效治疗子宫肌瘤提供新思路和实验依据。
14-3-3蛋白与肿瘤发生发展的关系近年来受到学者们的重视,包括其与乳腺癌、卵巢癌的复发和转移之间的相关性[6-7]。国外学者采用质粒转染技术研究14-3-3β和14-3-3ζ对细胞功能和肿瘤细胞生物学行为的影响[8-9]。在我们的前期研究中,采用差异蛋白质组学技术发现14-3-3γ在子宫肌瘤中的表达明显低于正常子宫肌层组织[3],但14-3-3γ在子宫肌瘤发生发展中的作用尚未明确。
因此,本实验首先将目的基因构建在真核细胞表达载体pCMV-N-Flag,成功构建重组质粒14-3-3 γpCMV-N-Flag。经限制性核酸内切酶酶切鉴定和DNA测序证实目的基因14-3-3γ序列正确,目的基因正确地构建在多克隆位点BamH I、EcoRI之间,开放阅读框架正确。然后将重组质粒转染到原代培养的子宫肌瘤细胞,用Western Blot法检测转染效果,结果显示转染后细胞的14-3-3 γ蛋白表达明显增高。子宫肌瘤细胞转染14-3-3γ重组质粒使细胞高表达14-3-3 γ后,细胞增殖明显被抑制,而细胞凋亡率明显增加,说明14-3-3 γ有抑制子宫肌瘤细胞增殖和促进细胞凋亡的作用。本实验为进一步研究14-3-3γ的抗子宫肌瘤的作用及其相关的信号传导通路奠定了基础,也为有效治疗子宫肌瘤提供了新思路和实验依据。
[1]Tzivion G, Gupta VS, Kaplun L, et al. 14-3-3 proteins as potential oncogenes[J]. Semin Cancer Biol, 2006, 16(3): 203-213.
[2]Nierth-Simpson EN, Martin MM, Chiang TC, et al. Human uterine smooth muscle and leiomyoma cells differ in their rapid 17 beta-estradiol signaling: implications for proliferation[J]. Endocrinology, 2009, 150(5): 2436-2445.
[3]Lv JQ, Zhu XQ, Dong K, et al. Reduced expression of 14-3-3 gamma in uterine leiomyoma as identified by proteomics [J]. Fertil Steril, 2008, 90(5): 1892-1898.
[4]金慧佩, 余方芳, 赵雅萍, 等. 不同因素对子宫肌瘤HIFU治疗疗效影响的初步分析[J]. 温州医学院学报, 2013, 43(6): 379-382.
[5]Hoekstra AV, Sefton EC, Berry E, et al. Progestins activate the AKT pathway in leiomyoma cells and promote survival [J]. J Clin Endocrinol Metab, 2009, 94(5): 1768-1774.
[6]Bergamaschi A, Frasor J, Borgen K, et al. 14-3-3ζ as a predictor of early time to recurrence and distant metastasis in hormone receptor-positive and -negative breast cancers [J]. Breast Cancer Res Treat, 2013, 137(3): 689-696.
[7]Ravi D, Chen Y, Karia B, et al. 14-3-3σ expression effects G2/M response to oxygen and correlates with ovarian cancer metastasis[J]. PLoS One, 2011, 6(1): e15864.
[8]Park SG, Jung S, Ryu HH, et al. Role of 14-3-3-beta in the migration and invasion in human malignant glioma cell line U87MG[J]. Neurol Res, 2012, 34(9): 893-900.
[9]Kao GS, Chuang JY, Cherng CF, et al. Accumbal 14-3-3ζ protein downregulation is associated with cocaine-conditioned memory[J]. Neurosignals, 2011, 19(4): 175-188.
(本文编辑:吴健敏)
Construction of a 14-3-3γ expression vector and its effect on proliferation and apoptosis of uterine lei-
omyoma cells
SHEN Qi, ZHANG Wenwen, TAO Xuejiao, DUAN Ping, ZHU Xueqiong.Department of
Obstetrics and Gynecology, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To construct stably and highly expressing 14-3-3γ gene eukaryotic expression plasmid vector and to explore its antitumor effects on uterine leiomyoma cells in vitro.Methods:The total RNA was isolated from the uterine leiomyoma cells. After reverse transcription reaction, 14-3-3γ was amplified by RTPCR. The PCR product was cloned into the eukaryote expression vector pCMV-N-Flag, the resulted recombinant was designated as 14-3-3γ-pCMV-N-Flag. After sequence determination, the recombinant vector was transfected into uterine leiomyoma cells by lipofectin. The expression of the interesting protein was confirmed by Western Blot analysis. Cell proliferation was assessed by cell counting kit-8 assay and the percentage of apoptotic cells detected by annexinV-FITC/PI double-staining was determined by flow cytometry.Results:①The 14-3-3γ gene eukaryotic expression vector was successfully constructed and identified by sequencing. ②The expression level of 14-3-3γ protein was increased obviously after transfection (P<0.05). ③The inhibitory effect on the rate of cell proliferation was 52.90% after transfection (P<0.05). ④After transfection, the percentage of apoptotic cells was increased obviously (P<0.05).Conclusion:The 14-3-3γ-pCMV-N-Flag gene eukaryotic expression plasmid vector is successfully constructed which could suppress proliferation and induce apoptosis of uterine leiomyoma cells.
uterine leiomyoma; vector construction; proliferation; apoptosis
R711.74
A
1000-2138(2014)02-0079-04
2013-10-10
国家自然科学基金资助项目(811 7192 6)。
沈奇(1987-),男,浙江丽水人,博士生。
朱雪琼,教授,主任医师,博士生导师,Ema il:zjwzzxq@163.com。
