腺苷A1受体基因多态性与浙南汉族人群部分性发作癫痫耐药的相关性
2014-03-23徐惠琴欧福勇那仁满都拉涂东佩郑荣远陈江帆陈必成陈玉军
徐惠琴,欧福勇,那仁·满都拉,涂东佩,郑荣远,陈江帆,陈必成,陈玉军
(1.温州医科大学附属第一医院 神经内科,浙江 温州 325015;2.郴州市第一人民医院 神经内科,湖南 郴州 423000;3.温州医科大学附属眼视光医院,浙江 温州 325027;4.温州医科大学附属第一医院 移植科,浙江 温州 325015)
·论 著·
腺苷A1受体基因多态性与浙南汉族人群部分性发作癫痫耐药的相关性
徐惠琴1,欧福勇2,那仁·满都拉1,涂东佩1,郑荣远1,陈江帆3,陈必成4,陈玉军1
(1.温州医科大学附属第一医院 神经内科,浙江 温州 325015;2.郴州市第一人民医院 神经内科,湖南 郴州 423000;3.温州医科大学附属眼视光医院,浙江 温州 325027;4.温州医科大学附属第一医院 移植科,浙江 温州 325015)
目的:探讨腺苷A1受体(A1AR)基因rs903361、rs10920573及rs3766553多态性与浙南汉族人群部分性发作癫痫耐药的相关性。方法:选取120例部分性发作癫痫患者(癫痫耐药组和非耐药组各60例)及正常对照组(正常组)60例。采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP) 法检测A1AR基因rs903361、rs10920573和rs3766553的多态性,并通过病例对照研究及logistic回归分析方法分析其与癫痫耐药的相关性。结果:所有入组人群三个位点等位基因C和T分布,正常组与非耐药组三个位点各基因型分布差异均无统计学意义;耐药组rs903361 CT型分布频率低于非耐药组(P=0.017),而rs10920573 CT型分布频率高于非耐药组(P=0.010),差异均具有统计学意义;rs3766553基因型分布各组差异均无统计学意义;rs903361 CC型、TT型耐药的危险性分别为CT型的2.730倍和2.609倍,P值分别为0.043和0.047;rs10920573的CT型耐药危险性为TT型的2.572倍(P=0.036);rs903361 CC型、rs903361 TT型、rs10920573 CT型均为耐药的独立危险因素。结论:A1AR基因的rs903361 CC型、TT型和rs10920573 CT型为浙南汉族人群部分性发作癫痫耐药产生的独立危险因素。
多态性,单核苷酸;癫痫;耐药;腺苷A1受体
癫痫是神经科仅次于脑卒中的第二大常见疾病,主要通过药物治疗,现约有30%的患者表现为耐药性癫痫。部分性发作癫痫作为人类最常见的癫痫类型,其耐药性比例最高[1]。癫痫耐药性的形成是一个多因素过程,其中与遗传方面的因素密切相关[2]。腺苷是在中枢神经系统神经元活动中起主要抑制作用的一个神经调质,可通过腺苷A1受体(adenosine A1 receptor,A1AR)抑制癫痫发作和发挥神经保护等作用[3]。Wagner等[4]研究发现A1AR基因型变异可增加脑外伤后癫痫的发病率。由于腺苷系统的缺陷或功能改变都有可能加剧癫痫的发作,因此其可能成为部分癫痫患者耐药的原因。为此笔者参考了Wagner等[4]研究中位点的选择,分析A1AR基因rs903361、rs10920573及rs3766553多态性与部分性发作癫痫耐药的相关性。
1 对象和方法
1.1 研究对象自2010年1月-2011年12月间温州医科大学附属第一医院神经内科癫痫门诊随访的部分性发作癫痫患者,且均已在本门诊经正规抗癫痫治疗2年及以上,共120例。病例入选标准:①浙南汉族人;②年龄18~80岁;③经临床和脑电图确诊,依照1981年国际抗癫痫联盟关于发作分类诊断标准诊断为部分性发作;④正规抗癫痫治疗2年及以上者,且用药剂量在有效范围内或已达常用最大剂量。排除标准:①有酒精相关性癫痫病史;②同时服用以下任何药物:抗肿瘤药物、细胞毒性药物、类固醇化合物等;③患有严重器质性病变如缺血性心脏病、肝肾功能不全等;④患有任何进展性疾病如肿瘤;⑤患有进展性中枢神经系统疾病。耐药组:符合王学峰等[5]关于耐药性癫痫的诊断:经正规抗癫痫治疗后发作频率仍为4次/月或以上者。非耐药组:同等情况下,治疗有效未发作达2年及以上。共收集耐药组60例:女34例,男26例,年龄21~42岁,平均(31.5±10.32)岁;非耐药组60例:女33例,男27例,年龄22~42岁,平均(32.02±9.91)岁;正常对照组(正常组60例)为性别、年龄与病例组匹配的同期健康体检的随机个体,其中男26例,女34例,年龄21~42岁,平均(31.48±10.23)岁。三组入选对象的籍贯均为浙江省南部地区,年龄、性别差异无统计学意义。
1.2 主要试剂人全血基因组DNA提取试剂盒、Tap plus DNA Polymerase聚合酶套装(北京天根生化科技有限公司),PCR引物(上海捷瑞生物科技有限公司),限制性内切酶(Fermentas公司和New England Biolabs公司)。
1.3 方法
1.3.1 资料收集:记录癫痫患者一般临床资料及各种耐药的可能危险因素,包括:性别、年龄、首次发作年龄、病程、发作类型、发作频率、目前及既往用药情况(用药种类、剂量、开始服药时间)、生产史、头部外伤史、热性惊厥史、中枢神经系统感染史、家族史、脑部器质性病变史、吸烟、饮酒史等。
1.3.2 实验方法:采用人全血基因组提取试剂盒提取经乙二胺四乙酸(EDTA)抗凝处理的外周静脉血DNA,应用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法进行基因分型,对含rs903361、rs10920573和rs3766553多态位点的基因片段进行PCR扩增,引物序列如下:rs3766553上游:5’-CAATCT AGCCAGCAGCCATC-3’,下游:5’-CGAGACAGACTTTAAGCA TCATCA-3’;rs903361上游:5’-GGGCAGAAAGTGAATGA GC-3’,下游:5’-CGGAAGTCCTCCCACGA-3’;rs10920573上游:5’-CAGCCTGGTCTCAAACTCC-3’,下游:5’-CCT TCTTGCCCGTGGTA-3’。分别采用限制性内切酶ScaI、BsrI、Hpy166I进行酶切,琼脂糖凝胶电泳,EB染色后,紫外线凝胶成像仪判断基因型并摄像。随机抽取3个位点9种基因型共18例进行测序验证。
1.4 统计学处理方法应用SPSSl8.0统计软件进行数据处理。采用Hardy-Weinberg遗传平衡定律检验样本的群体代表性。多组计量资料之间比较依据方差齐性与否分别采用单因素方差分析或秩和检验。计数资料用x2检验或Fisher精确检验进行组间比较。采用多因素logistic回归分析基因多态性与耐药性相关性。P<0.05为差异有统计学意义。
2 结果
2.1 耐药组与非耐药组患者耐药危险因素比较两组患者临床资料经x2检验,结果显示耐药组热性惊厥(x2=4.904,P=0.027)、发病至开始服药时间≥1年(x2=4.848,P=0.028)的比例较非耐药组偏高,差异具有统计学意义,其他临床资料之间的差异无统计学意义,提示热性惊厥和发病至开始服药时间≥1年这两项可能为耐药性产生的危险因素,详见表1。

表1 耐药组和非耐药组可能的耐药危险因素比较[n=60,n(%)]
2.2 基因多态性分型
2.2.1 rs903361基因多态性:PCR扩增出612 bp长度的片段,酶切后可产生三种基因型,因6 bp片段太小,电泳后不可见。只有612 bp一条带的为CC型,有372、234 bp两条带的为TT型,有612、372、234 bp三条带的为CT型。见图1。
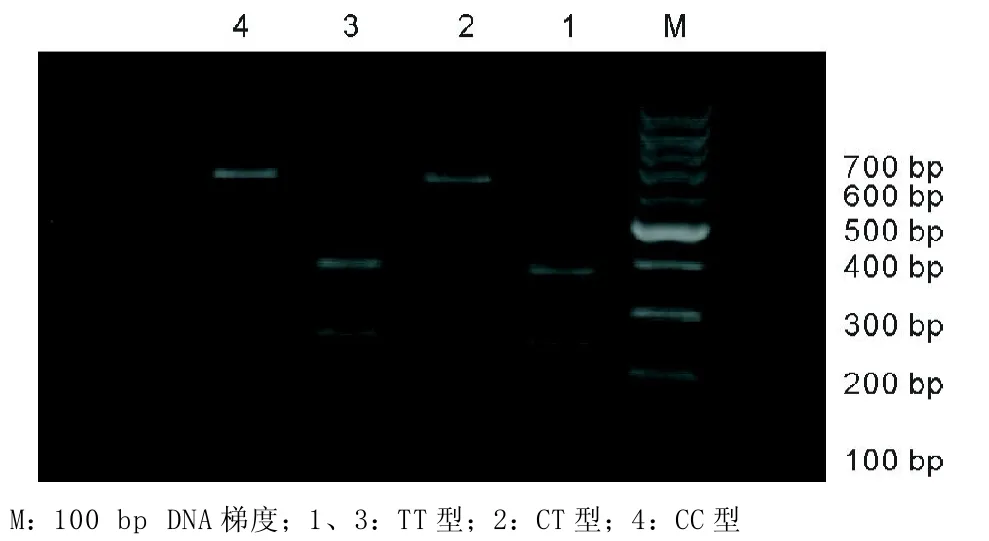
图1 rs903361位点PCR-RFPL酶切电泳图
2.2.2 rs3766553基因多态性:PCR扩增出293 bp长度的片段,酶切后可产生三种基因型。因6 bp片段太小,电泳后不可见。只有293 bp一条带的为TT型,有171、116 bp两条带的为CC型,有293、171、116 bp三条带的为CT型。见图2。
2.2.3 rs10920573基因多态性:PCR扩增出673 bp长度的片段,酶切后可产生三种基因型。酶切后337 bp和330 bp片段大小接近,二者融合成一条带,6 bp片段太小,电泳后不可见。只有673 bp一条带的为TT型,有337、330 bp两条带的为CC型,有673、337、330 bp三条带的为CT型。见图3。

图2 rs3766553位点PCR-RFPL酶切电泳图

图3 rs10920573位点PCR-RFPL酶切电泳图
2.3基因型和等位基因分布非耐药组和正常组rs903361、rs10920573及rs3766553位点基因型频率的分布,均符合Hardy-Weinberg平衡,说明该样本具有良好的人群代表性。三组之间三个位点等位基因C和T的频率分布、非耐药组和正常组三个位点各基因型分布均无明显差别。耐药组rs903361 CT型分布频率低于非耐药组(x2=5.711,P=0.017),rs10920573 CT型分布频率高于非耐药组(x2=6.599,P=0.010),差异具有统计学意义。rs3766553基因型分布各组差异无统计学意义,详见表2。

表2 部分性发作癫痫患者和正常组三个位点基因型和等位基因分布频率比较[n=60,n(%)]
2.4 耐药相关的危险因素logistic回归分析结果
结合单因素分析结果,在平衡“热性惊厥、发病至开始服药间隔时间≥1年、首次发作年龄、性别、年龄” 5个危险因素后rs903361 CC型和TT型相对于CT型发生耐药的危险度(OR)分别为2.730(95% CI:1.034~7.206,P=0.043)和2.609(95%CI:1.011~6.735,P=0.047),差异均存在统计学意义,提示rs903361 CC型和TT型均是耐药性产生的独立危险因素。而rs10920573 CT型相对于CC型和TT型发生耐药的OR分别为1.834(95%CI:0.652~5.155,P=0.250)和2.572(95%CI:1.061~6.209,P=0.037),其中相对于TT型,差异存在统计学意义,提示rs10920573 CT型为耐药产生的独立危险因素。
3 讨论
腺苷是大脑内源性抗惊厥物质,与癫痫发作的终止、严重程度及持续时间相关[6]。腺苷系统功能的缺陷,特别是腺苷发挥中枢抑制作用的主要受体A1AR的异常[7],可加剧癫痫的发作,也可能成为部分患者耐药的原因。腺苷及其受体激动剂、腺苷激酶抑制剂抑制癫痫发作的途径,完全有别于现有抗癫痫药的药理机制,可能成为癫痫治疗的新途径,尤其对于耐药性癫痫的治疗可能会是一较大的突破。
Wagner等[4]研究发现A1AR基因rs10920573的CT型增加脑外伤后迟发型癫痫的发病率,rs3766553的TT型和CC型分别可增加早发及迟发型脑外伤后癫痫的发病率。在本研究中rs903361的CC、TT型和rs10920573 的CT型在部分发作性癫痫耐药患者分布频率明显偏高,而rs3766553位点基因型各组之间未发现明显差异。同时笔者收集了入选患者的相关临床调查资料,经多因素logistic回归分析平衡各种耐药相关的其他可能危险因素,发现A1AR基因rs903361的CC型、TT型和rs10920573 CT型是癫痫耐药性发生的独立危险因素。这一结果是目前有关A1AR基因变异与癫痫耐药产生相关方面的初次探索。
rs903361、rs10920573、rs3766553均为A1AR基因的标签单核苷酸(SNP tagging,tSNP),最小等位基因频率都超过了20%。这3个tSNPs囊括了A1AR基因启动子区域中5’上游的1 000 bp[4]。这些位点的遗传变异均可能对A1AR的功能产生影响。rs903361为位于外显子1附近的一个内含子,最接近A1AR基因的5’上游启动子区域。研究中纯合的TT型和CC型均易致癫痫耐药,相对于CT型耐药的危险性为2.609倍和2.730倍,而杂合CT型则倾向于药物治疗有效。rs10920573位于内含子4,其两侧为4个其他的内含子单核苷酸[8]。而rs10920573 CT型相对于TT型耐药的危险性为2.572倍,这与之前发现CT型增加脑外伤后癫痫的发病率结果[4]一致,因而这一结果对于耐药性的产生有较强的提示意义。rs3766553标记A1AR基因一段大约有9 263 bp的DNA,覆盖了最后一个外显子,可能与受体配体结合和信号转导都相关[9]。在之前的研究中认为rs3766553的TT型、CC型增加了脑外伤后癫痫的发病率[4]。然而本研究并未发现明显的差异,也许与不同人群的选择及样本量较少有关。
A1AR高度表达于大脑皮层、海马,是腺苷在中枢发挥抑制作用的主要受体亚型[3]。腺苷通过A1AR可抑制神经突触活动,介导癫痫发作的抑制和神经保护等作用[6]。脑内多种神经递质,尤其是兴奋性氨基酸,均可被神经元突触前的A1AR抑制[10]。无论在体外或体内的癫痫模型中[11],均发现A1AR介导的抗惊厥作用的缺失可易致癫痫持续状态的发生。癫痫发作急性期可引起A1AR密度反应性的上调[12],而慢性癫痫中伴随着神经元的损伤,A1AR水平明显偏低[13]。
耐药性癫痫患者往往表现为反复发作的慢性癫痫,很有可能伴随A1AR水平的下降,而目前常规抗癫痫药物作用缺乏针对腺苷作用缺失的药物。因而若存在A1AR功能上的缺陷则可加剧癫痫的发作,且常规药物治疗无效。结合本研究结果,可推断腺苷A1AR的遗传变异有可能与部分发作性癫痫患者耐药具有一定关系。
本研究的癫痫患者均来自温州医科大学附属第一医院门诊长期随访患者,在社会人群中的代表性有待于进一步验证。由于本研究中对耐药性癫痫的入选标准把握严格,故入选的每组病例仅为60例,病例数较少,因此说服力不强,希望在此基础上进一步增加病例数,以期得到更可靠的结果。此外,本研究仅调查了内含子区的几个tSNP,病例对照研究也仅能提供相关的信息,因此,有待进一步的研究去证实该遗传变异是如何影响A1AR功能而致使部分发作癫痫患者耐药。
[1]Nadkarni S, LaJoie J, Devinssky O. Current treatments of epilepsy[J]. Neurology, 2005, 64(12 Suppl 3): 2-11.
[2]Dombrowski SM, Desai SY, Marroni M, et al. Overexpression of multiple drug resistance genes in endothelial cells from patients with refractory epilepsy[J]. Epilepsia, 2001, 42 (12): 1501-1506.
[3]Ribeiro JA, Sebastiao AM, De Mendonca A. Adenosine receptors in the nervous system: pathophysiological implications[J]. Prog Neurobiol, 2003, 68(6): 377-392.
[4]Wagner AK, Miller MA, Scanlon J, et al. Adenosine A1 receptor gene variants associated with post-traumatic seizures after severe TBI[J]. Epilepsy Research, 2010, 90(3): 259-272.
[5]王学峰, 肖波, 孙洪斌. 难治性癫痫[M]. 上海: 上海科学技术出版社, 2001: 1-46.
[6]Dunwiddie TV, Masino SA. The role and regulation of adenosine in the central nervous system[J]. Annu Rev Neurosci, 2001, 24: 31-55.
[7]Boison D. Adenosine-based cell therapy approaches for pharmacoresistant epilepsies[J]. Neurodegener Disorder, 2007, 4(1): 28-33.
[8]Hernandez SD, Mccord JM. Association of a new intronic polymorphism of the SOD2 gene (G1677T) with cancer[J]. Cell Biochem Funct, 2009, 27: 223-227.
[9]Rosen N, Chalifa-Caspi V, Shmueli O, et al. GeneLoc: exonbased integration of human genome maps[J]. Bioinformatics, 2006, 19(S1): i222-i224.
[10]Fredholm BB, Ijzerman AP, Jacobson KA, et al. International Union of Pharmacology. XXV. Nomenclature and classification of adenosine receptors[J]. Pharmacol Rev, 2001, 53(4): 527-552.
[11]Avsar E, Empson RM. Adenosine acting via A1 receptors, controls the transition to status epilepticus-like behaviour in an in vitro model of epilepsy[J]. Neuropharmacology, 2004, 47(3): 427-437.
[12]Ohta Y, Nariai T, Kurumaji A,et al.Increased binding of inhibitory neuronal receptors in the hippocampus in kainatetreated rats with spontaneous limbic seizures[J]. J Clini Neurosci, 2010, 17(5): 612-616.
[13]Rebola N, Porciuncula LO, Lopes LV, et al. Long-term effect of convulsive behavior on the density of adenosine A1 and A2A receptors in the rat cerebral cortex[J]. Epilepsia, 2005, 46 Suppl 5: 159-165.
(本文编辑:吴飞盈)
The association of adenosine A1 receptor gene variants with the multidrug-resistant partial seizure
epilepsy
XU Huiqin1, OU Fuyong2, NAREN Mandula1, TU Dongpei1, ZHENG Rongyuan1, CHEN Jiangfan3,
CHEN Bicheng4, CHEN Yujun1.1.Department of Neurology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Neurology, Chenzhou NO.1 People’s Hospital, Chenzhou,423000; 3.The Eye Hospital of Wenzhou Medical University, Wenzhou, 325027; 4.Department of Transplantation, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To explore the association of the single-nucleotide polymorphisms (SNP) of adenosine A1 receptor (A1AR) gene with partial pharmacoresistance seizure in south of Zhejiang province Han population.Methods:One hundred and twenty cases of partial seizure patients were obtained for this study, multidrugresistant group and full controlled with no seizures group (followed: named the none pharmacoresistance group) each 60 cases, and 60 healthy patients as normal control group. A polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) was used for the detection of rs903361, rs10920573, rs3766553 SNP, via the retrospective case-control study and multiple logistic regression analysis methods to explore its correlation of drug resistance epilepsy. Rusults: Both the frequencies of the allelic of all SNPs among the three group and genotypes of three SNPs between the normal control and none pharmacoresistance group had no statistical difference. The frequency of rs903361 CT genotype in pharmacoresistance epilepsy patients was obviously lower than in the none pharmacoresistance group, P=0.017. The frequency of rs10920573 CT genotypes in pharmacoresistance epilepsy patients was obviously higher than in the none pharmacoresistance group, P=0.010. According to the multiple logistic regression analysis, the CC and TT genotypes in rs903361 were both the independent risk factor for pharmcoresistance in epileptic patients and associated with a 2.73 and 2.609 times added risk for pharmacoresistance than CT genotype, P=0.043 and 0.047 respectively. In rs10920573, CT genotype was also anindependent risk factor for pharmcoresistance in epileptic patients,and associated with a 2.572 times increased risk for pharmacoresistance than TT genotype, P=0.037. There was no difference among all rs3766553 genotypes.Conclusion:The CC and TT genotypes of rs903361 and the CT of rs10920573 are both the independent risk factors associated with mulltidrug-resistant partial seizure epilepsy.
polymorphism, single nucleotide; epilepsy; drug resistance; A1AR
R742.1
A
1000-2138(2014)02-0100-05
2013-03-27
温州医学院校外引进人才基金资助项目(QTJ11011)。
徐惠琴(1972-),女,浙江上虞人,副主任医师,硕士。
