5株新分离海洋硅藻总脂和脂肪酸组成的比较研究
2014-03-22高秀芝蒋霞敏张泽凌孙志鹏
高秀芝, 蒋霞敏, 张泽凌, 叶 丽, 孙志鹏
(宁波大学海洋学院 宁波大学应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
微藻作为水域生态系统中重要的初级生产力,具有合成脂肪和多不饱和脂肪酸(PUFA)的能力,且其脂肪不具有鱼腥味,脂肪酸组成较简单,是海洋软体动物、甲壳动物幼体及鱼类仔幼鱼的优良饵料。海洋微藻作为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等高度不饱和脂肪酸的新来源越来越受到国内外科研工作者的重视。大量研究表明:EPA和DHA在营养强化、预防和治疗多种疾病方面发挥着重要作用,如预防心脏病、动脉粥样硬化,治疗癌症、炎症、哮喘、糖尿病等取得了良好效果[1]。目前日本和美国已利用微藻规模化生产PUFAs,中国利用微藻技术开发PUFAs还处于研究阶段[2]。到目前为止,已测定了上百个品种微藻的脂肪酸。其中研究最多的是三角褐指藻(Phaeodactylumtricornutum)、中肋骨条藻(Skeletonemacostatum)、小球藻(Chlorellaspp.)等[3]。本实验室从浙江海域采集浮游植物,从中分离微藻,最终筛选出5株硅藻,进行了脂肪含量及脂肪酸组成的比较分析,以期为海洋微藻EPA或DHA的开发利用提供理论依据。
1 材料与方法
1.1 水样采集
从浙江渔山列岛、朱家尖海域,采用25号浮游生物网拖采,采集的样品用装有培养基的透明塑料瓶保存,然后带入实验室进行分离。
1.2 微藻的分离
采用平板分离法和水滴分离法对样品中的微藻进行分离。挑选单细胞进行单种培养,藻株大量繁殖后,进一步镜检,反复分离纯化,直至分离出纯藻株,纯种转入100 mL三角瓶中保存培养。
1.3 微藻的培养
用于培养微藻的海水均经脱脂棉过滤、煮沸消毒,所用容器均120℃高温消毒,采用MAV培养基[4],培养体积5 L,各3平行。培养条件:水温17~25℃,盐度25,自然光照,不充气培养。每天取适量藻液进行计数以确定指数生长期。
1.4 总脂的测定
在藻细胞达到指数生长末期后将藻液离心收集(4000 r/min, 4℃),冷冻干燥,藻粉于-20℃冷冻保存。称取100 mg左右的藻粉,参照改进后的Bligh-Dyer法[5]进行总脂含量的测定。
1.5 脂肪酸的测定
采用Bligh-Dyer法抽提总脂,分层后下层氯仿层旋转蒸发至恒重,充N2冷冻保存。总脂移入4 mL样品瓶,加入5%~6%KOH甲醇溶液(V/V 4∶1), 充N21 min。皂化甲酯化过程参照文献[6],然后用日本SHIMADZU公司QP2010气象色谱-质谱分析仪进行分析, 参考脂肪酸标准和参考文献[7-10],用面积归一法计算出各脂肪酸的百分含量(以占脂肪酸含量的百分比表示)。
1.6 数据处理
试验数据以平均值±标准差来表示,利用Excel 2003和SPSS13.0软件进行数据分析。
2 实验结果
2.1 分离藻株的形态特征
对浙江渔山列岛和朱家尖水样中微藻进行分离、纯化,根据分离纯化过程中培养物的颜色变化和细胞特性的观察,最终筛选出5株易培养、生长稳定的藻株,经鉴定均为硅藻。表1是5株硅藻的形态特征,从表1可以看出这5株硅藻的细胞大小为3.0~23.7 μm。其中大龙骨藻(Tropidoneismaxima)和咖啡双眉藻(Amphoracoffeaeformis)为底栖硅藻,其它3株藻均为浮游硅藻。
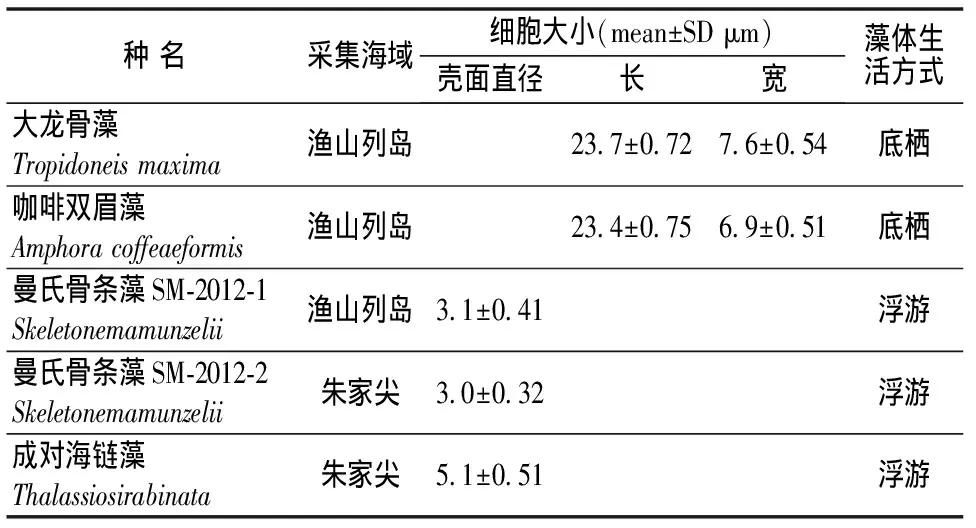
表15株海洋微藻的形态特征
2.2 试验条件下5株微藻的生长特性
图1为试验条件下筛选出的5株微藻一次性培养的生长曲线。根据藻类细胞增长的情况,确定曼氏骨条藻SM-2012-1(Skeletonemamunzelii)、曼氏骨条藻SM-2012-2、成对海链藻(Thalassiosirabinata)的指数生长期、相对生长下降期和静止期分别为第3 d、第4 d和第5 d;咖啡双眉藻和大龙骨藻的指数生长期、相对生长下降期和静止期分别为第4 d、第6 d和第8 d。
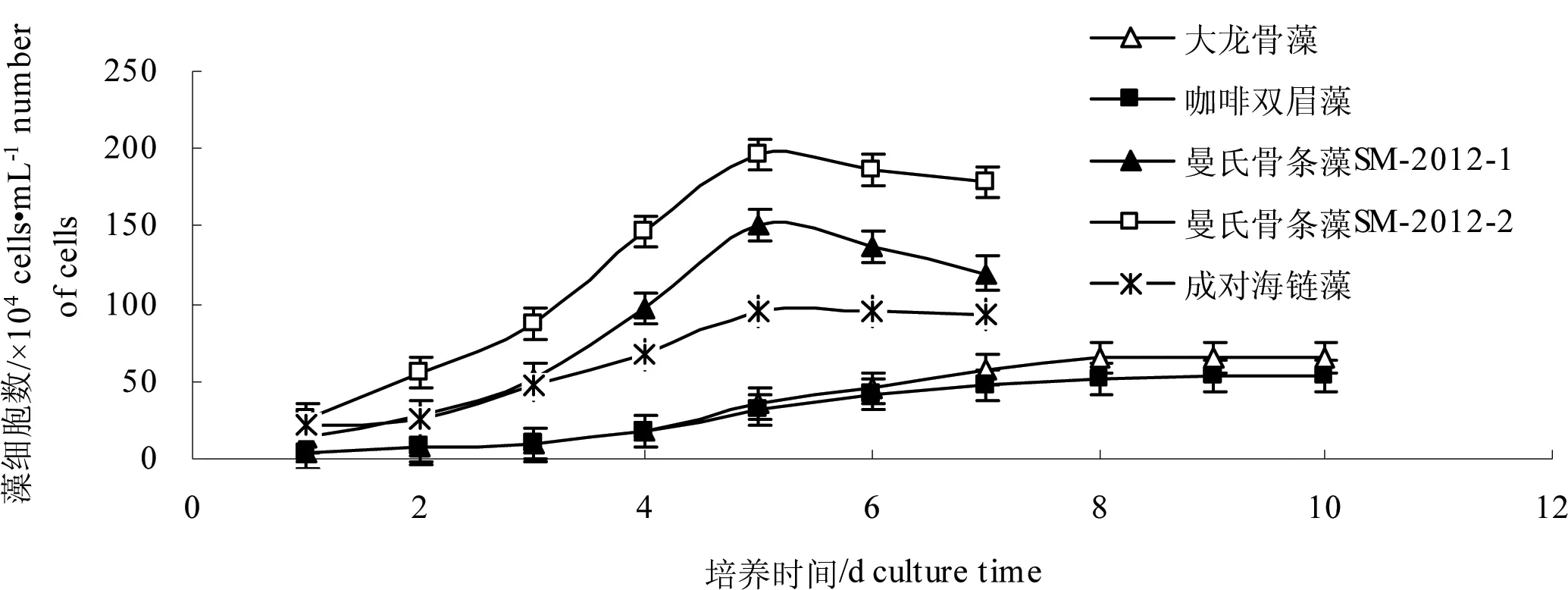
图1 试验条件下5株微藻生长曲线
2.3 试验条件下5株微藻的生物量
由表2可知,5株微藻中大龙骨藻在培养8 d后生物量最高,为0.204 g/L,其次为咖啡双眉藻(0.179 g/L)>曼氏骨条藻SM-2012-2(0.053 g/L)>曼氏骨条藻SM-2012-1(0.047 g/L)>成对海链藻(0.046 g/L)。

表2 试验条件下5株微藻的藻株干重
2.4 微藻的脂肪含量
表3是5株海洋微藻的总脂含量。结果显示,这5株微藻的收获密度为58×104~197×104cells/mL,曼氏骨条藻SM-2012-2的收获密度最高,咖啡双眉藻最低。5株硅藻的总脂含量为15.14%~28.07%,除成对海链藻外,其它4株硅藻脂肪含量均高于其干重的20%;大龙骨藻总脂含量最高,咖啡双眉藻次之,成对海链藻最低。

表35株海洋微藻的总脂含量
2.5 5株硅藻的脂肪酸组成
5株硅藻的主要脂肪酸为14:0、16:0、16:1 n-7、16:3 n-4、20:5 n-3,占总脂肪酸的67.65%~77.59%。饱和脂肪酸(SFA)含量为24.94%~30.92%,其中成对海链藻的SFA含量最高(30.92%),其次为曼氏骨条藻SM-2012-1(30.66%)>曼氏骨条藻SM-2012-2(30.18%)>大龙骨藻(27%)>咖啡双眉藻(24.94%),对于饱和脂肪酸12:0,只有成对海链藻中含有少量,其它4株硅藻未检测到。5株微藻的单不饱和脂肪酸(MUFA)含量为22.74%~30.26%,其中成对海链藻的MUFA含量最高(30.26%),其次为大龙骨藻(27.21%)>咖啡双眉藻(25.14%)>曼氏骨条藻SM-2012-1(23.90%)>曼氏骨条藻SM-2012-2(22.74%)。5株微藻的n-3 多不饱和脂肪酸(n-3 PUFA)含量为13.27~30.53%,其中曼氏骨条藻SM-2012-2的n-3 PUFA含量最高,咖啡双眉藻最低。5株微藻的n-6 PUFA含量为2.67%~22.63%,其中咖啡双眉藻的n-6 PUFA含量最高,成对海链藻最低。PUFA中 20:5 n-3的含量最高,EPA含量从高到低依次为曼氏骨条藻SM-2012-2(27.74%)>曼氏骨条藻SM-2012-1(24.83%)>大龙骨藻(23.08%)>成对海链藻(22.04%)>咖啡双眉藻(12.72%)。5株微藻富含C16PUFAs,其中16:2 n-4,16:3 n-4是主要的组分,并且16:3 n-4的含量均高于16:2 n-4。5株微藻的C18系列脂肪酸组成各有不同,大龙骨藻的C18系列脂肪酸中18:3 n-6 含量最高(2.74%),18:1 n-9最低(0.69%);咖啡双眉藻的C18系列中18:2 n-6最高(1.79%),而18:1 n-9最低;成对海链藻C18系列脂肪酸中18:1 n-7最高(6.58%),18:3 n-6最低;曼氏骨条藻SM-2012-1和曼氏骨条藻SM-2012-2的C18系列脂肪酸组成相同,变化趋势相近, C18系列脂肪酸中18:1 n-7含量最高,分别为7.6%、6.28%,18:3 n-3最低,分别为0.32%、0.43%。 5株微藻的20:4 n-6含量为0.12%~17.72%,咖啡双眉藻最高(17.72%),大龙骨藻其次(5.66%),曼氏骨条藻SM-2012-1、曼氏骨条藻SM-2012-2、成对海链藻中20:4 n-6的含量极少。 除咖啡双眉藻外,其它4株微藻都含有一定量的DHA。
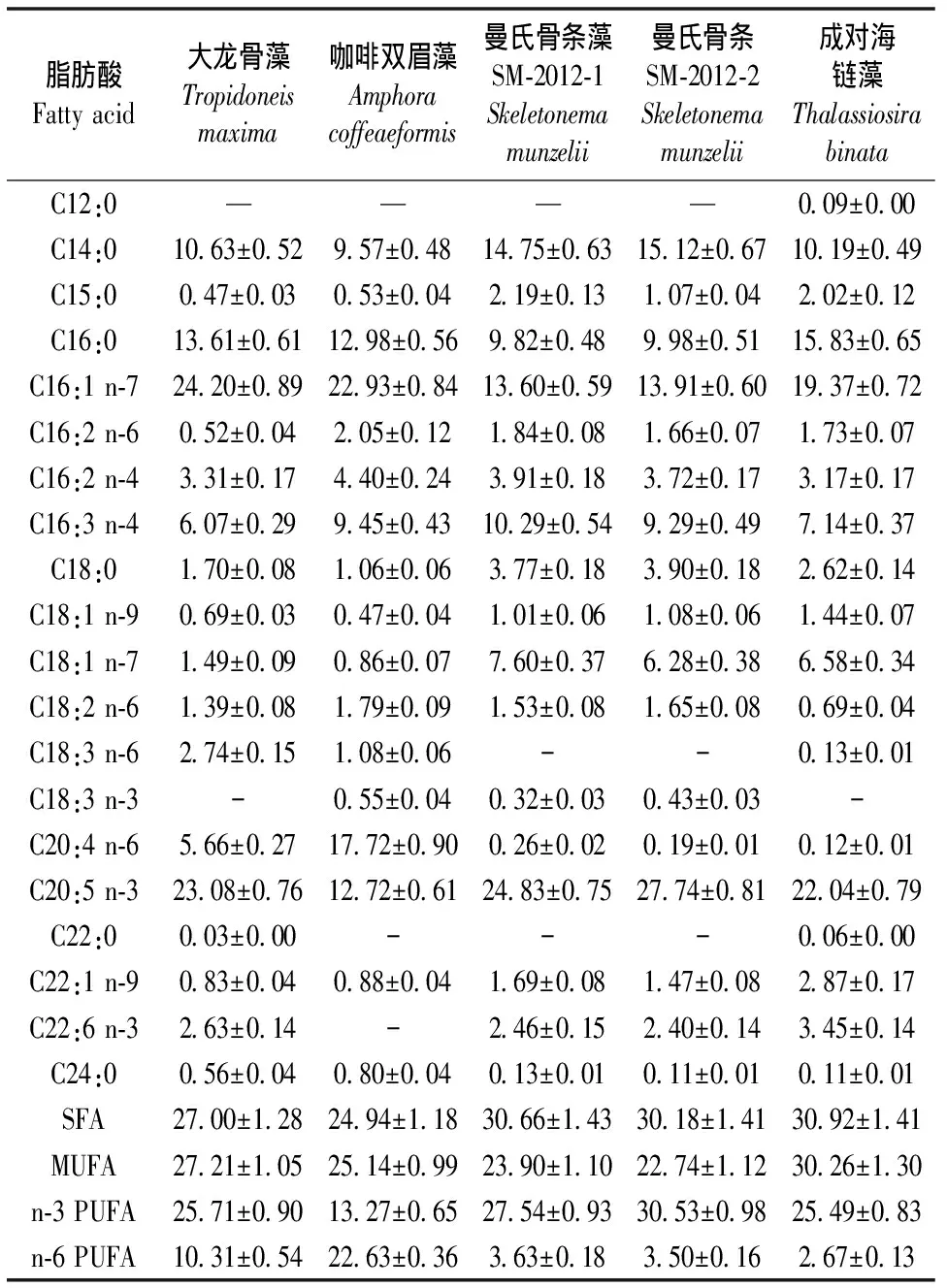
表4 5株海洋微藻的脂肪酸组成(%占总脂肪酸含量的百分比)
3 讨论
本研究中5株微藻总脂含量为15.14%~28.07%,咖啡双眉藻总脂含量与Chen[7]报道的双凸双眉藻(Amphorabigibba)总脂含量(37.16%)和简单双眉藻(Amphoraexigua)总脂含量(33.21%)有所差异,后者是在水温14~22.5℃,PES培养液中培养49 d后测得,出现此种差异的原因可能是藻株、营养条件、培养时间等不同所致,但可以看出这3株藻的总脂含量都不低,说明咖啡双眉藻相对于其他微藻很可能是含油量偏高的一株藻。曼氏骨条藻SM-2012-1、曼氏骨条藻SM-2012-2的总脂含量与 Rodolfi等[11]的报道中肋骨条藻的总脂含量相近。
5株海洋微藻的主要脂肪酸为14:0、16:0、16:1 n-7、16:3 n-4、20:5 n-3,且16:1 n-7的含量均高于16:0,这与Zhukova等[12]报道的硅藻纲的主要脂肪酸组成相一致。5株微藻的饱和脂肪酸(SFA)含量为24.94%~30.92%,其中曼氏骨条藻SM-2012-1的SFA量(30.66%)与Pistocchi等[13]报道的中肋骨条藻在磷限制的f/2 培养条件下测得的SFA含量(33.8%)接近,而Chen[7]报道的中肋骨条藻的SFA为69.46%,后者的培养时间为49 d,培养液为PES,而有研究表明中肋骨条藻随着培养时间的延长,SFA中的C14:0量增加,EPA降低,因此导致总的SFA增加[12]。Chen[7]报道的简单双眉藻的n-3 PUFA含量(13.45%)与本试验中咖啡双眉藻n-3 PUFA含量(13.27%)的结果相近。5株微藻的n-6 PUFA含量为2.67%~22.63%,而Chen[7]报道的中肋骨条藻的n-6 PUFA为5.92%,后者培养时间为49 d,远长于本试验培养时间,正如前面所述,可能是随着培养时间的延长,多不饱和脂肪酸含量减少所致。本研究中16:1 n-7/16:0为1.2~1.8,Zhukova等[12]研究的三角褐指藻、中肋骨条藻、牟氏角毛藻(Chaetocerosmuelleri)、溢缩角毛藻(Chaetocerosconstrictus)4株硅藻的16:1 n-7/16:0为1.3~2.0,两者结果较为接近,且有研究表明16:1 n-7含量高于16:0时具有一定的优势。5株微藻均富含EPA,但不同藻株EPA含量相差很大,一些因素可导致这种差距,例如改变微藻的营养和物理条件,其EPA含量也会从1%~3%增至30%~40%,曼氏骨条藻SM-2012-2的EPA含量(27.74%)与 Pistocchi 等[13]报道的中肋骨条藻EPA含量(26.7%)较为接近,然而脂肪酸组成上的变化,特别是EPA的含量极易受温度、光照及硅酸盐含量的影响,且有研究表明随EPA含量的减少,中肋骨条藻的14:0增加。成对海链藻的EPA含量(22.04%)与Zhukova等[12]报道的海链藻(Thalassiosirasp.)EPA含量(1.75%)和威氏海链藻(Thalassiosiraweissflogii)EPA含量(3.8%)差异显著,导致此差异的原因可能与环境因子及藻株有关。5株微藻的C18系列脂肪酸的含量较低,这与Chuecas等[14]、Volman等[15]、Nichols等[16]对硅藻的研究结果相符合; 5种微藻中咖啡双眉藻的20:4 n-6含量高达17.72%,明显高于Chen[7]报道的简单双眉藻(1.44%)和双凸双眉藻(1.73%)。24:0在文献中未被经常报道[17],成对海链藻24:0含量(0.11%)与Viso等[17]报道的成对海链藻24:0含量(0.1%)基本一致。
本研究中大龙骨藻和咖啡双眉藻均为底栖硅藻,在本试验条件下培养6 d后达到相对生长下降期,生长周期较其它3株浮游硅藻(4 d)长些;从生物量方面考虑,大龙骨藻培养至相对生长下降期后生物量(0.204 g/L)远高于其它3株浮游硅藻;从总脂方面考虑,也是大龙骨藻最高(28.07%),其次为咖啡双眉藻(23.58%)、曼氏骨条藻SM-2012-2(22.09%)、曼氏骨条藻SM-2012-1(21.05%)、成对海链藻(15.14%)。从EPA含量来看,曼氏骨条藻SM-2012-2的EPA含量最高,为27.74%,其次为曼氏骨条藻SM-2012-1(24.83%)、大龙骨藻(23.08%)、成对海链藻(22.04%)、咖啡双眉藻(12.72%)。从DHA含量来看,成对海链藻最高(3.45%),而大龙骨藻、曼氏骨条藻SM-2012-1、曼氏骨条藻SM-2012-2的DHA含量接近,咖啡双眉藻则未检测到DHA。结合咖啡双眉藻的EPA及DHA含量,可先将咖啡双眉藻排除暂不开发的可能性。本研究中收集藻泥时因3株浮游硅藻均易沉降,因此在离心前可先通过虹吸法将藻液浓缩至较少的体积,再离心,方便收集,若在生产上应用,可以大大节约生产成本。
就目前的研究结果而言,筛选出3株具有开发潜能的藻株分别是大龙骨藻、曼氏骨条藻SM-2012-1、曼氏骨条藻SM-2012-2,以期更好的开发利用。需要说明的是,由于5株藻均采用同一营养盐配方和相同理化条件培养,并不一定代表每种藻的最佳优化条件,因此其比较结果存在一定的局限性,这有待于进一步的研究。
参考文献:
[1]林学政, 李光友. 11种微藻脂类和EPA/DHA组成的研究[J]. 黄渤海海洋, 2000, 18(2): 36-40.
[2]王 铭, 刘 然, 徐 宁, 等. 13种微藻的脂肪酸组成分析[J]. 生态科学, 2006, 25(6): 542-544.
[3]梁 英, 麦康森. 微藻EPA和DHA 的研究现状及前景[J]. 水产学报, 2000, 24(3):289-296.
[4]蒋霞敏. 营养与饵料生物实验教程[M]. 北京:高等教育出版社, 2010, 80-81.
[5]Bligh E G, Dyer W J. A rapid method lipid extraction and purification[J]. Can J Biochem Physiol, 1959, 37: 911-923.
[6]蒋霞敏, 柳敏海, 邢晨光. 不同生态条件对绿色巴夫藻生长及脂肪酸组成的影响[J]. 水生生物学报, 2007, 31(1):88-93.
[7]Chen Y C. The biomass and total lipid content and composition of twelve species of marine diatoms cultured under various environments[J]. Food Chem, 2012, 131: 211-219.
[8]徐继林, 严小军, 周成旭, 等. 19种(株)海洋微藻脂肪酸组成及充气产生的影响[J]. 宁波大学学报, 2006, 29(2): 180-185.
[9]刘梦坛, 李超伦, 孙 松. 两种甲藻和两种硅藻脂肪酸组成的比较研究[J]. 海洋科学, 2010, 34(10): 77-82.
[10]曹春晖, 孙世春, 麦康森, 等. 30株海洋绿藻的总脂含量和脂肪酸组成[J]. 青岛海洋大学学报, 2000, 30(3): 428-434.
[11]Rodolfi L, Chini Z G, Bassi N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low cost photobioreactor[J]. Biotechnol Bioeng, 2009, 102(1): 100-120.
[12]Zhukova N V, Aizdaicher N A. Fatty acid composition of 15 species of marine microalgae[J]. Phytochemistry, 1995, 39(2): 351-356.
[13]Pistocchi R, Trigari G, Serrazanetti G P, et al. Chemical and biochemical parameters of cultured diatoms and bacteria from the Adriatic Sea as possible biomarkers of mucilage production[J]. Sci Total Environ, 2005, 353: 287-299.
[14]Chuecas L, Riley J P. Component fatty acids of the total lipids of some marine phytoplankton[J]. J Mar Biol Associ UK, 1969, 49: 97-116.
[15]Volkman J K, Jeffrey S W, Nichols P D, et al. Fatty acid and lipid composition of 10 species of microalgae used in mariculture[J]. J Exp Mar Biol Ecol, 1989, 128(3): 219-240.
[16]Nichols P D, Palmisano A C, Smith G A, et al. Lipids of the Antarctic sea ice diatomNitzschiacylindrus[J]. Phytochemistry, 1986, 25(7):1649-1753.
[17]Viso A C, Marty J C. Fatty acid from 28 marine microalgae[J]. Phytochemistry, 1993, 34(6): 1521-1533.
