六价铬对水绵生长的毒性效应
2014-03-22王丽卿徐玉萍
山 鹰, 张 玮, 2, 王丽卿, 徐玉萍
(1.上海海洋大学 水产与生命学院, 上海 201306; 2.上海水生环境工程有限公司, 上海 200090)
六价铬(Cr6+)为工业“五毒”之一,是一种毒性大、致畸、致突变的重金属;六价铬可直接侵入生物体内,造成生物体代谢损伤,甚至死亡;也可通过食物链的富集,引发复杂的毒害问题;因此,如何监测环境中的六价铬污染,并研究其对不同生物的影响,对受污染环境的及时监测和治理具有重要意义[1-3]。
在水域生态系统中,藻类是重要的初级生产者,常常作为一个食物链的开端,具有重要的生态地位。故利用一些生态习性特殊、较敏感的藻类作为污染指示种,可监测水体的重金属污染程度和估测水生态的受损程度。然而,目前关于六价铬(Cr6+)对淡水藻类毒性的研究仅有有限的报道。Corradi等研究认为,栅藻的分泌物具有降低Cr6+毒性的作用;陈海柳等比较了6种微藻对Cr6+的耐受性,发现四尾栅藻>羊角月牙藻>钝顶螺旋藻>极大螺旋藻>聚球藻>蛋白核小球藻[4-6]。本文以水绵(Spirogyrasp.)为研究对象,从淡水藻类的生长以及细胞氧化损伤的角度出发,探讨了六价铬(Cr6+)对水绵的毒性作用,以期为淡水丝状绿藻对六价铬毒性响应机理的研究及六价铬在水环境中的风险评价积累科学依据。
1 材料与方法
1.1 实验样品采集及分离
实验藻种于2013年3月15日采自上海海洋大学校园水系,采集时水温为14.6℃。经实验室分离后,纯化培养。根据预实验培养基筛选结果,从水生4号、朱氏10号、BG11液体培养基中选取实验培养基为BG11液体培养基,pH值控制在7.5~8.0,温度为25℃、光照强度3000 Lx、光暗比14 h∶10 h。
1.2 驯化培养
实验前向每个实验容器(长55 cm×宽40 cm×高30 cm)的透明玻璃缸内加入曝气24 h的上海海洋大学校园水系水至20 cm。培养条件为湿度66%,明暗周期12 h,温度25℃,光照强度8000 Lx。每个容器内加入前期大量培养制备的15 g(鲜重)水绵进行5 d的适应。
1.3 六价铬对水绵的EC50值测定
取20 g鲜重的藻体分装于500 mL锥形瓶中。培养3 d后, 根据预实验的结果, 设置5个暴露组和1个空白对照组, 每组3个平行, 根据预实验结果,用重铬酸钾(K2Cr2O7,优级纯)配制六价铬标准溶液[7],六价铬在藻液中的终浓度分别为4、6、8、10和12 mg/L, 测定六价铬对水绵的毒性。每隔24 h取样, 称取等量鲜重水绵后测定藻细胞中叶绿素a的含量(μg/g), 叶绿素a(Chla)采用丙酮萃取-分光光度法,具体步骤参照《水和废水监测分析方法进行》[7]。
用概率单位-浓度对数法[8], 分别计算出24、48、72和96 h的半效应浓度EC50值。
1.4 膜脂过氧化作用的测定
实验96 h后测定1次丙二醛含量和细胞膜透性。
丙二醛(MDA)含量的测定采用TBA比色法,参照李合生等[9]的方法。细胞膜透性采用电导仪测定[10]。在20℃环境下在实验96 h后测定。取培养中的藻体,用吸水纸吸干外部的水分,称取1 g±0.2 g,用自来水洗净后,再用去离子水洗4次,放入40 mL烧杯中,将上述藻体剪碎研磨并加入去离子水至40 mL,连续振荡2 h后,用电导仪测定浸出液的电导率。
1.5 分析方法与数据统计
采用Excel2003、SPSS 18.0软件进行作图和统计分析。
2 结果与分析
2.1 六价铬对水绵的急性毒性
不同浓度六价铬暴露下,水绵的生长曲线如图1所示。从图1可以看出, 24 h后,除4 mg/L组和6 mg/L组叶绿素a含量略有上升外(131.22 μg/g和103.59 μg/g),各实验组藻类叶绿素a含量在96 h后都出现了下降;随着暴露时间的推移,六价铬在藻细胞内积累,实验组叶绿素a含量虽然都有一定的上升,但远远小于对照组叶绿素a的浓度。随着六价铬暴露浓度的增大, 叶绿素a含量逐渐下降, 显示出明显的剂量-效应关系。镜检发现, 随着六价铬浓度的增大和暴露时间的延长, 藻细胞体积缩小, 颜色明显变黄变白,出现叶绿体分布不规则和解体现象。说明六价铬对水绵的生长产生了一定的解偶联作用(解偶联作用即为所有破坏生物氧化与磷酸化相偶联的作用。解偶联剂使氧化和磷酸化脱偶联,氧化仍可以进行,而磷酸化不能进行而导致无ATP生成,使氧化释放出来的能量全部以热的形式散发。本文中水绵在六价铬胁迫作用下,出现了解偶联的现象。可以推断六价铬对水绵是一种生长解偶联剂)。且与对照组相比,不同六价铬浓度组对水绵细胞生长均呈现抑制作用,且高浓度比低浓度更明显。
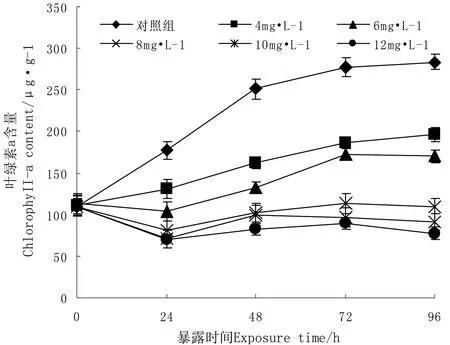
图1 不同浓度六价铬对水绵生长的影响
根据图1的数据, 采用黄国兰等[8]介绍的方法得到不同时间的概率单位-浓度对数曲线方程, 经统计分析, 确定各时间(24、48、72和96 h)的EC50及其95%置信区间, 如表1所示。
由表1可以看出, 各个时段的EC50值中, 24 h时最不敏感, 其EC50值最大(8.33 mg/L), 表明在短时间内, 水绵有一定自我恢复能力;随着暴露天数的增加, EC50值减小且变化不大(7.02~7.53 mg/L), 表明六价铬对水绵的毒性随着时间的延长而增强, 藻自身的抗性减小, 恢复减慢。此结果与暴露组水绵的抗逆性指标变化是一致的。

表1 六价铬对水绵的急性毒性
x为六价铬浓度对数(以10为底);y为抑制率概率单位(%)。
根据表1的数据,参照《水和废水监测分析方法》[7]的毒性的分级, 藻类以96 h EC50数值为判断依据,<1 mg/L属极高毒;1~10 mg/L为高毒;10~100 mg/L为中毒;>100 mg/L属低毒。结果表明六价铬对于水绵属于高毒(96 h EC50为7.25 mg/L)。
2.2 水绵抗逆性指标变化
暴露96 h后, 各实验组水绵细胞浸出液电导率的变化如图2a所示。从图中可以看出, 随六价铬暴露浓度的升高, 浸出液电导率变化呈逐渐递增趋势。而从图2b 中也可以看出,MDA含量也呈现不断累积的趋势。

图2 不同浓度六价铬对水绵细胞浸出液电导率(a)和MDA(b)的变化
电导率是测定丝状藻类细胞浸出液的导电能力,以反映其细胞膜透性的变化。当实验开始时,六价铬还未能进入细胞内部。所以当六价铬浓度<4 mg/L, 细胞浸出液电导率变化不大, 仅比对照高出10.85%,表明六价铬对藻具有一定的毒害作用, 藻体受到逆境胁迫, 导致细胞膜结构开始被破坏而导致细胞质流出,使得细胞浸出液电导率开始变大;当六价铬浓度>6 mg/L时, 细胞浸出液电导率活性有较为明显的上升, 与对照组相比有显著性差异(P<0.05), 当六价铬浓度≥8 mg/L时,与对照组相比有极显著性差异(P<0.01), 但与8和10 mg/L组无显著性差异(P>0.05)。到浓度为12 mg/L时到达峰值,高出对照80.26%。表明由于高浓度六价铬的胁迫, 藻细胞的结构遭到破坏, 超过了藻自身的调节范围, 从而导致膜结构被几乎完全破坏,电导率到达峰值。
2.3 水绵抗逆性指标与六价铬浓度的毒性响应关系
当六价铬浓度≥4 mg/L时,MDA含量就有明显升高,与对照组有极显著性差异(P<0.01)。当六价铬浓度≥8 mg/L时,与6 mg/L相比,无显著性差异(P>0.05),这表明即使是低浓度的六价铬也会对藻体细胞有严重的胁迫作用,且随着六价铬暴露浓度的增大,膜脂过氧化加剧,细胞伤害加重,其生长受到抑制。

图3 水绵细胞浸出液电导率(a)和MDA(b)对不同浓度六价铬的毒性响应
从图3a和图3b可以看出,水绵细胞浸出液电导率与六价铬浓度存在显著正相关非线性关系(P<0.05,r=0.951),在六价铬浓度为12 mg/L时,水绵细胞浸出液电导率比对照组增加了80.53%;水绵MDA含量与六价铬浓度存在极显著正相关非线性关系(P<0.01,r=0.977),在六价铬浓度为12 mg/L时,水绵细胞MDA含量比对照组增加了77.32%。可以看出,水绵细胞浸出液电导率和水绵细胞MDA含量与六价铬浓度存在一定的毒性响应关系。其中水绵MDA含量比水绵细胞浸出液电导率能更好反应六价铬的胁迫程度(0.977>0.951)。
3 讨论
大量研究表明,植物细胞应对逆境胁迫时,细胞质膜是最敏感的结构部分[13],胁迫会引起细胞脱水,细胞脱水和再度吸水又会造成对质膜的机械伤害,最终导致质膜结构完整性的破坏[14]。MDA是生物膜系统脂质过氧化的产物之一,其浓度表示脂质过氧化强度和膜系统伤害程度。本实验中MDA含量的上升表明,随着六价铬暴露浓度的升高,活性氧的产生和清除间的平衡被破坏,水绵的膜脂质过氧化加剧,细胞膜的结构和功能遭到破坏,细胞伤害加重。因此即使是较低浓度的六价铬也会对水绵细胞液造成伤害,逐渐导致细胞膜的结构和功能完整性的丧失;且浓度越高,破坏越严重。以致完全丧失功能成为通透性的膜[15, 16]。
本实验中,低浓度的六价铬暴露下,细胞浸出液电导率增加,但在4 mg/L浓度增加值(与对照组相比)比6 mg/L时低37.10%;而MDA指标上,6 mg/L浓度组只比4 mg/L浓度组高1.85%。表明细胞内部的膜体损伤程度比细胞膜严重,细胞膜结构出现了解体,但程度较轻。而高浓度六价铬暴露下,细胞浸出液电导率明显增加,氧自由基增多,膜质过氧化加剧,导致细胞膜结构严重破坏,导致细胞渗漏加剧。水绵细胞浸出液电导率与六价铬浓度存在显著正相关关系,从不同角度说明六价铬抑制了藻细胞的生长和代谢。
参考文献:
[1]Foster P M D, CattLey R C, MyLchreest E. Effects of Cr(VI)on male reproductive development in the rat:implications for human risk assessment[J].Food and Chemical Toxicology, 2000, 38:97-99.
[2]许云华, 邵世光, 郑 霞.六价铬对条斑紫菜的毒害影响及镧的缓解效应[J].淮海工学院学报:自然科学版, 2006, 15(3):54-57.
[3]徐勤松, 施国新, 杜开和. 六价铬污染对水车前叶片生理生化及细胞超微结构的影响[J].广西植物, 2002, 22(1):92-96.
[4]Corradi M G, Orbi G, Torelli A, et al. Exudates from the wild type and a Cr-tolerant strain ofScenedesmusacutusinfluence differently CR(VI) toxicity to algae[J]. Chemosphere, 1998, 37(14-15): 3019-3025.
[5]陈海柳, 潘 纲, 闫 海, 等.六价铬抑制淡水蓝绿藻生长的毒性效应[J].环境科学, 2003, 24(2):13-18.
[6]金立方, 袁翊朦, 胡祎瑞, 等.六价铬的细胞毒理效应及其机制研究进展[J].中国细胞生物学学报, 2013, 35(3):387-392.
[7]国家环境保护局编辑委员会.水和废水监测分析方法(4版)[M].北京:中国环境科学出版社, 2002.
[8]黄国兰, 戴树桂, 孙红文.有机污染物对藻类毒性的测定[J].环境化学, 1994, 13(3):259-262.
[9]李合生, 孙 群, 赵氏杰.植物生理生化实验原理与技术[M].北京:高等教育出版社, 2000:58-64.
[10]姚南瑜.潮间带底栖海藻对离子的通透性及其渗透适应性[J].植物生理学通讯, 1984(4):21-24.
[11]马成仓.Hg对油菜叶细胞膜的损伤及细胞的自身保护作用[J].应用生态学报, 1998(3):323-326.
[12]Khattar J I S, Sarma T A, Sharma A, et al. Effect of Cr6+stress on photosynthetic pigments and certain physiological processes in theCyanobacteriumanacystisnidulans and its chromium resistant strain[J].Microbiol Biotechnol, 2004, 14(6):1211-1216.
[13]张志良.植物生理学实验指导[M].北京:高等教育出版社, 2009:54-56.
[14]汤章城.现代植物生理学实验指南[M].北京:科学出版社, 1999:95.
[15]Prasad T K. Mechanism of chilling induce doxidative stress injury and to lerances: changes in antioxidant system, oxidation of proteins and lipids and protease activities[J].Plant Journal, 1996, (10):1017-1026.
[16]Franklin N M, Stauber J L, Lim R P, et al. Toxicity of metal mixtures to a tropical freshwater alga (Chlorellasp.): The effect of interactions between copper, cadmium, and zinc on metal cellbinding and uptake [J]. Environmental Toxicology and Chemistry, 2002, 21(11):2412-2422.
