贝类毒素大田软海绵酸OA对小鼠肝脏还原型谷胱甘肽GSH、过氧化氢酶CAT、超氧化物岐化酶SOD的影响
2014-03-22兰文升贺秀媛朱家增史秀杰欧小雷
张 锐, 兰文升, 贺秀媛, 朱家增, 刘 荭, 史秀杰, 欧小雷
(1. 深圳出入境检验检疫局动植物检验检疫技术中心 深圳市外来有害生物检测技术研发重点实验室,深圳 518045; 2. 广东海洋大学 实验教学部现代生化中心,广东 湛江 524088; 3. 河南农业大学 牧医工程学院动物医学系, 郑州 450002)
大田软海绵酸(okadaic acid, OA) 及其衍生物是腹泻型贝类毒素(DSP)毒素的主要组分, 它能够抑制蛋白质磷酸酶PP1A和PP2A,导致细胞蛋白质过磷酸化[1],从而降低了PP1和PP2A对正常细胞所具有的抑癌作用,促进脂质过氧化[2]。有关报道表明,在低浓度不能引起机体剧烈毒性反应时,OA成为一种潜在的肿瘤促进物和诱发剂,可诱导多种类型细胞的凋亡[3, 4]。
有报道氧自由基(Reactive oxygen species)在细胞信号肽中发挥很重要的作用,并主要存在于细胞增殖和凋亡过程中[5]。也有研究表明外源性污染物进入生物体后, 会导致大量活性氧自由基的产生[6],它可以与DNA、蛋白质和多元不饱和脂肪酸作用,造成DNA链断裂和氧化性损伤、蛋白-蛋白交联、蛋白-DNA交联和脂质过氧化。脂质过氧化是造成生物体氧化损伤的主要原因,它使脂的通透性增加,膜结构及其功能受到损伤,最终对生物体造成损伤[7]。抗氧化系统包括还原性谷胱甘肽(GSH),过氧化氢酶(CAT), 超氧化物歧化酶(SOD)等,在消除氧自由基,维持细胞氧化还原平衡中发挥重要作用。尽管有很多报告指出OA能够诱导细胞凋亡,但是各种信号之间的转导途径的精确连接以及它们的活化机制,到目前为止还不是很清楚。在我们的学习中,就关于OA能引起细胞凋亡和氧自由基的关系,测定在消除自由基和抗氧化反应中起重要作用的3种物质:还原性谷胱甘肽(GSH)、过氧化氢酶(CAT)、 超氧化物歧化酶(SOD)的活性变化,旨在找出其中可能的特异性敏感标识物,也为后续试验奠定基础。
1 材料和方法
1.1 毒素及试剂
软海绵酸(OA)购自伊普瑞斯科技有限公司(17.7 μM/L 14.2 μg/mL),毒素标准品用于攻毒时稀释10倍。甲醇(小鼠腹膜半数致死量260 mg/kg);实验所用试剂盒:过氧化氢酶(CAT)测定试剂盒;超氧化物岐化酶(SOD)测定试剂盒;还原性谷胱甘肽(GSH)测定试剂盒均购自南京建成生物技术公司。
1.2 实验器械及仪器
制冰机(GRANT FM 70A);高压灭菌锅(SYSTEC VX-100;HIRAYAMA);微孔板式连续光谱测试系统(Spectra max plus384);离心机(Mikro 22 R)。
1.3 实验动物
Balb/C实验鼠(雄性),体重20~30 g,年龄均为5周龄。购自北京大学第三附属医院动物房。
1.4 鼠的攻毒方式与剂量
攻毒剂量依据NRC小鼠腹腔注射的LD50(192 μg/kg)进行剂量的确定。将实验鼠随机分为5组,每组10只。剂量组分为:高剂量组(96 μg/kg),中剂量组(48μg/kg),低剂量组(24 μg/kg),溶剂对照组和空白对照组。溶剂对照所用为甲醇(Methanol),按照高剂量组(96 μg/kg)注射剂量注射。于攻毒24 h后取其肝脏制备10%组织匀浆液,然后测定酶活含量。
1.5 指标测定
染毒24 h后处死小鼠取出肝脏,制备10%组织匀浆,按照购买的测试试剂盒的操作说明进行各种指标的测定。
1.610%组织匀浆的制备
1)取组织块(0.2~1 g)最少可到2~5 mg,在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称重,放入5或10 mL的小烧杯内。
2)用移液管量取预冷的匀浆介质(pH值7.4, 0.01 mol/L Tris-HCL, 0.0001M/LEDTA-2Na, 0.01 mol/L蔗糖0.8%的氯化钠溶液)或者用0.86%冷生理盐水,匀浆介质或生理盐水的体积总量应该是组织块重量的9倍,用移液管或移液器取总量的2/3的匀浆介质或生理盐水于烧杯中,用眼科小剪尽快剪碎组织块(天然操作时要在冰水浴中进行,将盛有组织的小烧杯放入冰水中)。
3)将剪碎的组织倒入玻璃匀浆管中,再将剩余的1/3匀浆介质或生理盐水冲洗残留在烧杯中的碎组织块,一起倒入匀浆管中进行匀浆,左手持匀浆管将下端插入盛有冰水混合物的器皿中,右手将捣杆垂直插入套管中,上下转动研磨数十次(6~8 min),充分研碎,使组织匀浆化。
4)将制备好的10%匀浆用普通离心机或低温低速离心机3000 r/min左右离心10~15 min。
5)样品放于4℃保存,进行酶活测定。
1.7 数据统计
使用SPSS9.1分析软件进行数据分析。剂量组组间差异性采用t检验的方式表示,P<0.05表示差异有显著变化。
2 结果
2.1 OA毒素对小鼠肝脏GSH活性的影响
小鼠肝脏GSH活性随OA的浓度变化如图1所示。小鼠染毒24 h后,溶剂对照组(甲醇)和空白对照组的GSH活性显著性不明显(P>0.05),在试验所设的各剂量组GSH活性明显低于空白对照组(P<0.05),随着染毒浓度的增加,GSH的活性也逐渐降低,在高剂量组(96 μg/kg)GSH的活性最小,但是高剂量组(96 μg/kg)和中剂量组(48μg/kg)的GSH活性变化值差异性不显著(P>0.05)。
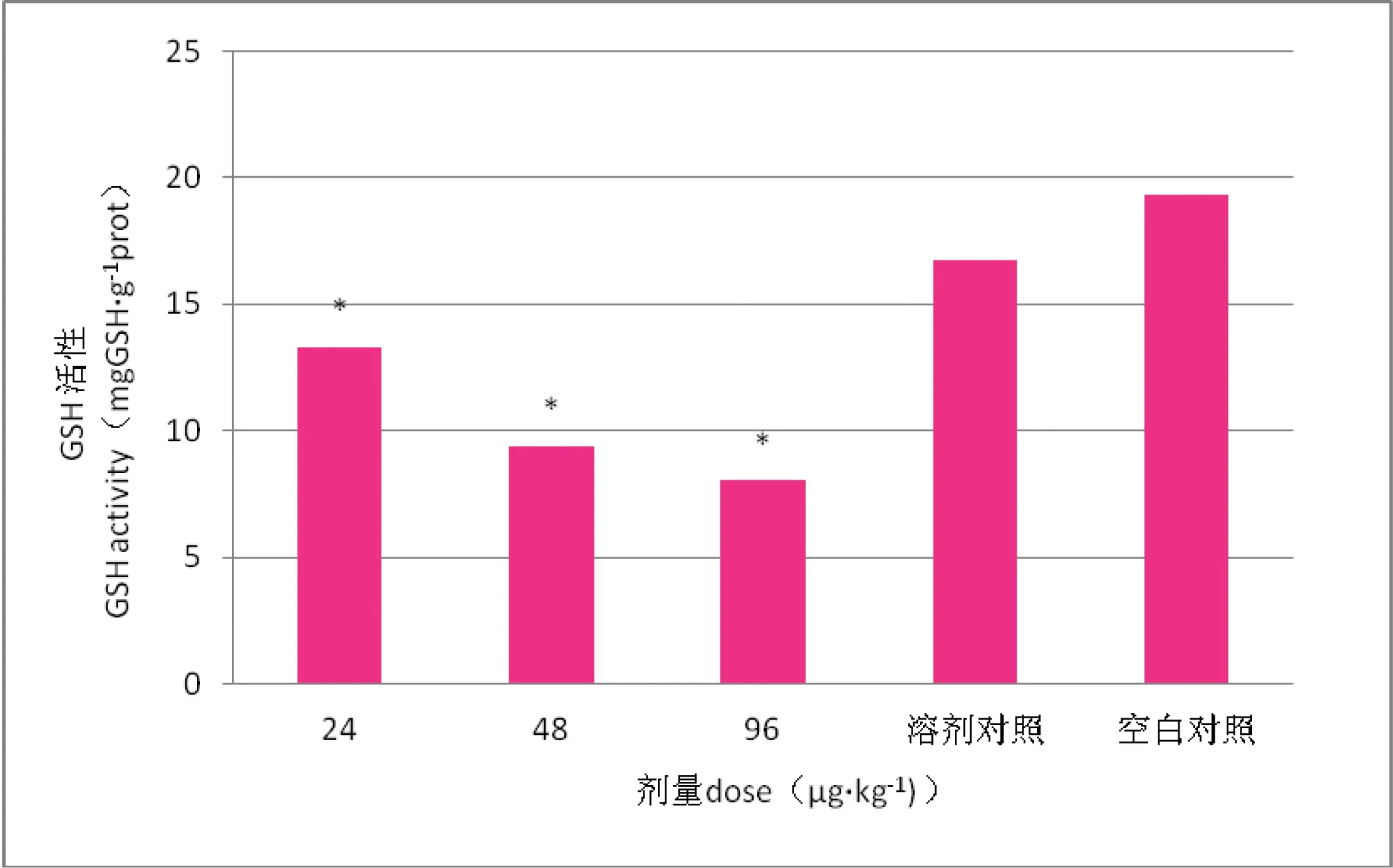
*—与对照组比较P<0.05。
2.2 OA毒素对小鼠肝脏CAT的活性的影响
小鼠肝脏CAT活性随OA浓度变化如图2所示,小鼠在染毒24 h后,溶剂对照(甲醇)组和空白对照组的CAT活性没有显著差异(P>0.05),染毒浓度在低剂量组(24 μg/kg)时,CAT活性比起空白对照组就已受到显著(P<0.05)的抑制效应。随着染毒浓度的升高,各浓度组受到的抑制效应越强烈,在高剂量组(96 μg/kg)时CAT活性达到最小值。

*—与对照组比较P<0.05。
2.3 OA毒素对小鼠肝脏SOD的活性的影响
小鼠肝脏SOD活性随染毒浓度的变化如图3所示,小鼠在染毒OA, 24 h后溶剂对照组(甲醇)和空白对照组的SOD活性差异不显著(P>0.05)。染毒浓度在低剂量组(24 μg/kg)时SOD的活性已受到显著的抑制作用(P<0.05),随着染毒浓度的增高,SOD的活性受到的抑制效应也越强,在高剂量组(96 μg/kg)时SOD活性最小,但是数据统计显示各浓度组差异并不显著(P>0.05)。

*—与对照组比较P<0.05。
3 结论
小鼠肝脏各种酶GSH、CAT、SOD的活性,小鼠在感染OA毒素后,随着染毒浓度的增加,GSH的活性也逐渐降低,在高剂量组(96 μg/kg)GSH的活性最小,而CAT和SOD的活性,均为低剂量OA毒素对CAT和SOD的活性均有显著抑制效应, 随着染毒浓度的升高,各浓度组受到的抑制效应越强烈,在高剂量组(96 μg/kg)时CAT活性达到最小值。
4 讨论
随着环境污染的加剧和水生生物栖居环境的日益恶化, 有毒藻类大量的繁殖对生物生理功能和抗氧化防御机制的影响受到了广泛关注和探究。有研究认为,因外来异物胁迫而引起抗氧化酶活性的改变, 可在一定程度上反应出机体处于逆境胁迫下的生理状态, 并对一些早期污染物具有生物指示作用[8, 9]。探讨以抗氧化酶活性的变化规律作为污染监测的生物标识物的可能性成为一项十分重要的课题项目[10]。
本次研究的结果显示,小鼠染毒24 h后,空白对照组和溶剂对照组的GSH的活性,CAT酶活性值和SOD酶活性变化显著性不明显(P>0.05),说明溶剂甲醇对动物机体抗氧化酶系统没有产生显著性的影响,当毒素作用于动物机体时不会产生显著影响。GSH是存在于组织中消除氧化损伤的一种重要的分子, 机体GSH含量的变化直接也可以反应机体抗氧化能力[11, 12]。本次研究试验中,染毒剂量组的GSH活性显著低于对照组,表明染毒OA后,肝细胞的抗氧化能力受到抑制,细胞膜的完整性受到损伤。GSH活性在高剂量组(96 μg/kg)和中剂量组(48 μg/kg)间差异性并不显著(P>0.05),表明在这2个剂量组间抑制效应的增加并不明显。表明在本试验中这2个浓度毒素作用对GSH的含量变化没有显示出明显的剂量-效应关系。CAT是抗氧化胁迫反应中最为重要的酶,它可以分解氧化胁迫和SOD岐化反应产生的H2O2,保护细胞免受损伤[13]。在本次试验中,染毒剂量组的CAT活性显著低于对照组(P<0.05),并且随着染毒剂量的升高,CAT活性越来越低,各浓度差异性也很显著(P<0.05),显示了一定的剂量-效应关系。许多研究表明SOD是细胞抗氧化系统对抗细胞损伤的一种重要的酶,也是指示氧化胁迫的一种重要的指示酶[14]。在本次研究中,SOD活性受到显著抑制(P<0.05),表明肝脏细胞中存在大量氧自由基,并已经引起细胞损伤和DNA损伤,从而导致SOD活性降低。随着染毒剂量的增加,SOD活性变化不显著,表明SOD在本次试验的OA各个浓度组并不敏感。
已经有大量有关毒素对小鼠中枢神经系统急性毒性和免疫保护性研究[15-18],但OA对小鼠肝脏各种免疫因子相关酶的影响尚鲜有报道。
通过本次试验得知,OA毒素作用于动物机体后,会引起机体抗氧化物系统(CAT、SOD、 GSH)的活性的变化,其中以CAT活性变化较为显著,呈现了良好的剂量-效应关系,有望成为OA毒素的特异指示酶。同时也为我们进一步的细胞水平和分子水平的实验奠定了一定的基础。
参考文献:
[1]Haystead T A, Sim A T, Carling D, et al. Effects of the tumour promoter okadaic acid on intracellular protein phosphorylation and metabolism[J]. Nature, 1989, 337:78-81.
[2]Suganuma M, Tatematsu M, Yatsunami J, et al. An alternative theory of tissue specificity by tumor promotion of okadaic acid in glandular stomach of SD rats [J]. Carcinogenesis, 1992, 13 (10) : 1841-1845.
[3]Fujiki H, Suganuma M. Tumor promotion by inhibitors of protein phosphatases1 and 2A:the okadaic acid class of compounds[J]. Adv Cancer Res, 1993, 61:143-194.
[4]Lago J, Santaclara F, Vieites J M, et al. Collapse of mitochondrial membrane potential and caspases activation are early events in okadaicacid-treated Caco-2 cells[J]. Toxicon, 2005, 46: 579-586.
[5]Hancock J T, Desikan R, Neill S J. Role of reactive oxygen species in cell signalling pathways[J]. Biochem Soc Trans, 2001, 29: 345-350.
[6]张景飞,王晓蓉. 2, 4-二氯苯酚低浓度长期暴露对鲫鱼肝脏抗氧化系统的影响[J].环境科学,2003,24(5):136-140.
[7]罗 义, 施华宏, 张景飞.分子生物标志物在污染环境早期诊断和生态风险评价中的应用[J].环境化学,2006, 25(3):320-325.
[8]Steidinger K A. Sume taxonomic and biological species of toxic dinoflangellates[J]. Algal Toxins in Seafood and Drinking Water, 1993, 2: 1-28.
[9]徐镜波. M-DNB 和 P-DNB 对鲤鱼肝脏过氧化氢酶活性的影响[J].中国环境科学, 1999,19 (2):141-144.
[10]冯 涛,郑微云,郭祥群, 等.苯并(a)芘对大弹涂鱼肝脏过氧化氢酶活性的影响[J].生态学杂志,2001, 20(5):73-75.
[11]贾秀英 陈志伟.镉对鲫鱼组织转氨酶和过氧化氢酶活性的影响[J].环境污染与防治, 1997, 20(5):73-75.
[12]Pompella A, Visvikis A, Paolicchi A, et al. The changing faces of glutathione, a cellular protagonist[J].Biochem Phar, 2003, 66:1499-1503.
[13]Halliwell B, Gutteridge J. Free radicals in biology and medicine[M]. Third ed Oxford, New York: 2000, 10: 279-298.
[14]Hayes M A, Timmins A C, Yau E H, et al. Oxygen transport patterns in patients with sepsis syndrome or septic shock: in fluence of treatment and relationship to outcome[J]. Crit Care Med, 1997, 25:926-936.
[15]张 镭, 王敏伟, 宫泽辉. 芋螺毒素SO3对小鼠中枢神经系统作用的研究[J]. 解放军药学学报, 2006, 22(4): 254-261.
[16]严克霞, 刘建杰, 周 锐, 等. 重组猪胸膜肺炎放线杆菌毒素ApxI对小鼠的急性毒性和免疫保护性研究[J]. 生物工程学报, 2006, 22(1): 65-70.
[17]董 娜, 武军华, 贾培媛.蓖麻毒素细胞毒性及其中毒小鼠组织病理改变[J]. 军医进修学院学报, 2013, 34(10): 12-18.
[18]Nigro F M, Benedetti M, Fattorini, et al. Antioxidant efficiency in early life stages of the antarctic silverfish,Pleuragrammaantarcticum: responsiveness to pro-oxidant conditions of platelet ice and chemical exposure[J]. Aquat Toxicol, 2005, 75: 43-52.
