利用人皮肤模型评价杀菌类农药的腐蚀/刺激性
2014-03-22张光甫刘薇邢立国胥维
张光甫,刘薇,*,邢立国,胥维
1. 大连理工大学环境学院工业生态与环境工程教育部重点实验室,大连 116024 2. 中化集团沈阳化工研究院有限公司,沈阳110027
化妆品、农药等接触类物质,依据安全管理要求,进入市场之前须经过皮肤腐蚀/刺激性测试。传统检测方法都采用活体动物皮肤实验,给实验动物造成巨大的痛苦,而且每年动物使用量呈逐年增加趋势,不符合“3R”原则[1]。为了减少动物使用,体外皮肤模型替代方法的开发和验证取得快速发展,开发了如Episkin、SkinEthic和EpiDerm皮肤模型等[2-4]。欧洲替代方法验证中心(ECVAM)经过大量的验证工作,于2007年4月公告Episkin可作为Draize皮肤刺激性替代方法,成为第一个被认证的模型,随后EpiDerm、SkinEthic也得到认证。2008年美国EPA、NIH和NIP协议未来十年内减少动物在化学品安全评价中的使用,欧盟立法2009年3月起禁止动物实验用于化妆品安全性评价[5],进一步推动了皮肤模型替代方法的发展和应用。我国在重组皮肤模型的研究,近年来也取得了较快的发展[6-8]。
目前体外皮肤模型在农药化学品评价中的应用非常有限,仍需进一步研究。我国作为农药品生产大国,农药品的腐蚀/刺激性替代方法的研究同样迫在眉睫。杀菌剂作为农药中重要的一类产品,近年来的使用量和整体比重呈上升趋势[9]。目前国内的皮肤腐蚀/刺激性检验,主要依据动物皮肤腐蚀/刺激性检测方法(GB15670-1995)。本研究通过人皮肤模型在杀菌类农药皮肤腐蚀/刺激性评价中应用,为动物实验替代方法用于农药类化学品安全性评价提供依据。
1 实验材料(Materials)
1.1 试剂与仪器
试剂:人表皮角化细胞(HEK)、成人真皮纤维原细胞(HDF-a)(上海佛雷堡生物有限公司),K-SFM培养基(Gibco公司),鼠尾胶原(北京鸿跃有限公司),DMEM培养基、0.25%胰酶(0.04%EDTA)、胎牛血清(Hyclone公司),MTT试剂(BioSHARP公司),TritonX-100、正辛酸、十二烷基硫酸钠SLS分析纯试剂(国药药业有限公司)、人白介素-1aELISA试剂盒(R&D公司),10种农药包括嘧菌酯原药、肟菌酯原药、丁香菌酯原药、唑胺菌酯原药、苯醚菌酯原药、唑菌酯原药、SYP-11545、SYP-14380、SYP-13409、SYP-12194纯度均在95%以上(中国中化集团公司提供)、大耳白兔(日本)。
仪器:Transwell细胞培养板(Corning公司),倒置显微镜(CKX31,Olympus公司),CO2培养箱(Sanyo公司),离心机(5430,Eppendorf公司),多功能酶标仪(BIO-TEK公司)。
1.2 实验方法(Methods)
1.2.1 人皮肤模型的建立
人皮肤模型的构建方法,依据EpiDerm的构建原理。皮肤模型包括表皮层和真皮层两部分,分别通过利用成人真皮纤维原和鼠尾胶原模拟具有支撑作用的真皮层,利用人角化细胞模拟上面的表皮层,从而得到构建的皮肤模型[10-11]。
由人成纤维细胞和鼠尾胶原蛋白混合培养模拟真皮层。(1)将生长状态良好的人成纤维细胞消化、重悬,制成约为5×105个·mL-1浓度的细胞悬液;(2)冰浴条件下,取1 mL鼠尾胶原与60 μL 0.1 mol·L-1NaOH溶液混合;(3)迅速将鼠尾胶原混合液与4 mL细胞悬液混合;(4)将以上混合液以每孔600 μL的量加入Transwell,在37 ℃培养箱中放置0.5~1 h,待胶原凝固后,加入2 mL含10%胎牛血清的DMEM培养基,浸没培养5~6 d,隔天换液。
HEK细胞在上述真皮层基质表面上模拟表皮层。(5)接种2×106个·mL-1浓度的人角化细胞,同时更换为K-SFM培养基,隔天换液。(6)每天观察细胞生长状态,当表层角化细胞融合率达90~95%时,改为气液培养5~6 d,表面细胞角质化,获得所需的人皮肤模型。
1.2.2 人皮肤模型的屏障功能测试
皮肤模型方法相比细胞毒性实验,其三维结构更好的模拟了人皮肤,可反映不同细胞之间的级联毒性作用。且细胞实验对低溶解度化合物进行测试时,结果可能受助溶剂干扰,而人皮肤模型则不受测试物的剂型的影响。同时皮肤模型模拟了皮肤中具有屏障功能的角质层,提高其与动物测试方法结果的一致性。利用1%聚乙二醇辛基苯基醚(TritonX-100)评价皮肤模型的屏障功能[2]。TritonX-100(1%)在皮肤模型上作用不同时间点t=0、1、2、3、4、5 h,用无菌PBS冲洗皮肤模型5~6次,最后利用MTT法测定模型活性(OD570),计算得出组织活性减少50%时所需的作用时间(ET50)。
进一步利用十二烷基硫酸钠(SLS)对皮肤模型屏障性验证[12],将不同浓度SLS(c=0、0.16、0.8、4、20、100 mg·mL-1)作用于皮肤模型,作用时间达到18 h后,用无菌PBS去掉残留农药,最后用MTT法测定组织模型活性(OD570),计算组织活性减少50%时,所需的暴露剂量(IC50)。
1.2.3 皮肤腐蚀和刺激性测试方法
皮肤模型腐蚀性测试方法参考OECD化学品测试指南(TG431)[13]。待测化学物按25 μL·cm-2(液体)或25 mg·cm-2(固体),均匀作用于皮肤模型(N=3)3 min或1 h,之后利用MTT法测定组织模型的活性。通过相对细胞活性评价待测品的腐蚀性。
皮肤模型的刺激性测试方法,依据OECD化学品测试指南(TG439)[14]。首先待测化学物按25 μL·cm-2(液体)或25 mg·cm-2(固体),均匀涂于皮肤模型作用15 min,之后用无菌PBS冲洗,再将皮肤模型转移到新培养基中继续培养42 h,最后通过测定培养基中组织活性和白介素-1a,判断待测品的刺激性。白介素-1a(IL-1a)是皮肤受到刺激时,产生的一种细胞因子,含量与待测物的刺激性存在剂量效应关系[15]。皮肤模型暴露42 h后,通过ELISA法测定培养基中IL-1a含量,首先取42 h培养后的培养液和试剂盒中的IL-1a标准品,分别按40 μL和50 μL的量加入96孔板,每个样品做2个平行对照;在样品孔中加入10 μL一抗和50 μL的酶标试剂,标准品中只加50 μL酶标试剂,盖上封板膜37 ℃温育60 min;洗涤液洗板5次,加入A、B两种显色液,避光37 ℃显色10 min,最后每孔加入50 μL终止液,在450 nm处测定吸光度。利用标样首先绘制标准曲线:Y=0.009X+0.021,当X=60时,Y=0.561。根据绘制的标准曲线和酶标仪450 nm处对样品的测定结果,计算IL-1a含量并用pg·mL-1表示。即:光吸收值大于0.561时,该农药品能使皮肤组织模型IL-1a量超过60 pg·mL-1,说明该农药品具有皮肤刺激性。
人皮肤模型对杀菌类农药品的腐蚀性/刺激性测试,每种受试物进行3个平行测试,采用无菌PBS作为阴性对照,分别采用正辛酸和SLS作为腐蚀性和刺激性测试的阳性对照物。
1.2.4 农药腐蚀/刺激性动物测试
参考OECD和我国化学品腐蚀/刺激性试验方法(OECD TG404;GB15670 -1995)设计试验[16-17]。
液体受试物0.5 mL,固体受试物用0.5%的羧甲基纤维素配制0.5 g·mL-1的悬浊液涂在2.5 cm×2.5 cm大小去毛的一侧皮肤上,另一侧皮肤作为对照,每组4只兔子平行对照,涂匀后用无刺激性的绷带和胶布固定。未知受试物具有腐蚀性的情况下,测试过程分3步观察:(1)作用3 min后移去观察,如未见严重的皮肤反应,继续作用至1 h后观察。(2)无明显反应下,作用4 h后观察皮肤症状,判断是否具有腐蚀性。(3)无明显反应下,对兔子皮肤连续观察24、48、72 h后结束实验,如出现损伤观察14 d结束,根据皮肤损伤的程度及恢复情况给出评分,判断刺激性。
1.2.5 数据处理与判定标准

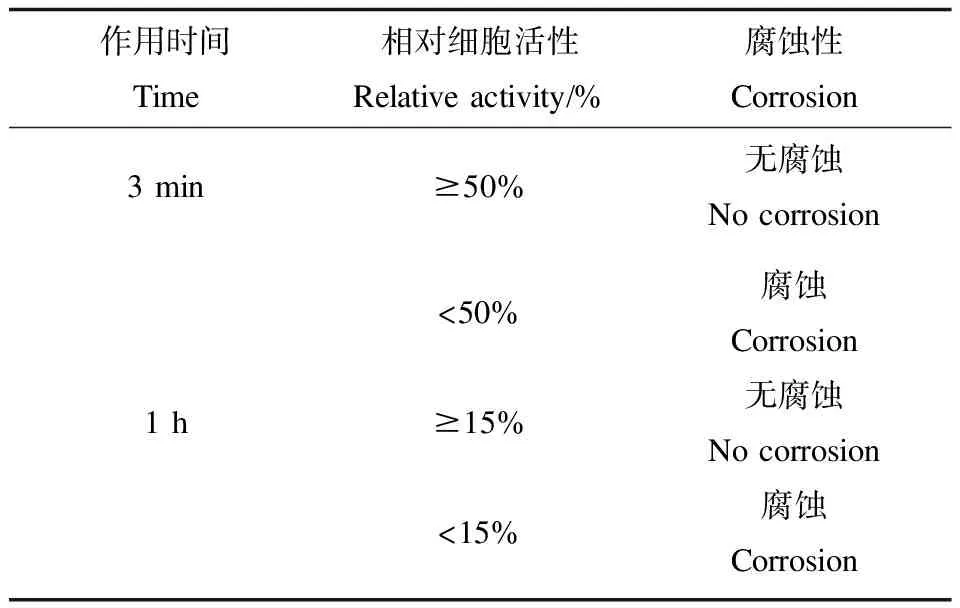
表1 腐蚀性鉴别标准Table 1 Standard of corrosion identification

表2 刺激性鉴别标准Table 2 Standard of irritation identification
2 结果与讨论(Results and discussion)
2.1 人皮肤模型的功能评价
本研究建立的皮肤模型阴性对照组细胞相对活性大于0.6,证明皮肤模型具有良好的活性。本研究中,TritonX-100对人皮肤模型的细胞活性的影响,随时间的延长其活性降低。通过表3的时间-效应关系得出ET50为2.2 h。本实验为更充分的验证皮肤模型屏障功能,又选用了SLS对人皮肤模型进行不同浓度的作用测试。表3给出了在不同浓度SLS作用18 h后的相对细胞活性。SLS对皮肤模型的IC50为1.71 mg·mL-1。参考物质TritonX-100和SLS2种化学品对人皮肤模型的ET50大于2 h,IC50在1.0~3.0 mg·mL-1范围,符合相关参考标准[13-14,18]。
皮肤腐蚀/刺激性的传统方法是借助实验动物,观察动物皮肤对受试物的反应。其生理机制是化学分子透过角质层,损伤细胞引起细胞的死亡,从而释放大量的细胞因子,激活炎症反应信号通路。炎症分子进一步作用于真皮细胞中的基质细胞和内皮细胞,内皮细胞扩张通透性增加最终导致红斑和水肿。体外构建的皮肤模型测试方法不同于二维细胞毒性试验,因为细胞毒性方法中的细胞微环境相对皮肤模型与真实皮肤的差异更大,并且忽略了不同细胞之间的相互作用。而体外皮肤模型替代实验方法正是针对此级联效应和初始反应设计的。角质层的形成使皮肤模型模拟了受试物与皮肤的作用机制,显著提高了体外皮肤模型测试结果与动物试验方法的一致性,因此体外皮肤模型的屏障功能评价是该替代方法的重要质量控制/质量保证措施。此外,阳性对照物正辛酸和SLS的鉴别结果准确(表4,5)。表明本研究建立的人皮肤模型具有较好的性能,能够准确反映受试化合物的皮肤腐蚀性/刺激性。
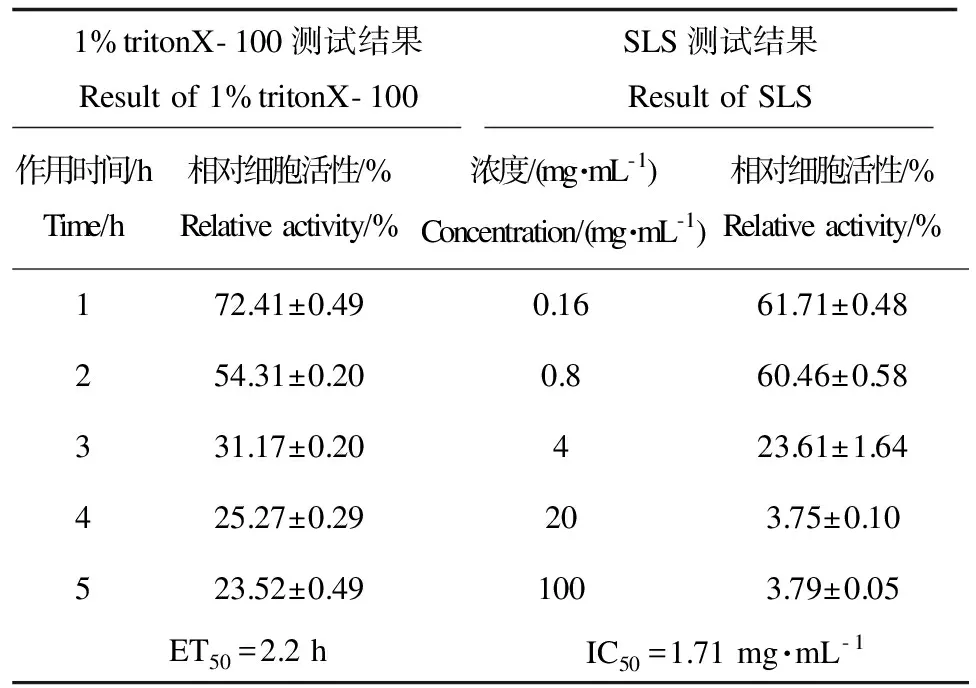
表3 人皮肤模型的屏障功能测试Table 3 Test of the barrier function of the human skin model
2.2 人皮肤模型对杀菌类农药品的腐蚀性测试 3组平行测定的结果,满足RSD≤18%的要求。在对杀菌类农药品的动物实验时,发现在3 min、1 h、4 h暴露作用时间点的皮肤反应中,没有明显的变化和损伤。在人皮肤模型对10种杀菌类农药品3 min暴露作用的腐蚀性预实验中,测定相对细胞活性都在97%以上。1 h后相对细胞活性降低到61.7~96.0%。3 min时可能由于农药品与皮肤模型作用时间较短,难以充分反应受试物对皮肤模型的腐蚀性。因此本实验采用了1 h暴露作用时间,根据1 h后的相对细胞活性判断,受试物属于无腐蚀性(表4)。比较皮肤模型和动物测试结果(表4,5),可得出两者的鉴别结果完全一致。
2.3 人皮肤模型对杀菌类农药品的刺激性测试
细胞活性作为检测终点时,皮肤模型对杀菌类农药品刺激性筛选鉴别结果(图1)发现农药品3(丁香菌酯)、5(苯醚菌酯)和7(SYP-11545)具有刺激性,其它无刺激性。动物皮肤刺激性测试结果(表5)表明,农药品3(丁香菌酯)和4(唑胺菌酯)有刺激性,其它无刺激性。两种测试方法结果的准确性为70%,进一步对刺激性相关的细胞因子(IL-1a)进行定量分析。刺激反应引起细胞因子包括IL-1a、IL-2和IL-8等[19],其中IL-1a是OECD推荐的一种。Chatterjee等[20]利用皮肤模型对IL-1a和IL-8两种因子的“时间-剂量”关系分析,发现IL-1a具有更好的对应关系。根据表2的刺激性筛选标准,对相对细胞活性大于50%的测试组进行IL-1a的定量分析。
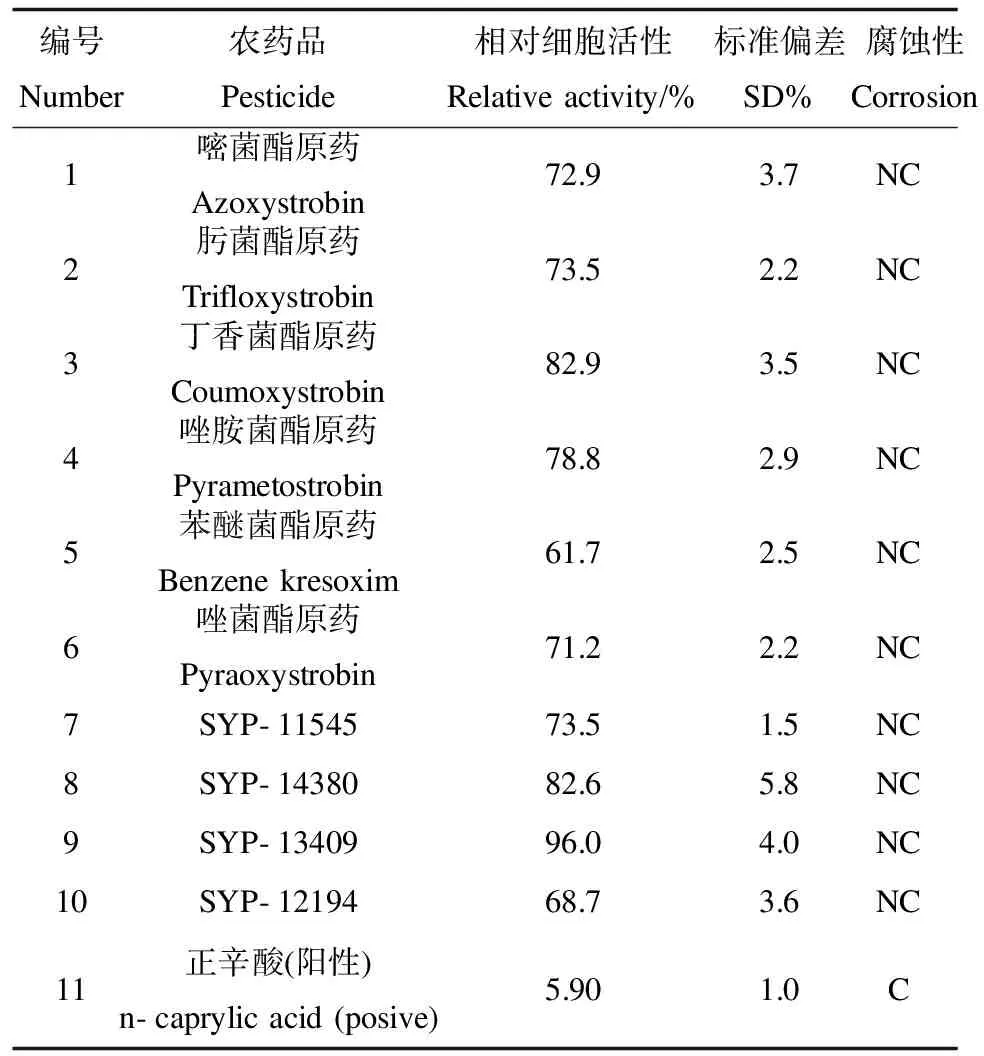
表4 杀菌类农药对人皮肤模型的腐蚀性Table 4 The corrosion of pesticide on human skin model
注:C表示具有腐蚀性;NC表示为无腐蚀性
皮肤模型刺激性结果中相对细胞活性大于50%农药品的IL-1a测定结果见图1。结合细胞相对活性和IL-1a测定结果,具有刺激性的农药品为3(丁香菌酯)、4(唑胺菌酯)、5(苯醚菌酯)和7(SYP-11545),动物实验和体外皮肤模型的准确性提高到80%。
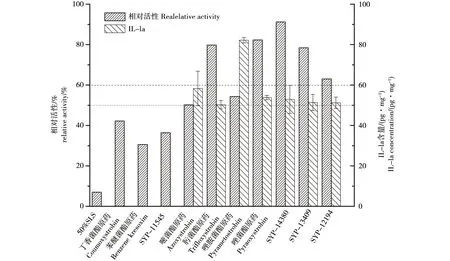
图1 杀菌类农药对人皮肤模型的刺激性Fig. 1 The irritation of pesticide on human skin model
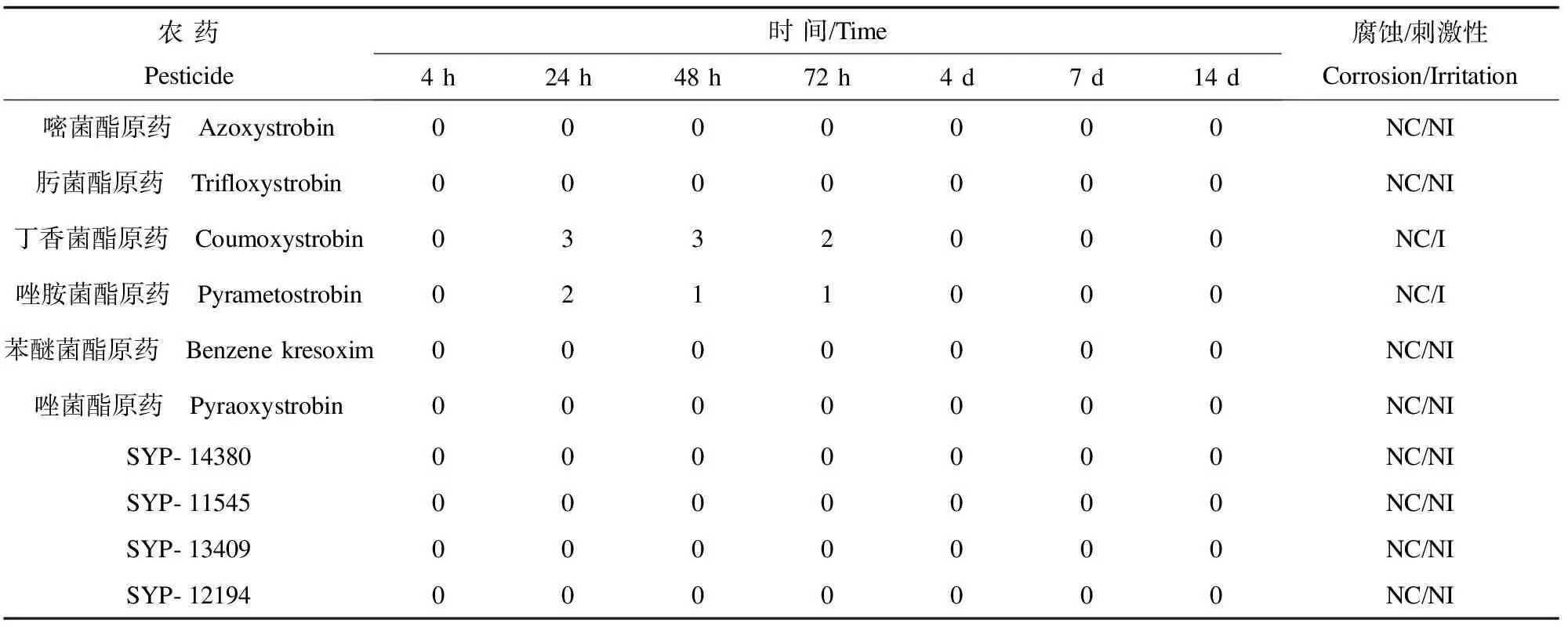
表5 杀菌类农药的动物皮肤测试结果Table 5 The corrosion/irritation of pesticide on animal skin
目前国际和国内在体外皮肤模型的研究与应用上,已取得一定成果。目前体外皮肤模型真皮层的模拟,包括用无活性的聚合物模拟和具有活性的成纤维细胞作为真皮层。其中采用具有活性的成纤维细胞构建的人皮肤模型,能够更准确模拟真实人皮肤组织。且人皮肤模型目前主要应用于化妆品的安全性评价[6-8,21-23],鲜有利用皮肤模型在农药的应用。农药的腐蚀/刺激性评价是安全评价中重要的部分。利用人皮肤模型替代动物皮肤测试,将会大量减少动物的使用量,替代实验的研究是今后安全性评价发展的趋势。本研究利用构建的人皮肤模型检测农药的腐蚀/刺激性,采用1 h暴露作用时间的腐蚀性测试,其结果与动物实验的一致率为100%。刺激性测试中,通过相对细胞活性和IL-1a含量两个终点信号的测定,使皮肤模型的结果与动物实验的准确性达到了80%。皮肤模型在杀菌类农药的应用初步表现出良好的性能,通过模型建立的优化和测试终点的筛选,在农药的安全性评价中有良好的应用前景。此外,目前对于体外皮肤模型的建立,所使用材料如Transwell培养板的价格较昂贵,廉价或可重复利用支架材料的开发,将会有利于降低实验成本,促进人皮肤模型的推广和应用。
致谢:感谢沈阳化工研究院安全性评价中心谢明工程师在实验中的支持和帮助。
参考文献:
[1] Frank N, Lehr C M. The human epidermis models EpiSkin, SkinEthic and EpiDerm: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity and substance transport [J]. Pharmaceutics and Biopharmaceutics, 2005, 6: 167-178
[2] Kidd D A, Johnson M, Clements J, et al. Development of an in vitro corrosion/irritation prediction assay using the EpiDerm skin model [J]. Toxicology in Vitro, 2007, 21: 1292-1297
[3] Spielmann H, Hoffmann S, Liebsch M, et al. The ECVAM International Validation on in vitro tests for acute skin irritation: Report on the validity of the EMISKIN and EpiDerm assays and on the skin integrity function test [J]. Alternatives to Laboratory Animals, 2007, 35: 559-601
[4] Macfarlane M, Penny J. A tiered approach to the use of alternatives to animals testing for the safety assessment of cosmetics: Skin irritation [J]. Regulatory Toxicology and Pharmacology, 2009, 54: 188-196
[5] Andrea S, Oelgeschlager M. Developmental toxicity testing in the 21stcentury: The sword of Damocles shattered by embryonic stem cell assays? [J]. Archives of Toxicology, 2011, 85: 1361-1372
[6] 程树军, 秦瑶. 体外重建人体皮肤模型刺激试验的验证[J]. 实验动物与比较医学, 2012, 32(3): 243-246
[7] 邹运动, 郑洪艳. 基于人体皮肤模型的ECVAM体外皮肤刺激验证研究[J]. 毒理学杂志, 2008, 22(3): 226-229
[8] 程树军, 焦红. 体外构建的皮肤模型InspectskinI修复裸鼠全层皮肤缺损[J]. 中山大学学报, 2009, 30(2): 132-135
Cheng S J, Jiao H. Restoration of full-thickness skin defect in nude mice by skin model InspectskinI constructed in vitro [J]. Journal of Sun Yat-Sen University (medical sciences), 2009, 30(2): 132-135 (in Chinese)
[9] 宋卫国, 李宝聚, 赵志辉, 等. 杀菌剂安全风险及解决途径[J]. 中国蔬菜, 2008, 1(9): 1-4
[10] Tinois E, Tiollier J, Gaucherand M, Thivolet J, et al. In vitro and post-transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute [J]. Experimental Cell Research, 1991, 193: 310-319
[11] Cannon C L, Neal P J. New epidermal model for dermal irritancy testing [J]. Toxicology in Vitro, 1994, 8: 889-891
[12] Faller C, Bracher M. Reconstructed skin kit: Reproducibility of cutaneous, irritancy testing, skin pharmacol [J]. Skin Physiology, 2002, 15: 74-91
[13] OECD. OECD guidelines for the testing of chemicals, no. 431: In vitro skin corrosion; Human skin model test [S]. Paris, France, 2004
[14] OECD. OECD guidelines for the testing of chemicals, no. 439: In vitro skin irritation; Human skin model test [S]. Paris, France, 2010
[15] Angela C, Jackie Morton. The effects of nickel and chromium on human keratinocytes: Differences in viability, cell associated metal and IL-1a release [J]. Toxicology In Vitro, 2007, 21: 809-819
[16] OECD. OECD guidelines for the testing of chemicals, no. 404: Acute dermal irritation/corrosion. Organisation for Economic Co-operation and Development [S] Paris, France, 2002
[17] 国家农业部. GB15670-1995农药登记毒理学试验方法[S]. 国家技术监督局, 北京, 1995
[18] 程树军, 焦红. 建立体外重建人体皮肤模型刺激试验的验证标准[J]. 中山大学学报, 2009, 5(2): 183-189
Cheng S J, Jiao H. Validation criterion for reconstruct human skin model to skin irritation [J]. Journal of Sun Yat-Sen University, 2009, 5(2): 183-189 (in Chinese)
[19] 程树军, 潘芳. 体外皮肤刺激模型的生物标志研究进展[J]. 中国比较医学杂志, 2010, 20(3): 64-68
Cheng S J, Pan F. Progress on biomarkers of skin irritation model in vitro [J]. Chinese Journal of Comparative Medicine, 2010, 20(3): 64-68 (in Chinese)
[20] Abhijit C, Mandip S, et al. In vitro and in vivo comparison of dermal irritancy of jet fuel exposure using EpiDerm cultured human skin and hairless rats [J]. Toxicology Letters, 2006, 167: 85-94
[21] 李中良, 伍津津. 用于替代皮肤刺激试验的组织工程表皮模型的构建研究[J]. 中国修复重建外科杂志, 2011, 25(2): 129-132
Li Z L, Wu J J. Experimental study on constructing a tissue engineered epidermis for replacement of skin irritation in vitro [J]. Chinese Journal of Reparative and Reconstructive Surgery, 2011, 25(2): 129-132 (in Chinese)
[22] 金岩, 吕红兵. 人全层组织工程皮肤的研制[J]. 实用口腔医学杂志, 2002, 18(2): 163-166
Jin Y, Lv H B. Development of human tissue engineered skin with full thickness [J]. Journal of Practical Stomatology, 2002, 18(2): 163-166 (in Chinese)
[23] Ghalbzouri A, Siamari R. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential [J]. Toxicology in Vitro, 2008, 22: 1311-1320
