双齿许水蚤(Pseudodiaptomus dubia)对亚热带虾池Cu和Zn的富集
2014-03-22李长玲黄翔鹄蔡欣维
李长玲,黄翔鹄,江 东,蔡欣维
广东海洋大学水产学院,湛江 524088
集约化养殖导致池塘环境的自身污染和生态失衡,致使水产养殖动物疾病频繁爆发,尤其是对虾养殖越来越困难。为了提高对虾养殖的成功率,在养殖过程中大量使用化学药物来控制疾病的发生,一些含Cu和Zn等重金属的化学药物由于能杀死有害藻类和控制病原菌增殖而被大量使用,导致养殖环境的重金属污染[1-3],养殖废水排放致使海洋环境也受到重金属的严重污染[4]。水生生物对重金属具有富集性,以各种方式存在的重金属在进入养殖环境后会在生物体中存留和积累,并在各生物群落间迁移,通过食物链浓缩,从而对生物生长和发育产生不良影响[5-6]。有研究报道,重金属胁迫能够诱导生物体产生碱基改变、DNA 单双链断裂和染色体改变等DNA 损伤[7-9];水中的Cu和Zn能够使对虾体内磷酸酶活性减弱,减少对虾蜕皮次数,降低对虾养殖存活率,产品质量下降,甚至造成食品安全隐患[2]。双齿许水蚤(Pseudodiaptomusdubia)属于桡足亚纲(Copepoda)、哲水蚤目(Calanoida)、伪镖水蚤科(Pseudoiaptomidae)、许水蚤属(Pseudodiaptomus),是对虾养殖池塘中常见的浮游动物种类,在虾池食物链中占有重要的位置[10]。关于双齿许水蚤发育生物学和摄食的研究有相关报道[11-13],而对重金属富集的研究未见报道。本文通过对双齿许水蚤Cu和Zn富集的动力学及不同温度和盐度条件对富集效果影响的研究,探明双齿许水蚤对重金属污染物的富集规律,为对虾健康养殖提供理论依据。
1 材料与方法(Materials and methods)
1.1 材 料
1.1.1 实验用海水
海水取自湛江市东风码头海区,新鲜海水经沉淀砂滤、静置1 d,用350目的筛绢过滤,煮沸消毒冷却后使用。
1.1.2 双齿许水蚤采集与纯化培养
试验用的双齿许水蚤来自湛江市东海岛中联养殖有限公司对虾养殖基地的精养虾池,用浮游生物网采捕,样品带回实验室暂养于容积为50 L塑料桶中驯化培养,培养温度条件为28 ℃、光照度为60 μmol·m-2·s-1(L:D=12:12)、盐度为27,饵料为蛋白核小球藻(Chlorellapyrenoidosa)。
1.2 方 法
1.2.1 富集动力学实验
准确称取0.3928 g的CuSO4·5H2O、0.4378 g的ZnSO4·7H2O,分别溶解于少量的1 M(mol·L-1)稀硫酸中,再定容成1 L,获得100 mg·L-1的Cu、Zn标准贮备液溶液。分别量取4 mL Cu、Zn标准贮备液于500 mL三角瓶中,加入经处理的海水至400 mL,使实验水体Cu2+、Zn2+浓度分别为1 mg·L-1。根据预实验结果,在此实验浓度下双齿许水蚤能正常生存。每实验组设置3个平行,每瓶加入2 000只双齿许水蚤。实验条件为温度28 ℃,光照度60 μmol·m-2·s-1(L:D=12:12),盐度28。动力学实验取样时间为0、2、4、6、8、12、24、36、48 h;实验过程中每隔2 h摇瓶一次,取样前摇匀,采用过滤的方法收集样品,样品用烘箱在60 ℃的条件下烘干保存。
1.2.2 温度和盐度实验
温度梯度设为10、15、20、25、30、35、40 ℃,实验盐度为28;盐度梯度设为5、10、15、20、25、30、35,实验温度为28 ℃。实验在500 mL三角瓶中进行,实验体积为400 mL,每瓶加入2 000只双齿许水蚤,置于光照培养箱中培养,光照度设为60 μmol·m-2·s-1(L:D=12:12),每组设置3个平行。实验时间为24 h,每隔2 h摇瓶一次。样品收集方法同上。
1.2.3 样品的处理和测定
样品的消化和测定均按照GB17378.6-2007《海洋监测规范》规定的方法。样品中重金属含量用Hitachi火焰原子吸收分光光度计(型号:Z-5000)进行测定。测定过程用Cu标准溶液和Zn标准溶液(国家标准物质)制作标准曲线,根据标准曲线计算出双齿许水蚤体内重金属的含量。测定结果以浮游生物中微量元素标准品进行质量控制。
1.2.4 动力学参数计算
双齿许水蚤对重金属的富集和排出是同时进行的过程,可利用双箱动力学模型进行富集和排出动力学参数计算[14],公式如下:
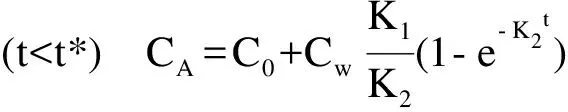
(1)
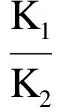
(2)
(3)
最大富集量CAmax=BCF×Cw
(4)
其中,K1为生物吸收速率常数;K2为生物排出速率常数;Cw为水体污染物浓度(mg·L-1);CA为生物体内污染物浓度(mg·g-1);C0为生物体内污染物初始浓度(mg·g-1);t为实验进行的时间(h);t*为富集阶段结束时实验进行的时间(h) 。
1.2.5 生物体内重金属浓度的计算
换算公式[14]:
(5)
式中,X为样品中的重金属含量(mg·g-1);Cl为样品液中的重金属含量(mg·L-1);C0为空白液中的重金属含量(mg·L-1);V为样品消化液定量总体积,即25 mL;d为稀释倍数;m为样品质量(g)。
2 结果(Results)
2.1 双齿许水蚤对Cu和Zn的富集动力学
双齿许水蚤对Cu的富集过程可分为快速、慢速和平衡3个阶段,快速富集过程在8 h以前,实验24 h时其富集达到平衡(图1)。
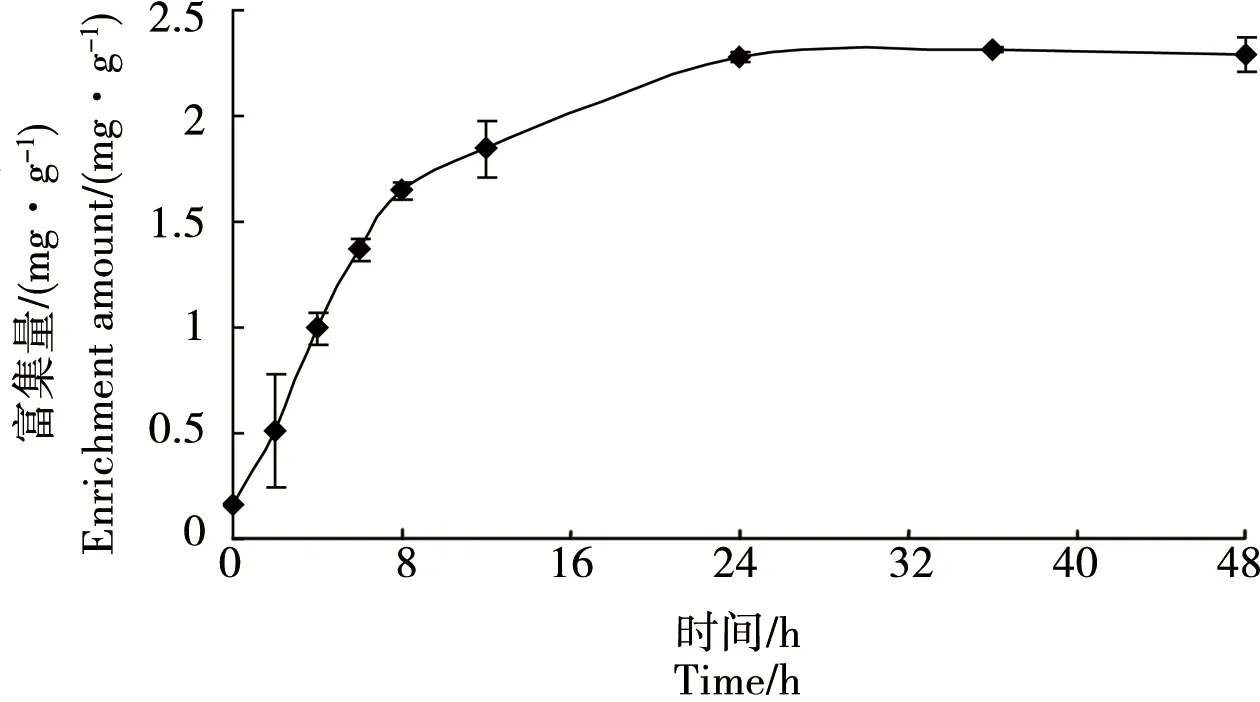
双齿许水蚤对Zn的富集过程同样可分为快速、慢速和平衡3个阶段,快速富集过程在8 h以前,实验24 h时其富集达到富集平衡(图2)。双齿许水蚤对Zn快速富集和慢速富集阶段的富集量与富集时间近似于线性关系,分别对其进行线性拟合,得线性方程分别为y=0.1914x+0.1705(R2=0.9926)、y=0.0388x+1.3549 (R2=0.9953)。
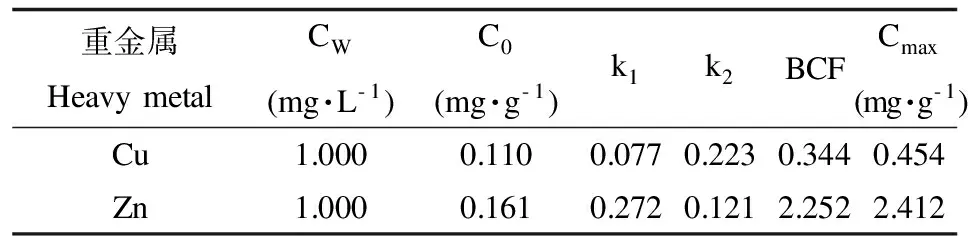
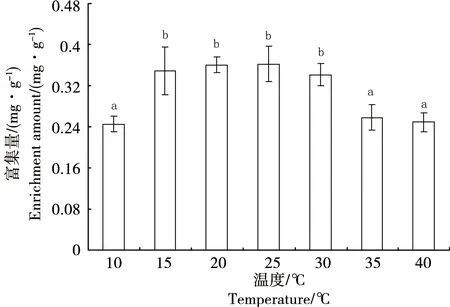
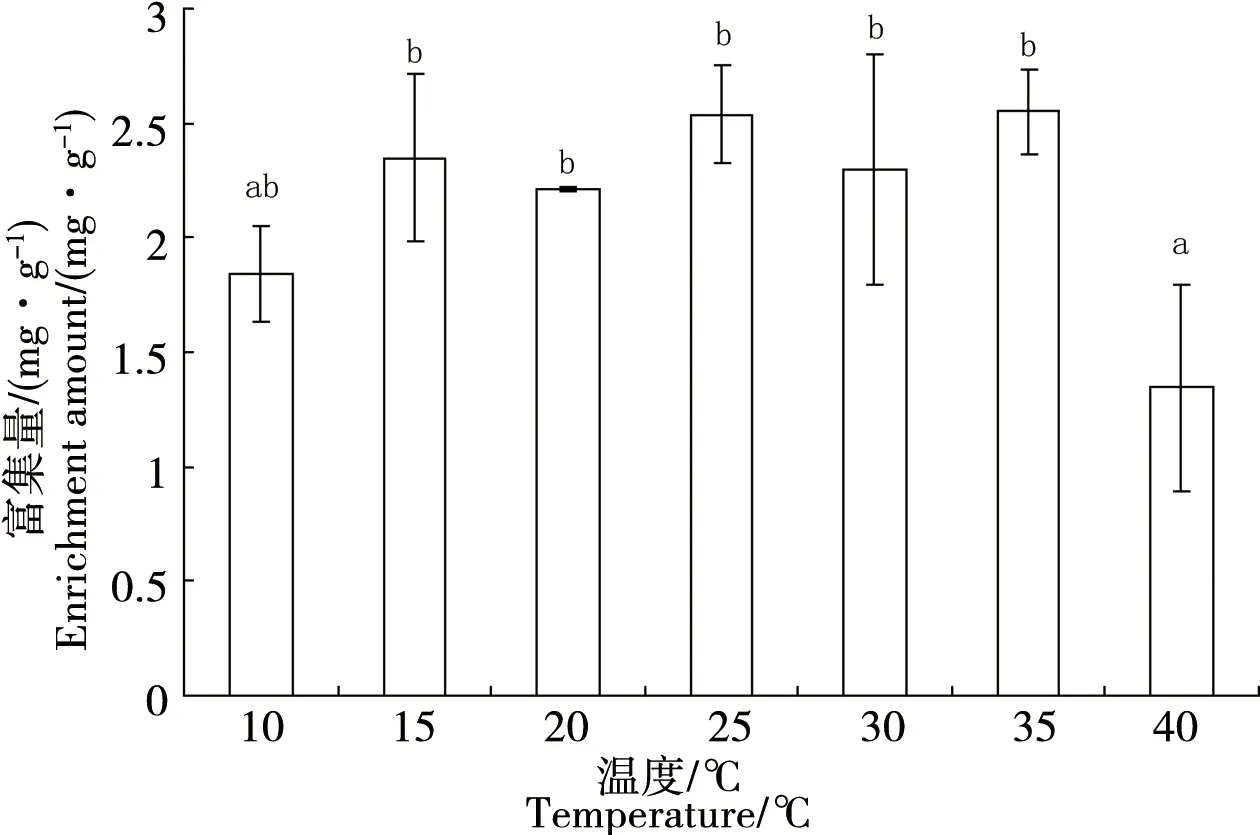
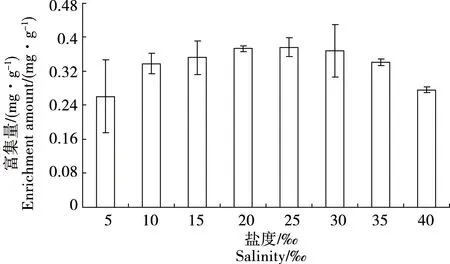
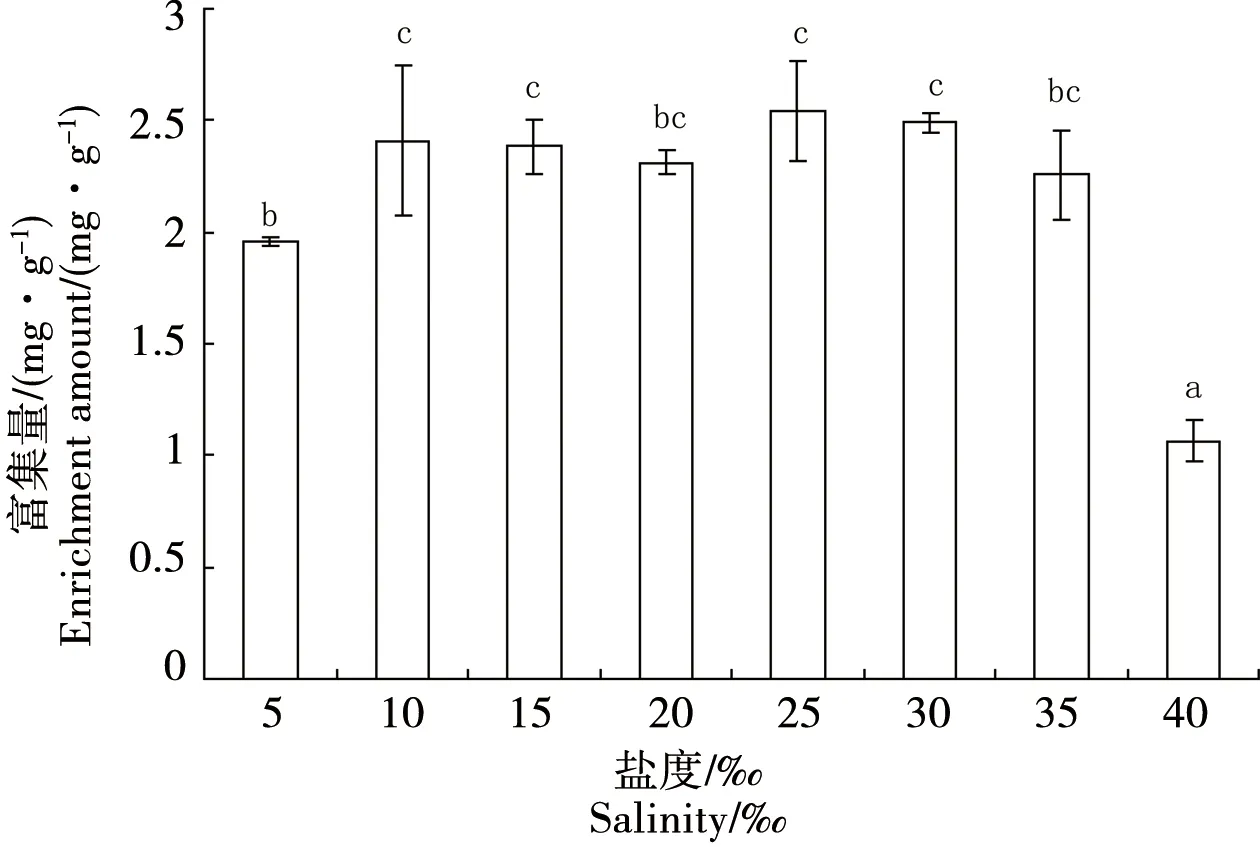
双齿许水蚤对Cu和Zn的富集速率常数表现为k1(Cu)= 0.077 图1 双齿许水蚤富集Cu的动力学曲线Fig. 1 Accumulation dynamics curve of Cu by Pseudodiaptomus dubia 图2 双齿许水蚤富集Zn的动力学曲线Fig. 2 Accumulation dynamics curve of Zn by Pseudodiaptomus dubia 表1 双齿许水蚤富集Cu和 Zn的动力学参数Table 1 Accumulation kinetic parameters of Cu and Zn by Pseudodiaptomus dubia 温度对双齿许水蚤富集Cu的富集量有显著影响(F=8.15,p<0.05),当温度10 ℃、35 ℃和40 ℃时,双齿许水蚤对Cu的富集均表现出低富集量,当温度为15 ℃时,其富集量比温度10 ℃时的富集量提高了29.09%(图3)。多重比较显示,温度为15~30 ℃各实验组的双齿许水蚤对Cu的富集量显著高于其他实验组,双齿许水蚤富集Cu的最适温度范围为15~30 ℃。 温度对双齿许水蚤富集Zn的富集量有显著影响(F=7.67,p<0.05),当温度10 ℃和40 ℃时,双齿许水蚤对Zn的富集均表现出低富集量,当温度为15 ℃时,其富集量相对于温度10 ℃时的富集量提高了27.46%(图4)。多重比较显示,温度为15~35 ℃各实验组的双齿许水蚤对Zn的富集量显著高于其他实验组,双齿许水蚤富集Zn的最适温度范围为15~35 ℃。 在实验盐度范围内,盐度对双齿许水蚤富集Cu的富集量没有显著影响(F=2.25,p>0.05),各实验组双齿许水蚤富集Cu的富集量平均为0.34 mg·g-1,均表现出较高的富集量(图5)。 图3 不同温度下双齿许水蚤对Cu的富集量Fig. 3 The accumulation of Cu by Pseudodiaptomus dubia at different temperature 图4 不同温度下对双齿许水蚤对Zn的富集量Fig. 4 The accumulation of Zn by Pseudodiaptomus dubia at different temperature 盐度对双齿许水蚤富集Zn的富集量有显著影响(F=16.00,p<0.01),随着盐度的增加,双齿许水蚤对Zn的富集量呈现出先增加后减小的趋势。当盐度达到25时,富集量达到最大,为2.54 mg·g-1;盐度增加到40,富集量下降到最低,为1.07 mg·g-1(图6)。多重比较结果显示,盐度为10~35范围的各实验组的富集量均显著高于其他实验组,双齿许水蚤富集Zn的适盐度范围为10~35。 图5 不同盐度下双齿许水蚤对Cu的富集量Fig. 5 The accumulation of Cu by Pseudodiaptomus dubia at different salinity 图6 不同盐度下双齿许水蚤对Zn的富集量Fig. 6 The accumulation of Zn by Pseudodiaptomus dubia at different salinity 浮游动物主要通过3种途径富集重金属:(1)从周围水环境中直接富集重金属,富集量在不同动物和金属种类间存在较大差异,如浮游动物体内的Zn有90%都来自周围水环境,但是通过这种方式对Cd和Se的积累却很少;(2)食物同化,即食物链传递,食物同化在很大程度上依赖于食物种类或食物中金属含量和形态;(3)生殖传递,通过这种方式传递的只有少数特定的金属,如生命活动必需金属,如硒、锌等,非必需金属,如汞/甲基汞等,传递给下一代的能力很强,而对于Cd却不能通过此种方式迁移[15-17]。本实验研究表明,双齿许水蚤直接从水环境中富集Cu和Zn,达到富集平衡时的富集量分别为0.454 mg·g-1和2.412 mg·g-1,对Zn的最大富集量大于Cu,这与大型溞(Daphniamagna)对Zn最大富集量大于Cu的结果相似[15]。生物富集速率常数k1代表了生物吸收金属的快慢程度,水环境中金属浓度一定的条件下,BCF可以表示生物对金属的富集能力。郭远明[14]研究发现,当环境周围的金属离子浓度相同时,单齿螺(Monodontalabio)对Cu和Pb的富集动力学参数k1(Cu)>k1(Pb),表明单齿螺对Cu的富集比Pb快,而BCF(Cu) 浮游动物对金属富集受到各种环境因素的影响,如酸碱度、硬度、金属离子浓度和温度[16,18]。温度对浮游动物、淡水蚌、海水贝类和虾类等水生动物富集金属均有影响[19-20]。温度不仅会影响水生动物生理和新陈代谢,而且对富集或排除污染物的路径和效率有很大影响。Tsui等[21]研究发现,温度会影响大型溞对环境中Hg的富集,该水蚤在14 ℃下对汞和甲基汞的富集率比在24 ℃分别降低了32%、73%。Heugens等[18]研究发现,在没有进行驯化的情况下,温度从10 ℃上升到26 ℃,浮游动物对Cd富集显著增加。此外,温度对重金属离子的吸收还与金属或生物种类有关,如随着温度增加,淡水等足类动物对Cd和Cu富集增加,而对Pb和Zn的富集并没有增加[22]。本实验结果显示,当温度为10~15 ℃时,双齿许水蚤对Cu和Zn的富集量显著上升(p<0.05),与温度成正相关,与Heugens等[18]人的研究结果一致。双齿许水蚤对Cu和Zn富集的最适温度范围为15~30 ℃。亚热带地区对虾养殖池塘的温度范围一般在20~30 ℃,因此,在我国华南地区对虾养殖池塘中双齿许水蚤对Cu和Zn有较强富集能力。 盐度变化会影响水生生物正常的生命活动,也能使水体金属形态和离子间的相互作用发生变化,从而影响金属的生物可利用性[23]。Phillips等[24]研究发现,不同盐度对贻贝(Mytilusedulis)累积Zn没有影响,而随着盐度的升高而降低,贻贝对Pb的累积会增加,对Cd和Cu的累积反而降低。Denton等[23]研究表明盐度对棘刺牡蛎(Saccastreaechinata)累积Cd和Pb有显著的影响,低盐度组牡蛎的Cd和Pb含量明显地高于高盐度组。Isaac等[25]研究发现,随着水环境中Na+浓度的增加,竞争富集显著降低大型溞对Ag+的富集量。本实验结果表明,在一定浓度范围内,盐度对双齿许水蚤Cu的富集没有显著影响,但均有较强的富集能力;盐度对双齿许水蚤Zn的富集影响显著,其富集强度与盐度成正相关,富集适宜的盐度范围为10~35,当盐度为40时,双齿许水蚤对Zn2+富集显著下降,这与Isaac[20]的研究结果一致。对虾养殖的盐度范围为10~30,在此条件下,池塘中浮游动物对重金属具有较强的富集能力。 双齿许水蚤是广东沿海对虾养殖池塘中常见的一种浮游动物优势,作为对虾养殖池塘食物链中的重要的中间类群,对于保持池塘生物种群动态平衡、改善养殖水质起着重要作用[11]。温度和盐度均是引起桡足类生理活动变化重要的因素,有研究表明,温度为25~30 ℃时,双齿许水蚤的摄食率和孵化率均处于最佳状态;双齿许水蚤最佳的摄食盐度为25~30,但盐度对孵化率没有显著影响[12-13]。亚热带地区虾池的温度和盐度均能满足双齿许水蚤生存的需求,且在温度为15~30 ℃,盐度为10~30条件下,双齿许水蚤对Cu和Zn均有较高的富集量。在对虾养殖期间,当养殖环境受到重金属污染时,幼虾摄食富集重金属的双齿许水蚤,这些金属就可以传递到对虾体内,并在体内积累,造成食品安全隐患。因此,被重金属污染的养殖水体,可通过循环过滤的方式去除双齿许水蚤等浮游动物,减少对虾对浮游动物的摄食和虾体中重金属的积累,从而降低食品安全隐患。这些研究成果对对虾的健康养殖具有重要的理论意义和应用价值。 参考文献: [1] 黄翔鹄, 魏少红, 周美华. 条纹小环藻对Cu2+, Zn2+耐受力和吸附作用的研究[J]. 台湾海峡, 2011, 30(1): 36-42 Huang X H, Wei S H, Zhou M H. Absorption and toleration of Cu2+and Zn2+byCyclotellastriata[J]. Journal of Oceanography in Taiwan Strait, 2011, 30(1): 36-42 (in Chinese) [2] 江东, 李长玲, 黄翔鹄. 波吉卵囊藻(Oocystisborgei)对Cu2+、Zn2+吸附研究[J]. 广东海洋大学学报, 2011, 31(6): 60-65 Jiang D, Li C L, Huang X H. Assimilation of Cu2+and Zn2+in a micro-alga (Oocystisborgei) [J]. Journal of Zhanjiang Ocean University, 2011, 31(6): 60-65 (in Chinese) [3] 张怡, 夏继刚, 曹振东, 等. 铜对中华倒刺鲃幼鱼的急性致毒效应[J]. 重庆师范大学学报, 2013, 30(4): 15-21 Zhang Y, Xia J G, Cao Z D, et al. Acute toxic effects of Cu2+on juvenile Qingbo,Spinibarbussinensis[J]. Journal of Chongqing Normal University (Natural Science Edition), 2013, 30(4): 15-21 (in Chinese) [4] 张瑞, 张帆, 刘付程, 等. 海州湾潮滩重金属污染的历史记录[J]. 环境科学, 2013, 34(3): 1044-1054 Zhang R, Zhang F, Liu F C, et al. History of heavy metal pollution from tidal flat in Haizhou Bay [J]. Environmental Science, 2013, 34(3): 1044-1054 (in Chinese) [5] 郭远明, 刘琴, 顾捷, 等. 4种海洋贝类对海水中铜(Cu)的富集能力[J]. 水产学报, 2012, 36(5): 708-713 Guo Y M, Liu Q, Gu J, et al. The research of copper enrichment in four types of shellfish [J]. Journal of Fisheries of China, 2012, 36(5): 708-713 (in Chinese) [6] 霍礼辉, 林志华, 尤仲杰, 等. 泥蚶不同组织器官对重金属( Cu, Pb, Cd)的富集规律[J]. 海洋环境科学, 2012, 31(3): 395-399 Huo L H, Lin Z H, You Z J, et al. Accumulation mechanism of heavy metals (Cu, Pb, Cd) in different tissues ofTegillarcagranosa[J]. Marine Environmental Science, 2012, 31(3): 395-399 (in Chinese) [7] 陈慧男, 胡大鹏, 陈琛, 等. 分子标志物在监测植物重金属污染中的应用[J]. 杭州师范大学学报: 自然科学版, 2013, 12(4): 319-322 Chen H N, Hu D P, Chen C, et al. The application of molecular markers in monitoring plants suffering heavy metal pollution [J]. Journal of Hangzhou Normal University (Natural Sciences Edition), 2013, 12(4): 319-322 (in Chinese) [8] Monteiro V, Cavalcante D G, Vilela M B, et al. In vivo and invitro exposures for the evaluation of the genotoxic effects of lead on the Neotropical freshwater fishProchiloduslineatus[J]. Aquatic Toxicology, 2011, 104(3-4): 291-298 [9] 唐建勋, 唐奕扬, 孙红祥, 等. 重金属Cu2+, Pb2+单因子及联合毒性对泥鳅卵细胞DNA的损伤效应[J]. 水生生物学报, 2013, 37(3): 501-506 Tang J X, Tang Y Y, Sun H X, et al. Effects of Cu2+and Pb2+(single factor and joint toxicity) on DNA damage inMisgurnusanguillicaudatusoocytes [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 501-506 (in Chinese) [10] 赵文. 水生生物学[M]. 北京: 中国农业出版社, 2005: 205-225 [11] Li C L, Luo X X, Huang X H, et al. Influences of temperature on development and survival, reproduction and growth of a calanoid copepod (Pseudodiaptomusdubia) [J]. The Scientific World Journal, 2009, 96(9): 866--879 [12] 罗晓霞, 黄翔鹄, 洪腾. 食物类型和浓度对双齿许水蚤摄食的影响[J]. 广东海洋大学学报, 2008, 28(3): 39-44 Luo X X, Huang X H, Hong T. Effect of type and density of feed on ingestion characteristics ofSchmackeriadubin[J]. Journal of Zhanjiang Ocean University, 2008, 28(3): 39-44 (in Chinese) [13] Li C L, Luo X X, Huang X H, et al. Effects of temperature, salinity, pH, and light on filtering and grazing rates of a calanoid copepod (Schmackeriadubia) [J]. The Scientific World Journal, 2008, 153(8): 1219-1227 [14] 郭远明. 海洋贝类对水体中重金属的富集能力研究[D]. 青岛: 中国海洋大学, 2008: 5 Guo Y M. The study about bioconcentration ability of seashell to heavy metal [D]. Qingdao: Ocean University of China, 2008: 5 (in Chinese) [15] Yu R Q, Wang W X. Trace metal assimilation and release budget inDaphniamagna[J]. Limnology and Oceanography, 2002, 47(2): 495-504 [16] Yu R Q, Wang W X. Kinetic uptake of bio-available cadmium, selenium, and zinc byDaphniamagna[J]. Environ Toxicol Chem, 2002, 21: 2348-2355 [17] Guan R, Wang W X. Dietary assimilation and elimination of Cd, Se, and Zn byDaphniamagnaat different metal concentrations [J]. Environmental Toxicology and Chemistry, 2004, 23(11): 2689-2698 [18] Heugens E H W, Jager T, Creyghton R, et al. Temperature-dependent effects of cadmium onDaphniamagna: Accumulation versus sensitivity [J]. Environmental Science & Technology, 2003, 37(10): 2145-2151 [19] Boudou A, Ribeyre F. Comparative study of the trophic transfer of two mercury compounds-HgCl2and CH3HgCl-betweenChlorellavulgarisandDaphniamagnainfluence of temperature [J]. Bulletin of Environmental Contamination and Toxicology, 1981, 27: 624-629 [20] Fowler S W, Heyraud M, La Rosa J. Factors affecting methyl and inorganic mercury dynamics in mussels and shrimp [J]. Marine Biology, 1978, 46(3): 267-276 [21] Tsui M T K, Wang W X. Temperature influences on the accumulation and elimination of mercury in a freshwater cladoceran,Daphniamagna[J]. Aquatic Toxicology, 2004, 70(3): 245-256 [22] Van Hattum B, Korthals G, Van Straalen N M, et al. Accumulation patterns of trace metals in freshwater isopods in sediment bioassays-influence of substrate characteristics, temperature and pH [J]. Water Research, 1993, 27(4): 669-684 [23] Denton G R W, Burdon-Jones C. Influence of temperature and salinity on the uptake, distribution and depuration of mercury, cadmium and lead by the black-lip oysterSaccostreaechinata[J]. Marine Biology, 1981, 64(3): 317-326 [24] Phillips D J H, Segar D A. Use of bio-indicators in monitoring conservative contaminate programme design imperatives [J]. Marine Pollution Bulletin, 1986, 17(1): 10-17 [25] Isaac K S L, Wang W X. Accumulation and elimination of aqueous and dietary silver inDaphniamagna[J]. Chemosphere, 2006, 64(7): 26-35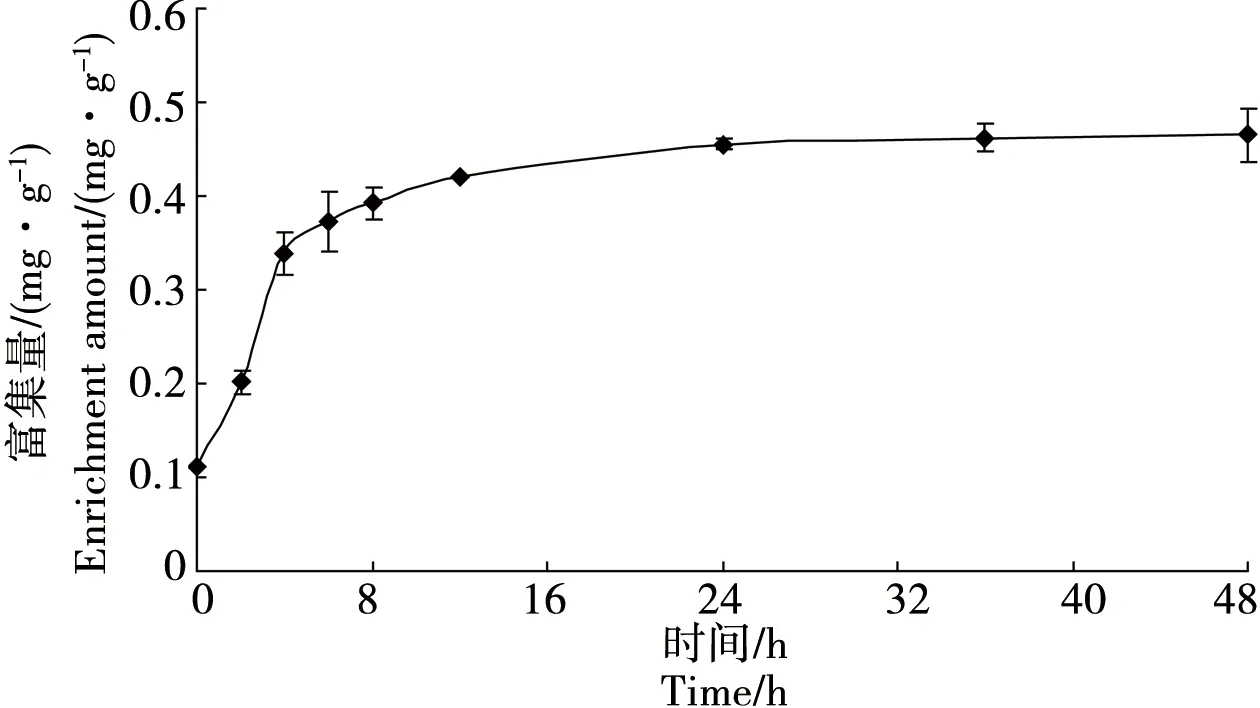
2.2 温度对双齿许水蚤富集Cu和Zn影响
2.3 盐度对双齿许水蚤富集Cu和Zn影响
3 讨论(Discussion)
3.1 双齿许水蚤对Cu和Zn的富集及其动力学
3.2 温度对双齿许水蚤富集重金属的影响
3.3 盐度对双齿许水蚤富集重金属的影响
3.4 双齿许水蚤在虾池水质调控中的应用
