甲状腺激素脱碘酶在孕哺期十溴联苯醚(BDE 209)暴露致子代小鼠神经发育毒性中的潜在作用
2014-03-22朱春艳刘晓晖
钱 波,王 健,朱春艳,胡 宏,邵 静, *,刘晓晖,#
1.大连医科大学公卫学院 劳动卫生与环境卫生教研室,大连 116044 2.大连医科大学附属二院 检验科,大连 116027
多溴联苯醚(polybromodiphenyl ethers,PBDEs)是一类高效溴系阻燃剂,在过去的30~40年中被广泛应用在多种工业产品和家庭消费品中。由于PBDEs具有一定的挥发性,并且与产品以非共价键结合,使得PBDEs易从产品中释放出来,导致生态和生活环境污染。在过去的20多年里,PBDEs不仅被发现存在于大气、水和土壤等多种环境介质中,而且许多生物组织也检测到PBDEs的存在[1]。人群调查显示,孕哺期妇女、婴幼儿及儿童等敏感人群体内PBDEs负荷有逐年升高趋势。在育龄妇女的脂肪、血液、胎盘,哺乳期妇女的乳汁,新生儿脐血及胚胎肝脏均已检测到PBDEs多种同系物的存在,并且新生儿脐血与母体血液PBDEs水平具有相关性[2],这说明PBDEs可通过胎盘屏障或以哺乳方式进入胎儿及婴幼儿体内,对胚胎发育和婴幼儿健康产生潜在损害。目前PBDEs对人类毒理效应还不十分清楚,但动物研究显示,PBDEs对甲状腺激素干扰和神经发育损伤尤为显著[3-4]。
甲状腺激素(TH,包括T3和T4)参与了脊椎动物几乎所有组织器官的发育和生理功能,尤其在神经系统发育过程中起着重要的作用[5]。PBDEs对TH的干扰作用已在多种种属动物研究中得到证实,主要表现在降低循环血液中T4浓度[6]。PBDEs神经发育毒性的主要表现为诱导运动行为以及改变认知能力和降低学习记忆能力[7]。因此,鉴于TH在大脑发育过程中的重要角色,刘早龄等推测PBDEs神经发育毒理效应可能(至少部分)与其导致的TH紊乱有关[6],但二者的联系机制尚不清楚。
生物体诸多基础生理过程的调节依赖于甲状腺激素的合理代谢。其中,甲状腺激素脱碘酶在甲状腺激素代谢转化及组织利用中具有重要作用。甲状腺激素脱碘酶包括I型、II型和III型脱碘酶。II型(DI-2)主要分布在脑、垂体、及棕色脂肪组织,近年来在甲状腺、胎盘和胎儿脑中也发现有该酶表达,尤其在新生儿脑中该酶活性达到高峰。局部组织细胞中的T3主要由DI-2催化T4外环脱碘生成,这对于依赖TH的大脑发育(特别是胎儿和婴幼儿)至关重要[8]。III型(DI-3)主要存在于脑、皮肤和眼睛等组织,特别是胎盘、胎脑和胎肝。DI-3催化T3和T4内环的脱碘,导致T3、T4的降解和灭活。在胎盘和胎儿组织,高DI-3活性可通过灭活T3调节胎儿循环T3水平,避免胎儿暴露于母体的高浓度T3之下,具有保护作用[9]。I型(DI-1)主要分布于肝脏、肾脏和甲状腺,目前其功能尚不十分明确[10]。由于DI-1同时具有内环和外环脱碘的活性[11],推测其主要作用包括:一是在外周组织中将T4催化生成T3,以维持循环T3浓度稳定;二是为机体清除T3灭活后生成的γT3,并作为产生循环T3主要来源。目前有关PBDEs对哺乳动物脱碘酶影响的报道较少,鉴于上述三种脱碘酶的组织分布特征,及在维护循环和局部组织TH稳态中的重要作用,可以推测PBDEs对脱碘酶的影响可能是其甲状腺激素紊乱和神经发育毒性的一种机制。
PBDEs具有209种同系物,其中十溴联苯醚(decabromodiphenyl ether, BDE 209)是目前使用量最大的一种。尽管BDE 209被认为毒性较小,但近年来的研究显示,其具有与其它同系物相似的甲状腺激素干扰效应和神经发育毒性[12-13]。本研究通过建立孕哺期BDE 209暴露模型,研究BDE 209对昆明小鼠母鼠胎盘、子鼠脑组织中甲状腺激素脱碘酶基因表达的变化,初步探讨甲状腺激素脱碘酶在PBDEs诱导神经发育毒理效应中的作用,为将来的机制研究提供依据。
1 材料和方法(Materials and methods)
1.1 主要仪器与试剂
仪器:Morris水迷宫检测系统(中国科学院研制),PCR仪(Takara Thermal Cycler Dice TP800,宝生物公司,大连)。
试剂:BDE 209(纯度>99% ChemService公司,美国),RNA提取及反转录试剂(宝生物公司,大连),其他试剂皆为国产分析纯。
1.2 实验动物
选用4周龄SPF级昆明雌性小鼠75只(大连医科大学实验动物中心提供),随机分为3组(对照组、低剂量暴露组、高剂量暴露组),每组25只。将BDE 209溶于精炼花生油中,根据小鼠体重,按不同暴露剂量(低剂量暴露组:1.5 mg·(kg·d)-1,高剂量暴露组:225 mg·(kg·d)-1每天避光灌胃一次。对照组灌胃等量花生油。BDE 209暴露10 d后,将雌鼠与同龄SPF级雄性昆明小鼠按2:1合笼,次日清晨检查脱落的阴栓,阴栓脱落则记为妊娠第0天。待确定雌鼠受孕后,将雄鼠取出。选取怀孕时间相近(相差不过2 d)的8只母鼠继续对其进行染毒,直至出生后子鼠断乳。所有动物均自由采食、饮水。室内温度为20~25 ℃,光线按亮/暗12 h循环。
1.3 样品采集
原代雌鼠每组取5只,在孕第17~18天处死,立即取其胎盘组织,放入液氮中冻存,后转入-80 ℃冰箱备用。子鼠每组取雌雄各5只,在染毒60 d后处死,立即取其脑组织,放入液氮中冻存,后转入-80 ℃冰箱备用。
1.4 检测指标及方法
1.4.1 实验动物一般动态观察
自子鼠出生第1天起,每天观察记录子鼠活动和精神状态,并在出生后第2、16、30和60天测量子鼠体重。
1.4.2 子鼠空间学习记忆能力检测(Morris水迷宫试验)
子鼠出生后第60天,按照性别,每组随机取5只子鼠,用Morris水迷宫检测系统(中国科学院研制)开始进行强迫游泳训练。实验前将小鼠置于站台上适应10 s,随后将小鼠随机从不同象限面壁置入池内,小鼠登上站台5 s后终止记录,最长记录时间为120 s,若小鼠在120 s内不能上台,引导其登上站台适应10 s,最后将小鼠擦干放入鼠笼。如此将小鼠置入游泳池,每天4次,每次间隔1 h。在定位航行训练第4天,通过水池上方架设的一台连接电脑的摄像机,记录和分析动物行为轨迹以及动物找到平台所需时间,即逃避潜伏期测量,以评判小鼠的空间记忆能力。
1.4.3 脱碘酶mRNA水平检测
采用实时荧光定量PCR(quantitative real-time reverse transcription-polymerase chain reaction, qRT-PCR)检测I型、II型、III型脱碘酶mRNA表达水平。(1)总RNA提取和质量控制:取-80 ℃冰箱冻存的孕第17~18天原代雌鼠胎盘和子鼠出生60 d脑组织,按照RNAiso Plus试剂盒(大连宝生物公司)方法分别提取总RNA,通过紫外吸收值A260/A280和琼脂糖凝胶电泳验证RNA无污染及降解。(2)本研究所用引物均由大连宝生物公司设计合成,引物序列号及序列如表1所示。(3)荧光定量PCR:将2 μg总RNA逆转录合成cDNA(PrimeScript®RT Master Mix试剂盒,大连宝生物公司),然后按照SYBR Premix Ex TaqTMⅡ试剂盒(大连宝生物公司)说明,使用大连宝生物公司PCR仪(Takara Thermal Cycler Dice TP800)进行实时荧光定量。反应条件为:预变性95 ℃ 30 s;PCR反应 95 ℃ 5 s,60℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。(4)结果分析:使用TP800 v4.01软件对结果进行分析,以GAPDH的表达量对结果进行标准化。
1.5 统计学分析
2 结果(Results)
2.1 子鼠生长动态观察
断乳后对子鼠一般状态进行动态观察。随着生长期的延长,BDE 209染毒组子鼠出现饮食及活动减少,精神萎靡,毛发紊乱,体重进行性下降直至消瘦等表现。由表2可见,第2、16天雌、雄子鼠体重未见明显变化(p>0.05);在出生后30 d,高剂量组雌性子鼠体重明显降低(p<0.05),而雄性子鼠低剂量和高剂量组体重均明显降低(p<0.05或p<0.01);出生后60 d各组子鼠体重未见明显差异(p>0.05)。
2.2 孕哺期十溴联苯醚暴露对60 d子鼠学习记忆能力的影响
Morris水迷宫训练结束后,在第4天对逃避潜伏期进行了考察。由图1可以看出,随着染毒剂量的升高,雌、雄子鼠的逃避潜伏期呈现延长趋势,剂量-效应趋势明显(p<0.05或p<0.01)。

表1 引物GAPDH, DI-1, DI-2, DI-3的基本参数Table 1 Parameters of GAPDH, DI-1, DI-2, DI-3 genes

表2 BDE 209对小鼠子鼠体重动态影响(g)Table 2 Effect of BDE 209 exposure on the body weight in the offspring mice
注:*与对照组比较,p<0.05;**与对照组比较,p<0.01。
Note: *compared with the control,p<0.05; **compared with the control,p<0.01.

图1 孕哺期BDE 209暴露对子鼠逃避潜伏期影响注:*与对照组比较,p<0.05;**与对照组比较,p<0.01。Fig. 1 Effect of BDE 209 on latency of offspringNote: *compared with the control, p<0.05; **compared with the control, p<0.01.
2.3 十溴联苯醚暴露对原代雌鼠胎盘脱碘酶表达的影响
BDE 209暴露对原代雌鼠胎盘脱碘酶表达影响结果如图2所示。低剂量暴露组与对照组比较,低剂量暴露组胎盘DI-1和DI-3的mRNA表达水平显著下降(约60%,p<0.05),而DI-2的mRNA表达水平无显著差异(p>0.05);高剂量暴露组胎盘DI-2和DI-3的mRNA表达水平显著下降(约70%,p<0.01),而DI-1与对照组相比无显著差异(p>0.05)。
2.4 十溴联苯醚暴露对60 d子鼠脑组织脱碘酶表达的影响
BDE 209暴露对雄性子鼠3种脱碘酶mRNA表达水平影响如图3所示。与对照组比较,低剂量暴露组子鼠脑组织DI-1的mRNA表达水平显著升高(约300%,p<0.01),DI-3的mRNA表达水平显著降低(约70%,p<0.01),而DI-2的mRNA表达水平无显著差异(p>0.05);高剂量暴露组子鼠脑组织DI-1的mRNA表达水平显著升高(约140%,p<0.05),而DI-2和DI-3的mRNA表达水平无显著差异(p>0.05)。

图2 孕哺期BDE 209暴露对母鼠胎盘脱碘酶基因表达影响注:*与对照组比较,p<0.05;**与对照组比较,p<0.01。Fig. 2 Effect of BDE 209 exposure on deiodinase gene expression in the placenta of miceNote: *compared with the control, p<0.05;**compared with the control, p<0.01.

图3 孕哺期BDE 209暴露对雄性子鼠大脑脑组织脱碘酶基因表达影响注:*与对照组比较,p<0.05;**与对照组比较,p<0.01。Fig. 3 Effect of BDE 209 exposure on deiodinase gene expression in the brain of male miceNote: *compared with the control, p<0.05; **compared with the control, p<0.01.
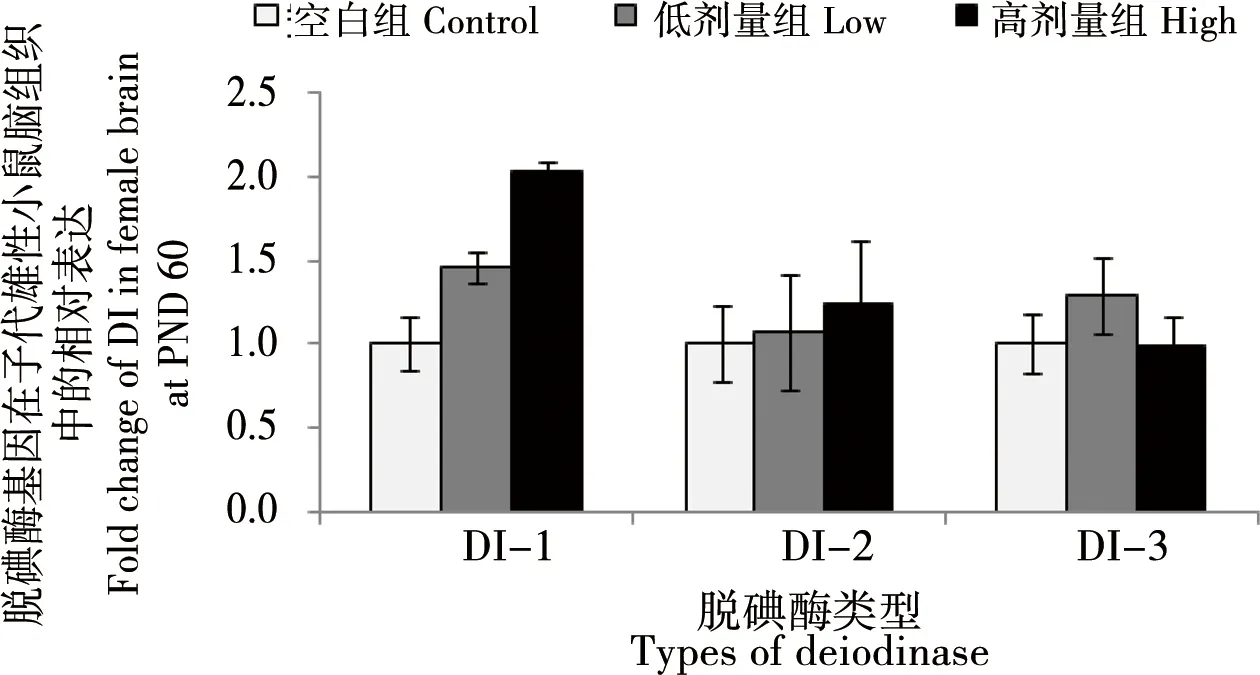
图4 孕哺期BDE 209暴露对雌性子鼠大脑脑组织脱碘酶基因表达影响注:*与对照组比较,p<0.05;**与对照组比较,p<0.01。Fig. 4 Effect of BDE 209 exposure on deiodinase gene expression in the brain of female miceNote: *compared with the control, p<0.05;**compared with the control, p<0.01
BDE 209暴露对雌性子鼠脑组织3种脱碘酶基因表达影响如图4所示。与对照组比较,低剂量和高剂量暴露组子鼠脑组织中3种脱碘酶的mRNA表达水平均无显著差异(p>0.05)。
3 讨论(Discussion)
大量动物研究表明,PBDEs具有神经发育毒性效应,主要表现在出生后子代运动行为异常,认知能力降低,学习和记忆能力下降等[14]。本研究通过建立孕哺期BDE 209暴露模型,评价出生60 d子鼠神经发育毒性效应。水迷宫试验结果显示,BDE 209暴露可导致雌、雄子鼠空间记忆能力降低,且具有剂量-效应关系,这与Eriksson和Rice等人在不同种属小鼠中的研究结果一致[15]。PBDEs神经发育毒性机制目前还不清楚,可能与神经细胞凋亡、神经干细胞分化和迁移,以及钙信号传导通路有关[3]。近年来许多研究显示,PBDEs对甲状腺激素具有干扰作用[16]。鉴于甲状腺激素在脑发育中的重要作用,有观点认为,PBDEs神经发育毒性可能与其甲状腺激素干扰作用有关,但其具体作用途径不清。
众所周知,甲状腺激素对早期胚胎发育(特别是大脑的发育)起着关键作用。在胚胎自身甲状腺形成、分泌和行使甲状腺激素功能之前(小鼠孕17 d),胎儿甲状腺激素主要来源于母体[17]。为避免胚胎暴露于母体高浓度甲状腺激素(特别是T3)之下,甲状腺激素脱碘酶DI-3在胎盘、胎脑以及胎肝等重要组织器官的表达和活性增高[18]。胎盘是连接母鼠与胎鼠的第一道屏障,DI-3在胎盘中的高表达和高活性可能体现了其在胚胎发育早期的保护作用[17]。动物研究显示,DI-3基因敲除对小鼠神经发育具有损伤作用,其表现程度远超过DI-1与DI-2双基因敲除导致的神经发育损害效应,表明DI-3的保护作用在早期神经发育过程中具有重要意义[19]。本研究中,低剂量和高剂量BDE 209孕期暴露均导致母鼠胎盘DI-3基因表达下调,并与其诱导的子鼠神经毒性效应(学习记忆能力下降)相似,呈现剂量-反应关系,提示胎盘DI-3可能在孕哺期BDE 209暴露诱导的子代神经发育毒理效应中具有重要作用。另外,本实验显示,低剂量和高剂量BDE 209暴露对胎盘DI-1和DI-2基因表达影响并不一致,低剂量暴露引起胎盘DI-1基因表达下调,对DI-2基因表达无显著影响,而高剂量暴露则恰恰相反,提示胎盘组织中DI-1和DI-2可能在将母体循环中的T4转化为T3功能上具有互补作用。
3种脱碘酶在成年小鼠的神经组织中也有表达,其功能在于维护局部脑组织细胞内T3的稳定,以保证神经细胞的正常活动[20],因此推测,脱碘酶在小鼠脑组织中的表达和活性异常可能导致神经功能障碍。本研究对孕哺期BDE 209暴露后出生60 d子鼠脑组织中3种脱碘酶基因表达进行了观察,结果显示,BDE 209低剂量和高剂量暴露均引起雄性子鼠脑组织中DI-1基因表达上调,而低剂量暴露导致雄鼠脑组织中DI-3基因表达下调,但不同暴露水平对DI-2基因表达没有显著影响。不同于T4,外周循环中的T3不能通过血脑屏障,神经细胞中的T3主要由DI-2转化形成。DI-2主要存在于神经胶质细胞中,将循环中的T4脱碘生成有活性的T3,并通过转运体(MCT8)运输到神经元中行使功能,而DI-3只分布于神经元,通过将T4降解生成γT3或灭活T3生成T2控制细胞内T3浓度[21]。DI-2和DI-3这种在不同神经细胞分布的独特性可能有着重要生理意义。胶质细胞是神经系统分布最多的细胞,也是构成神经垂体主要细胞,由于胶质细胞具有较强的抗氧化能力[22]。而氧化损伤是PBDEs的主要毒性机制之一,因此分布在胶质细胞中的DI-2比神经元中的DI-3不易受到PBDEs损伤,这与上述本实验观察结果相符。DI-2的这种分布特性及功能特点可稳定脑组织T3生成及垂体通过促甲状腺素(TSH)调节甲状腺功能,这可能也是在多数PBDEs诱导甲状腺素干扰的研究结果中并未发现血液中TSH改变的一个原因[6]。DI-1在神经系统分布较少,与在外周组织不同,DI-1在脑组织中可能并不参与T3生成(主要由D2完成),其作用主要可能是清除DI-3降解T4过程中生成的γT3[21]。γT3是T3竞争性抑制剂,它不仅可通过抑制T3与其受体结合阻碍T3的作用,而且能够通过阻碍T3进入细胞内导致细胞内T3水平降低,因此DI-1具有“清道夫”之称[23]。基于DI-1在脑中的这种功能特点,DI-1表达和活性的改变可能是DI-3活动的应答反应。
PBDEs对动物的神经毒性作用与大脑所处的发育阶段有关。研究显示,小鼠出生后10 d之前暴露PBDEs能诱发神经毒性效应,而之后暴露多不能产生影响[24]。另外,PBDEs对动物的神经毒性作用与其在大脑中的累积和代谢过程有关。例如,BDE 99在大鼠出生10 d时暴露可导致适应性降低等神经毒性效应,而BDE 209在相同时间点暴露则不能诱发症状,可能与BDE 209在脑中的累积速度较慢有关[24]。本研究结果显示,孕哺期BDE 209暴露对出生后60 d雌鼠脑组织中的3种脱碘酶的基因表达均没有显著影响,而对雄鼠脑组织DI-1和DI-3基因表达水平有显著影响,表明BDE 209在体内代谢过程或在神经系统中蓄积速度具有性别差异性。此外,本研究发现,尽管孕哺期BDE 209暴露对60 d子代雄鼠脑组织的DI-1和DI-3基因表达水平有显著影响,子代雄鼠呈现了与同龄子代雌鼠相似(或稍低)的神经毒性效应,提示孕哺期BDE 209暴露诱导神经发育毒性效应可能是永久性的,主要源于对胚胎早期神经发育的损伤,并可能是通过对胎盘脱碘酶(主要是DI-3)的影响造成的,而BDE 209在成鼠脑组织的蓄积对脑脱碘酶产生的影响可能是有限的、暂时的、或可逆转的,这可能与脱碘酶在成鼠神经细胞的分布和功能特点有关。
本研究对出生后子代小鼠的生长体重进行了动态观察(见表1),结果显示第2、16天雌、雄子鼠体重均无明显变化,表明孕哺期BDE 209暴露对子代生长发育没有明显影响。而出生第30天时所观察到的体重改变,且在第60天时得到恢复,显示孕期BDE 209暴露对子代体重生长的作用可能与BDE 209在体内代谢和蓄积过程有关,从而进一步证实BDE 209在体内代谢和蓄积过程可能有性别差异,这与上述BDE 209在成鼠脑组织的作用分析是一致的。
综合上述结果和分析,孕哺期BDE 209暴露对母体胎盘甲状腺激素脱碘酶(特别是DI-3)的影响可能是其神经发育毒性效应的机制之一。
参考文献:
[1] Anderson H A, Imm P, Knobeloch L, et al. Polybrominated diphenyl ethers (PBDE) in serum: findings from a US cohort of consumers of sport-caught fish [J]. Chemosphere, 2008, 73(2): 187-194
[2] Foster W G, Gregorovich S, Morrison K M, et al. Human maternal and umbilical cord blood concentrations of polybrominated diphenyl ethers [J]. Chemosphere, 2011, 84(10): 1301-1309
[3] Costa L G, Giordano G. Is decabromodiphenyl ether (BDE-209) a developmental neurotoxicant? [J]. Neurotoxicology, 2011, 32(1): 9-24
[4] Zhao X, Wang S, Li D, et al. Effects of perchlorate on BDE-47-induced alteration thyroid hormone and gene expression of in the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 1176-1185
[5] 张宝. 环境中毒物诱发甲减对胎儿神经系统发育的影响[J]. 中国科技信息, 2013, (11): 165
[6] 刘早龄, 张建清. 多溴联苯醚对甲状腺激素干扰毒性的研究进展[J]. 环境与职业医学, 2010, 27(2): 107-112
Liu Z L, Zhang J Q. Progress in toxicity of polybrominated diphenyl ethers on the thyroid hormone disruption [J]. Journal of Environmental & Occupational Medicine, 2010, 27(2): 107-112 (in Chinese)
[7] Costa L G, Giordano G. Developmental neurotoxicity of polybrominated diphenyl ether (PBDE) flame retardants [J]. Neurotoxicology, 2007, 28(6): 1047-1067
[8] 刘圆圆, 冀秀玲, 沈群辉, 等. 六溴环十二烷及其复合污染脑发育期暴露对大鼠甲状腺激素代谢过程的影响[J]. 生态环境学报, 2012, 21(9): 1614-1619
Liu Y Y, Ji X L, Shen Q H, et al. Disrupting Effects of Hexabromocyclododecane (HBCD) and its complex compounds on rat thyroid hormone metabolism after developmental exposure [J]. Ecology and Environment Sciences, 2012, 21(9): 1614-1619 (in Chinese)
[9] 冀秀玲, 刘洋, 刘芳, 等. 六溴环十二烷转甲状腺素蛋白结合活性及其发育期暴露的甲状腺激素干扰效应研究[J]. 环境科学, 2010, 31(9): 2191-2195
Ji X L, Liu Y, Liu F, et al. Transthyretin-binding activity of hexabromocyclododecanes (HBCDs) and its thyroid hormone disrupting effects after developmental exposure [J]. Environmental Scicence, 2010, 31(9): 2191-2195 (in Chinese)
[10] Galton V A, Schneider M J, Clark A S, et al. Life without thyroxine to 3,5,3'-triiodothyronine conversion: studies in mice devoid of the 5'-deiodinases [J]. Endocrinology, 2009, 150(6): 2957-2963
[11] 蔡振伟, 沈永年. 脱碘酶及影响其酶活性的因素[J]. 中国煤炭工业医学杂志, 2005, 8(3): 209-211
[12] Heredia L, Torrente M, Colomina M T, et al. Behavioral effects of oral subacute exposure to BDE-209 in young adult mice: A preliminary study [J]. Food and Chemical Toxicology, 2012, 50(3): 707-712
[13] Noyes P D, Hinton D E, Stapleton H M. Accumulation and debromination of decabromodiphenyl ether (BDE-209) in juvenile fathead minnows (Pimephalespromelas) induces thyroid disruption and liver alterations [J]. Toxicological Sciences, 2011, 122(2): 265-274.
[14] Viberg H, Johansson N, Fredriksson A, et al. Neonatal exposure to higher brominated diphenyl ethers, hepta-, octa-, or nonabromodiphenyl ether, impairs spontaneous behavior and learning and memory functions of adult mice [J]. Toxicological Sciences, 2006, 92(1): 211-218
[15] Rice D C, Thompson W D, Reeve E A, et al. Behavioral changes in aging but not young mice after neonatal exposure to the polybrominated flame retardant decaBDE [J]. Environmental Health Perspectives, 2009, 117(12): 1903
[16] Lee E, Kim T H, Choi J S, et al. Evaluation of liver and thyroid toxicity in Sprague-Dawley rats after exposure to polybrominated diphenyl ether BDE-209 [J]. The Journal of Toxicological Sciences, 2010, 35(4): 535-545
[17] 李茂全, 陈纯海, 王艳艳. 甲状腺激素与胚胎期脑发育[J]. 成都医学院学报, 2010, 5(3): 260-265
Li M Q, Chen C H, Wang Y Y. Thyroid hormones and embryonic brain development [J]. Journal of Chengdu Medical College, 2010, 5(3): 260-265 (in Chinese)
[18] 杨雪锋, 徐健, 郭怀兰, 等. 长期过量碘摄入对小鼠母-胎甲状腺激素代谢的影响[J]. 中华内分泌代谢杂志, 2006, 22(6): 532-534
Yang X F, Xu J, Guo H L, et al. Effects of long-term excessive iodine intake on the maternal-fetal thyroid hormone metabolism in mice [J]. Chinese Journal of Endocrinology and Metabolism, 2006, 22(6): 532-534 (in Chinese)
[19] Gereben B, Zavacki A M, Ribich S, et al. Cellular and molecular basis of deiodinase-regulated thyroid hormone signaling [J]. Endocrine Reviews, 2008, 29(7): 898-938
[20] Bernal J. Action of thyroid hormone in brain. Journal of endocrinological investigation, 2002, 25(3): 268-288
[21] Courtin F, Zrouri H, Lamirand A, et al. Thyroid hormone deiodinases in the central and peripheral nervous system [J]. Thyroid, 2005, 15(8): 931-942
[22] 谢玉丰. 神经胶质细胞与突触可塑性研究新进展[J]. 生理科学进展, 2007, 38(2): 111-115
Xie Y F. The updated advancements in synaptic plasticity mediated by glial cells [J]. Progress in Physiological Sciences, 2007, 38(2): 111-115 (in Chinese)
[23] Holtorf K. Understanding Local Control of Thyroid Hormones. National Academy Hypothyroidism [OL]. 2012. (http://nahypothyroidism.org/deiodinases/)
[24] 彦世帅, 徐海明, 秦展芬. 多溴二苯醚毒理学研究进展及展望[J]. 生态毒理学报, 2010, 5(5): 609-617
Yan S S, Xu H M, Qin Z F. Research progress and future perspectives in toxicology study on polybrominated diphenyl ethers [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 609-617 (in Chinese)
