荧光素酶表达基因法(CALUX)用于二噁英检测的研究进展
2014-03-22张诺孙韶华王明泉肖芙蓉许燕贾瑞宝
张诺,孙韶华,王明泉,肖芙蓉,许燕,贾瑞宝,*
1. 济南市供排水监测中心,济南 250021 2. 山东省图书馆,济南 250100
多氯代二苯并对二噁英(polychlorinated dibenzo-p-dioxins, PCDDs),多氯代二苯并呋喃(polychlorinated dibenzofurans, PCDFs),以及部分具有类二噁英性质的多氯联苯(dioxin-like polycholorinated diphenyls, DL-PCBs)是一类统称为二噁英的持久性有机污染物。全球历史上发生过几次重大的二噁英污染事件,比如1960年的日本米糠油事件,1998年的巴西黄油事件,1999年的比利时饲料、肉鸡事件,2011年的德国毒饲料事件等,这些事件造成了严重的人员伤亡及经济损失,并且影响了社会稳定[1-2]。现有研究表明,二噁英在目前已知化合物中毒性最大,广泛分布于各种介质中,主要来自于化工生产过程的副产物、有机物焚烧过程及汽车尾气排放等,2004年各类源二噁英类排放总量为10.2 kg TEQ,其中向空气中排放5.0 kg TEQ,向水体排放0.041 kg TEQ,通过产品排放0.17 kg TEQ,通过残渣、飞灰等向环境排放5.0 kg TEQ。二噁英具有难分解性和高生物蓄积性,对生物具有致癌、致畸、致突变等“三致”效应,影响生殖功能[3],并干扰内分泌系统,被称为“世纪之毒”,目前已被国际公约列入首批控制的12种/类持久性有机污染物的名单中,WHO国际癌症研究中心把它归为一级致癌物质[4]。因此,对二噁英的检测与控制至关重要,已成为当前的环境焦点之一。
环境中二噁英分析属超痕量、多组分分析,对分析技术的特异性、选择性和灵敏度的要求极高[5]。目前,二噁英的测定方法主要有美国环境保护局EPAl613和l668为代表的HRGC-HRMS[6]、基于抗原-抗体的ELISA法[7]以及基于总毒性当量(TEQ)的生物检测法[5]等。生物检测法所需时间短,操作简单,检测费用较低,同时能检测更多的样本。其中,荧光素酶表达基因法(CALUX)作为一种高效快速、简易价廉的生物分析方法,是唯一得到美国EPA推荐使用的二噁英生物学检测方法,并已被欧盟、美国、日本等国广泛用于二噁英的筛选检测中。
1 荧光素酶表达基因法原理及技术优势
CALUX方法首先利用基因工程技术,把哺乳动物细胞的细胞色素P450基因(CYPIAI)和萤火虫的荧光酶合成基因,重组到大鼠肝癌细胞系(H4IIE)染色体上。脂溶性二噁英类污染物,透过细胞膜与细胞内多环芳烃受体可逆性结合,形成配体-AhR复合物,使AhR的构象发生改变,进入细胞核内。在细胞核内配体-AhR复合体和核内转运蛋白(ARNT)结合,形成配体-AhR-ARNT复合物,特异性的与染色体上二噁英应答区域结合,并激活细胞色素P450基因和荧光合成酶基因合成荧光素。该测试系统合成的荧光素量及荧光强度与测定系统中加入的二噁英量成正相关[8-10]。
与其它二噁英的分析检测方法相比,CALUX法具有一系列优势,如表1所示。CALUX生物检测法使用高感度的细胞,加上前处理简单,拥有萃取、精制、分离等优良技术,因此成为环境、食品等领域二噁英的快速检测方法。此外,分析程序大幅度的缩短使成本大幅降低。但此类方法只能得到总的TEQ,不能了解样品中二噁英的具体组成。
2 荧光素酶表达基因法与同类方法用于二噁英检测的相关性
已有研究表明,CALUX法在牛乳样品二噁英检测实验中与标准方法(HRGC-HRMS)相比结果较一致,检测限高于活力诱导(EROD)法,线性范围更宽,检测限可达2.4 pm·L-1 [9,11,12]。
为了证明CALUX方法的准确性和实用性,有研究者分别采用国际上公认的HRGC-MS方法和CALUX法测定了同一批样品中的二噁英含量,并比较了两种分析方法测定结果之间的相关性。其结果表明,垃圾焚烧烟尘或土壤样品(r= 0.978)、地面水(r= 0.972)、工业废气(r= 0.960)、人类脂肪(r= 0.876)、母乳(r= 0.958)、卵泡液(r= 0.830)经两种方法测定,结果之间具有很好的正相关关系(p< 0.05),其测定值具有很好的重现性[13-15]。此外,李莹等[16]采用CALUX方法和HRGC-MS法测定同一样品二噁英含量的结果之间具有很好的正相关,且具有很好的重现性,与HRGC-MS方法相比,CALUX法具有所需样品量较小,测定周期短,测定成本低等优点。金一和等[17]也分别采用HRGC-MS法和CALUX方法测定同一来源的人体脂肪、血液和母乳中二噁英毒性当量,观察两种不同方法测定结果间的相关性。两种方法测定脂肪组织和母乳中二噁英毒性当量结果之间的相关系数分别为0.8675和0.9581,具有显著的正相关关系(p< 0.05)。二噁英毒性当量>20 pg·g-1的血液样品,两种方法测定结果之间也具有密切的相关关系(p<0.05或<0.01)。因此,CALUX法简化了实验操作,降低了成本,并且由于可利用基因工程技术改进报告质粒进一步提高灵敏度,适用于一般人群的脂肪组织、乳汁样品、二噁英暴露人群的血液以及环境水样中二噁英的快速筛查[11,18]。周志广等[19]应用CALUX法测定了废气中二噁英的浓度,并与HRGC-MS方法的测定值进行了比较,得出了二者的换算系数,换算以后的CALUX值与HRGC-MS方法值具有良好的相关性,相关系数为0.9948。
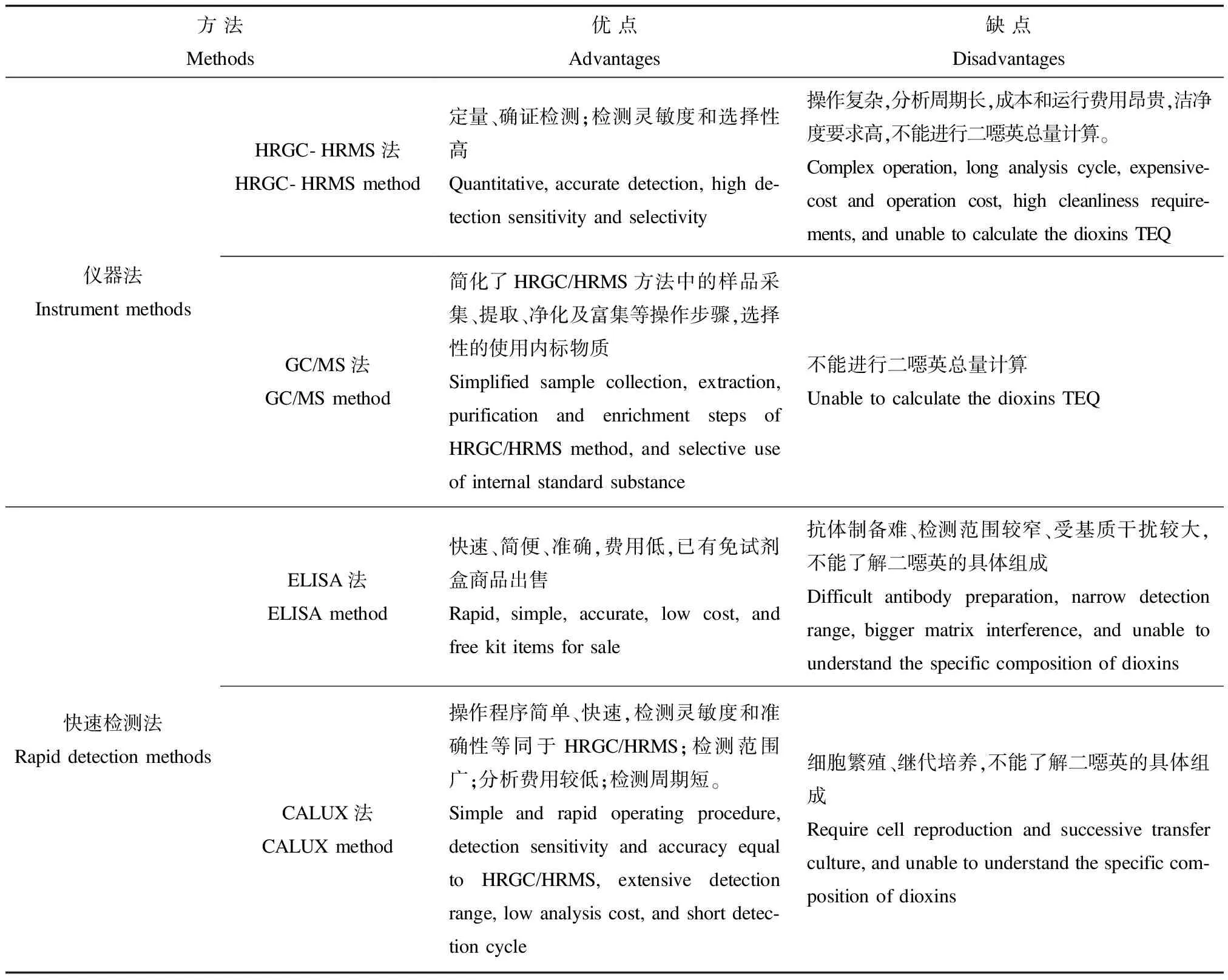
表1 荧光素酶表达基因法与其它方法的比较Table 1 The comparison results of CALUX with other methods
许多学者还对CALUX法和AhR-DNA结合的凝胶阻滞电泳生物检测法(GRAB法)进行了分析比较[20-22]。研究表明,CALUX法和GRAB法为我们提供了较便宜、较为迅速的二噁英检测方法。对于二噁英,CALUX系统快速(~4 h)、灵敏,并且由于可在96孔板中进行,从而加大检测通量。同时,CALUX诱导和二噁英浓度具有良好相关性[23]。
总之,CALUX法与其它检测方法具有一定的相关性,却又有无可比拟的优越性。与EROD法相比,CALUX法灵敏度较高、线性范围较宽、检测时间较短,为外源性基因不受转录后调控影响,可采用基因工程手段进一步改进质粒,进一步提高灵敏度;与HRGC-HRMS法相比,CALUX法在样品前处理时对分析所用的试剂纯度级别和实验室环境质量条件要求相对较低,前处理操作简便,样品需求量少(约1/10),测定周期短(可缩短4/5),检测成本低(可降低3/4)[24],可平行测定大量样品;与GRAB法相比,CALUX法得到的假阳性结果少得多,灵敏度更高,特异性更强,在初步监测成分不明的化合物以及其他样本的AhR配体活性时,CALUX法无疑是更好的选择[25]。
3 荧光素酶表达基因法在二噁英检测中的应用
用于二噁英检测的CALUX生物检测方法,目前可用于检测土壤、水、烟气、污泥、饲料、添加剂以及生物组织中的二噁英、呋喃和多氯联苯,该方法已得到美国(FDA和EPA)、欧盟、智利、日本等国的广泛采用,是大量筛查二噁英的新型快速检测技术,并成为部分国家的检测标准。国内已有研究者利用CALUX技术对部分水环境、沉积物、食品中所含的二噁英进行检测,但缺乏CALUX技术在中国不同水环境、食品、大气、土壤、消费品、生物样品中的大量应用,缺乏其中所含二噁英的系统调研,缺乏实质性安全评估工作的开展。并且,当前国内二噁英检测技术与发达国家相比尚存在较大差距,CALUX技术的建立及应用可以对现有化学检测方法进行补充,同时,通过系统调研筛查及风险评价建立二噁英的相应检测标准与规范,将在一定程度上促进二噁英检测方法及相应质量评价标准体系的建立和完善。
3.1 荧光素酶表达基因法用于水环境中二噁英检测
Wang等[26]采用CALUX技术,对海河沉积物中的多氯二苯并二噁英和呋喃(PCDD/Fs),多氯联苯(DL)和二噁英类多氯联苯物质(PCBs)进行了检测,结果发现海河沉积物中的PCDD/Fs比DL和PCBs高数百倍。高水平的二噁英在站点附近流入渤海湾发现的。二噁英污染可能与邻近地区五氯苯酚(PCP)工业相关的活动有关。王泰等[27]采用CALUX方法对海河天津流域底泥中的二噁英污染水平进行了调研,分析了海河底泥中二噁英的分布规律和污染特征,并且使用HRGC/MS方法进行了验证。CALUX TEQ结果表明海河入海口处的污染最为严重,且CALUX得到的TEQ值与HRGC/MS得到的TEQ值之间有很好的相关性。Murk[28]利用CALUX法检测了底泥、水体样品中的二噁英含量,获得了良好效果。CALUX作为一种简易价廉的生物分析方法,可以高效快速的应用于环境中沉积物样品的二噁英分析。TakigamiH等[29]利用CALUX技术对大阪湾沉积物样品中的二噁英类物质进行了分析检测,研究结果表明其中二噁英的含量在3.7~140pg·g-1。张婷婷等[30]采用CALUX法分析北京市污水厂污泥中的二噁英,结果表明CALUX法可以有效检出污泥中的二噁英含量,北京市区现运行的九大城市污水处理厂中二噁英的含量较低,未对环境造成较大危害。Kima等[31]研究了日本地表水和地下水中二噁英的类型及去除效果,在原水和净化水中二噁英的平均浓度分别为56.45 pg·L-1和4.24 pg·L-1。地下水和净化后的地下水二噁英含量水平均低于地表水。经过水处理后,二噁英的去除率为87%左右。
3.2 荧光素酶表达基因法用于食品中二噁英检测
目前,CALUX法已被广泛的用于牛奶、肉类、蛋类、鱼和鱼油、海产品等食品和动物饲料中二噁英类物质的检测[32-33]。Hasegawa等[34]研究了鱼油中PCDFs、DL-PCBs的含量,并同HRGC-HRMS法分析结果进行比较,这些分析验证得出的结论是 CALUX法和HRGC-HRMS法测出的TEQ值具有很好的相关性和一致性,有时 CALUX法还能得到更高的 TEQ值。Chou等[35]利用CALUX法对牛奶中PCDFs含量进行测定,并且与HRGC-HRMS进行了比较,相关系数为0.953。Shyu等[36]利用CALUX法研究了台湾鸡蛋和鱼油样品中二噁英的含量,含量水平在2.0 ± 0.7 pg·g-1、0.9 ± 0.6 ng·kg-1范围内,均低于欧盟标准。
3.3 荧光素酶表达基因法用于生物样品(母乳、血液)中二噁英检测
Croes等[37]利用CALUX法分析了来自弗兰德斯地区的84个母乳样品,结果表明,样品中PCDFs的含量为10.4 pg·g-1,DL-PCBs 的含量为1.73 pg·L-1。牛颖等[38]利用CALUX法对大连地区初产妇乳汁中二噁英含量进行了调研。调研结果表明,大连地区母乳中PCDDs/PCDFs和二噁英总毒性当量的中位数(P50)分别为14.7061和15.8473 pg·g-1。金一和等[17]用CALUX法调查了我国沈阳(32例)和大连(47例)地区母乳中二噁英污染水平,结果发现,大连地区母乳中二噁英污染物总毒性当量中位数为15.95 pg·g-1,而沈阳地区母乳中二噁英污染物总毒性当量中位数仅为7.21 pg·g-1。47例大连地区母乳样品中,17例检出多氯联苯(PCB)。我国大连地区母乳中二噁英浓度虽然低于日本、美国、加拿大和德国,但高于俄罗斯、南非和以色列等国的平均值[39]。Hui等[40]利用CALUX法测定了香港人口母乳中二噁英含量水平,检测的毒性为13 pg·g-1。Wouwea等[41]利用CALUX法和GC-HRMS法对人血液样品中的二噁英类物质进行了测定,研究表明,CALUX法在人血液样品中二噁英筛查方面具有良好的应用前景。
3.4 荧光素酶表达基因法用于土壤(固体废弃物)中二噁英检测
已有文献表明,CALUX作为一种快速廉价的生物分析方法,可以用于评价受PCBs、氯丹等氯代有机物污染土壤的光致二噁英类活性变化情况。由于其能分开检测PCDD/Fs和DL-PCBs,因此能够为揭示二噁英类物质之间的相互转化提供线索,减少进一步用HRGC/HRMS分析的工作量[42-43]。李雪等[44]利用CALUX法对海河流域底泥和土壤中二恶英类含量进行了测定研究,实验结果表明,海河流域土壤中二噁英的含量(0.55~9.66 pg·g-1)低于底泥中的存在情况(0~322.22 pg·g-1),DL-PCBs(0~6.13 pg·g-1)的含量低于PCDD/Fs的含量,二噁英含量最高可达324.15 pg·g-1。并且,不同环境介质严格正确的前处理过程能够有效的减少干扰因素对生物分析过程的负面影响,进而提高实验数据的准确性。
4 荧光素酶表达基因法用于二噁英检测的研究方向
随着二噁英检测需求的不断提高,CALUX法用于二噁英的检测仍需进行深入研究,主要包括样品前处理改进、方法推广应用及标准规范的制定等方面。
利用CALUX法进行二噁英类物质的检测,当前多采用液液萃取法处理样品,但是存在着处理时间长、有机试剂消耗多,易造成二次污染的劣势,可结合更简单、便捷的固相萃取技术从而实现液液萃取前处理的替代。
当前,CALUX法在国内的应用并不普遍,中科院环境所等少数单位采用HRGC/HRMS法进行二噁英的分析检测工作,所检测的二噁英物质的种类、数量和范围有限。因此,中国尚缺乏有关环境和食品中二噁英污染状况调查资料,且无法估算不同途径对二噁英总摄入量的贡献率。未来非常有必要加快CALUX法的推广步伐,利用该法进行广泛的二英污染状况调查,并开展相应的健康危害评价。
此外,与发达国家相比,我国尚未制定二噁英的国家检测标准。因此,亟需建立一套符合中国国情的低成本、快速简便的二噁英检测体系,以解决二噁英检测能力严重不足的问题,从而对我国二噁英的研究和污染防治工作起到积极作用。
综上所述,二噁英的物理性质决定了仅用一种方法不能达到准确检测的目的。CALUX技术作为一种新兴的生物检测技术,已被认为是用于快速筛选和检测食品、大气、各种生物样品、环境样品中二噁英类物质的最好方法,也是唯一可以大规模常规快速筛选二噁英类物质的方法,具有广阔的发展前景和较大优势。该法虽然不能检测二噁英的各组分含量,但它简便、快速、低廉、特异性高,并且能更准确的反映二噁英对机体的影响。由于二噁英对细胞芳香烃受体的联合作用不仅仅是单纯的相加作用,还存在协同和拮抗作用,因此,CALUX法不但可以测定环境样品中二噁英的总含量,还可以检测所有二噁英类物质对活体细胞产生的生物效应,同时还能用于分析和发现对人体健康有害的新的污染物[32]。实际应用中,可先用 CALUX法对污染样品进行筛选,作初步定性检测,再将筛选出的阳性样品用GC/MS法和HRGC/HRMS法作进一步精确的定性定量分析。因此,CALUX法是化学分析法的有效补充,可以更合理、完善的评估环境及食品样品中二噁英的影响,并大大的节约时间和分析费用。
参考文献:
[1] 陈学敏, 吴德生.环境卫生学[M]. 北京: 人民卫生出版社, 2001: 88-92
[2] Quass U, Fermann M, Bröker G. The European dioxin air emission inventory project-final results[J]. Chemosphere, 2004, 54: 1319-1327
[3] 黄莉, 黄韧, 冯媛瑜, 等. 2,3,7,8-四氯苯并二噁英(TCDD)短期染毒可造成着床前胚胎丢失并伴随雌性生殖器官中毒物相关蛋白的诱导表达[J]. 生态毒理学报, 2010, 5(3): 334-342
Huang L, Huang R, Feng Y Y, et al. Short time exposure of TCDD causing loss of implantation failure of embryos and its associated with induced expression of relevant proteins[J]. Asian Journal of Ecotoxicology, 2010, 5(3): 334-342 (in Chinese)
[4] 张莉娜. 广东某地垃圾焚烧厂周围大气中二噁英类污染物测定及环境行为研究[D]. 成都: 成都理工大学, 2012: 1-6
[5] 林海鹏, 于云江, 李琴, 等. 二噁英的毒性及其对人体健康影响的研究进展[J]. 环境科学与技术, 2009, 32(9): 93-97
Lin H P, Yu Y J, Li Q, et al. Research progress on the dioxin’s toxicity and its effect on human health[J]. Environmental Science & Technology, 2009, 32(9): 93-97 (in Chinese)
[6] 韩见龙, 铁晓威, 沈海涛, 等. 二恶英及其类似物检测技术进展[J]. 浙江预防医学, 2005, 17(11): 55-56
[7] 王承智, 胡筱敏, 石容, 等. 二恶英类物质的生物检测方法[J]. 中国安全科学学报, 2006, 16(5): 135-140
Wang C Z, Hu X M, Shi R, et al. Bioassay of Dioxin-like chemicals [J]. China Safety Science Journal, 2006, 16(5): 135-140 (in Chinese)
[8] Jmmjg S, Denison M S, DeHaan L H J, et a1. Ah receptormediatedluciferase expression: Atool formonitoringDioxin-like toxicity[J]. Organohalogen Compounds, 1993, (13): 361-364
[9] 张志仁, 徐顺清, 周宜开, 等. 虫荧光素酶报告基因用于二噁英类化学物质的检测[J].分析化学, 2001, 29(7): 825-827
Zhang Z R, Xu S Q, Zhou Y K, et al. Detection of dioxin-type chemicals by luciferase reporter gene[J]. Chinese Journal of Analytical Chemistry, 2001, 29(7): 825-827 (in Chinese)
[10] 赵毅, 张秉建, 贺鹏. 二恶英类化合物检测方法的研究现状及展望[J]. 电力环境保护, 2008, 24(6): 44-47
[11] 孙晞, 欧仕益, 彭喜春. 二恶英类化学物质生物检测方法研究进展[J]. 环境与职业医学, 2007, 24(2): 218-221
Sun X, Ou S Y, Peng X C. Development of biological detection methods of dioxin-like chemicais[J]. Journal of Environmental & Occupational Medicine, 2007, 24(2): 218-221 (in Chinese)
[12] Overmeire I V, Clark G C, Brown D J, et al. Trace contaminationwith dioxin-like chemicals: evaluation of bioassay-based TEQ determination for hazard assessment and regulatory responses[J]. Environmental Science & Policy, 2001, 4(6): 345-357
[13] Behnisch P A, Hosoe K, Shiozaki K, et al. Low-temperature thermal decomposition of dioxin-like compounds in fly Ash: Combination of chemical analysiswith in vitro bioassays(EROD and DR-CALUX)[J]. Environmental Science & Technology, 2002, 36: 5211-5217
[14] Pauwels A, Cenijin P H, Schepens P J, et al. Comparison of chemical-activated luciferase gene expression bioassay and gas chromatography for PCB determination inhuman serum and follicularfluid[J]. Environmental Health Perspectives, 2000, 108: 553-557
[15] Bovee T F, Hoogenboom L A, Hamers A R, et al. Validation anduse of the CALUX-bioassay for the determination of dioxins and PCBs in bovine milk [J]. Food Additives Contaminants, 1998, 15: 863-875
[16] 李莹, 金一和. 二噁英类污染物的CALUX测定法[J]. 环境与健康杂志,2004, 21(3): 168-169
Li Y, Jin Y H. An easy method for determination of Dioxins: the CALUX assay[J]. Journal of Environment and Health, 2004, 21(3): 168-169 (in Chinese)
[17] 金一和, 陈慧池, 唐慧君, 等. CALUX生物学检测二噁英方法在环境流行病学调查中的应用[J]. 环境与健康杂志. 2003, 20(3): 142-143
Jin Y H, Chen H C, Tang H J, et al. The application of the CALUX bioassay to determine dioxin in environmental epidemiological survey[J]. Journal of Environment and Health, 2003, 20(3): 142-143 (in Chinese)
[18] 曹巧玲, 张俊明, 卜承义. 二噁英的毒性与生物学检测研究进展[J]. 总装备部医学学报, 2007, 9(4): 233-235
[19] 周志广, 任玥, 许鹏军, 等. 荧光素酶报告基因法测定废气中二噁英类物质[J]. 环境科学研究, 2011, 24(12): 1416-1421
Zhou Z G, Ren Y, Xu P J, et al. Determination of dioxins in flue gas by chemical-activated luciferase gene expression[J]. Research of Environmental Sciences, 2011, 24(12): 1416-1421 (in Chinese)
[20] Denison M S, Seidel S D, et al. Ah receptor-based bioassays for Dioxins and related chemicals: applications and limitations[J]. Organohalogen Compounds, 1999, 40: 27-30
[21] Clark G C, Brown D J, et al.Characterization of the CALUX and GRAB bioassay for sensitivity and specificity in detection of pharmacological agents that activate the Ah receptor signaling system [J]. Organohalogen Compounds, 1999, 42: 309-312
[22] Seidel S D, Li V, Winter G M,et al. Ahreceptor-based chemical screening bioassays: Application and limitations for the detection of Ah receptor agonists[J]. Toxicological Sciences, 2000, 55: 107-115
[23] Garrison P M, Tullis K, Aarts J M, et al. Species-specific recombinant cell lines as bioassay systems for the detection of 2,3,7,8-tetrachlorodibenzo-p-dioxin-likechemicals[J]. Fundamental and Applied Toxicology, 1996, 30(2): 194-203
[24] Ziccardi M H, Gardner L A, Denison M S. Development and modification of a recombinant cell bioassay to directly detect halogenated and polycyclic aromatic hydrocarbons in serum [J]. Toxicological Sciences, 2000, 54: 183-193
[25] 程永友, 王迪, 王慧文, 等. 二恶英分子生物学检测方法[J]. 中国畜牧兽医, 2007, 34(6): 71-75
[26] Wang B, Yu G, Zhang T T, et al. CALUX bioassay of dioxin-like compounds in sediments from the Haihe River, China [J]. Soil and Sediment Contamination, 2009, 18(4), 397-411
[27] 王泰. 海河河口水环境中POPs 的污染特征及来源解析[D].北京: 清华大学, 2010: 82-89
[28] Murk A J, Legler J, Denison M S, et al.Chemical-activated luciferase gene expression(CALUX): Anovel in vitro bioassay for Ah receptor active compounds in sediments and pore water [J]. Fundamental and Applied Toxicology, 1996, 33: 149-160
[29] Takigami H, Sakai S, Brouwer A. Bio/chemical analysis of dionxin-like compounds in sediment samples from Osaka Bay, Japan[J]. Environmental Technology, 2005, 26: 459-469
[30] 张婷婷, 余刚, 王斌,等. CALUX生物法分析北京市污水厂污泥中的二噁英类化合物[C].持久性有机污染物论坛2008暨第三届持久性有机污染物全国学术研讨会论文集, 2008: 182-184
[31] Kima H, Masakia H, Matsumura T, et al. Removal efficiency and homologue patterns of dioxins in drinking water treatment[J]. Water Research, 2002, 36: 4861-4869
[32] 赵静, 王月华, 徐方旭, 等. CALUX法检测食品中的二噁英类化学污染物: 产生,发展与展望[J]. 食品与发酵工业, 2013, 39(11): 204-211
Zhao J, Wang Y H, Xu F X, et al. Determination of dioxin and dioxin-like contaminants in food using the CALUX bioassay: Development, status and prospect [J]. Food and FermentationIndustries, 2013, 39(11): 204-211 (in Chinese)
[33] Hoogenboom L, Goeyens L, Carbonnelle S, et al. The CALUX bioassay: Current status of its application to screening food and feed [J]. Trends in Analytical Chemistry, 2006, 25(4): 410-420
[34] Hasegawa J, Guruge K S, Seike N, et al. Determination of PCDD/Fs and dioxin-like PCBs in fish oils for feed ingredients by congener-specific chemical analysis and CALUX bioassay[J]. Chemosphere, 2007, 69: 1188-1194
[35] Chou I C, Lee W J, Wang L C, et al. Validation of the CALUX bioassay as a screening and semi-quantitative method for PCDD/F levels in cow's milk [J]. Journal of Hazardous Materials, 2008, 154: 1166-1172
[36] Shyu T S, Lee Y H, Lee M L, et al. Determination of PCDDS/DFS and dioxin-like PCBs in egg and fish feed samples in Taiwan by the DR CALUX®bioassay[J]. Organohalogen Compounds, 2009, 71: 434-438
[37] Croes, KColles A, Koppen G, et al. Determination of PCDD/Fs, PBDD/Fs and dioxin-like PCBs in Human milk from mothers residing in the rural areas in flanders, using the CALUX bioassay and GC-HRMS [J].Talanta, 2013, 113: 99-105
[38] 牛颖, 金一和, 唐丽云. 大连地区母乳中二噁英污染水平测定分析[J]. 中国煤炭工业医学杂志, 2007, 10(2): 207-208
[39] Arnold S.Dioxin and Health[M].New York: Plenum Press, 1994: 474
[40] Huia L L, Hedleya A J, Nelsonb E A S, et al. Agreement between breast milk dioxin levels by CALUX bioassay and chemical analysis in a population survey in HongKong [J]. Chemosphere, 2007, 69: 1287-1294
[41] Wouwea N V, Windal I, Vanderperren H, et al. Validation of the CALUX bioassay for PCDD/F analyses in human blood plasma and comparison with GC-HRMS[J]. Talanta, 2004, 63: 1157-1167
[42] 张望, 余刚, 卓琼芳,等. CALUX法测定PCBs污染土壤的光致二恶英类活性变化[C]. 持久性有机污染物论坛2009暨第四届持久性有机污染物全国学术研讨会论文集, 2009: 144-145
[43] 卓琼芳, 余刚, 张望, 等.CALUX法测定氯丹污染土壤的光致二恶英类活性变化[C]. 持久性有机污染物论坛2009暨第四届持久性有机污染物全国学术研讨会论文集, 2009: 146-147
[44] 李雪, 孙庆峰, 吕亚辉, 等. CALUX法测定海河流域底泥和土壤中二恶英类含量研究[C]. 持久性有机污染物论坛2007暨第二届持久性有机污染物全国学术研讨会论文集, 2007: 128-130
