γ-氨基丁酸的制备方法 与含量测定研究进展
2014-03-22,,,*
, ,,*
(1.昆明理工大学生命科学与技术学院,云南昆明 650500;2.昆明理工大学云南道地药材研究开发中心,云南昆明 650500)
γ-氨基丁酸(简称GABA),是一种四碳非蛋白氨基酸,广泛存在于动植物中。据文献记载,早在1949年就从土豆中发现了GABA,1950年又在动物大脑中发现GABA,而在1983年则首次用化学合成的方法制备了GABA[1-5]。在神经中枢中,1/3的神经突触部位都是以GABA为递质,与大脑皮质、垂体、下丘脑、生殖器官、肝脏和肾脏等存在着密切的关系,它于人体存在诸多益处,如对心肺血管有直接或间接作用,调节血压与心率;营养神经系统的发育,促进膜蛋白的合成;广泛应用于癫痫、帕金森、亨廷顿氏病等疾病的治疗;促进细胞新陈代谢,提高脑活力;抑制谷氨酸脱羧反应,降低血氨,保护肝脏;降低神经元活性,镇静神经,抑制焦虑等症;还具有保护肾脏、抗衰老、促进生长激素分泌、预防肥胖、促进酒精代谢等功效[1,6-11]。近年来,GABA的相关研究变得越来越热门,2009年卫生部批准其为新资源食品,它将会成为21世纪新资源食品的生产原料之一[12-13]。因此,GABA的制备纯化、检测方法与综合开发利用等相关研究已被人们普遍关注,大量的制备方法和检测技术应用于此类研究中,且仍在不断的改进中。其中一些新技术具有相当的发展潜力和推广价值,本文针对近年来GABA的制备方法和含量检测技术进行了综述。
1 制备方法
GABA的别名为氨酪酸或哌啶酸,化学名为4-氨基丁酸,其结构如图1所示,分子式为NH2CH2CH2CH2COOH,分子量为103.1。易溶于水,微溶于热乙醇溶液,不溶于乙醚等有机试剂。熔点为202℃,在高于熔点温度的情况下,分解为水和吡咯烷酮。目前,GABA的制备方法主要有化学合成法、微生物发酵法、植物富集法等。
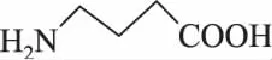
图1 γ-氨基丁酸(GABA)化学结构 Fig.1 The chemical structure of γ-aminobutyric acid(GABA)
1.1 化学合成法

表1 GABA化学合成制备方法Table 1 Chemical synthesis methods of GABA
化学合成法成本高产率低,在生产过程中涉及到危险有毒溶剂,而且存在化学成分残留,因此使用范围存在局限性,不能用于食品、药品等方面。目前,化学制备方法主要包含8种化学反应(见表1)。
1.2 微生物发酵法
微生物发酵法是利用生物发酵技术,通过筛选优良、高产、稳定的菌种,发酵生产GABA,该方法对生产设备要求高,且对环境要求比较严格,产品纯度不高,但是可以用作天然食品药品添加剂,对生物体伤害远比化学合成法低。它在食品等工业领域中应用广泛、历史悠久,最早利用大肠杆菌脱羧酶生产GABA,但是因其存在安全隐患,无法应用于食品、药品生产中[14]。随着绿色食品的不断开发,后被乳酸菌、酵母菌、曲霉菌等微生物所取代,催化谷氨酸脱羧,制备GABA,具有成本低、产量高、安全等优点,且已逐步走入产业化生产阶段,其中乳酸菌是一种食品安全级(GRAS)的微生物,因其具有安全、高效等诸多优点,被誉为重要的益生菌,具有很大的潜在价值。乳酸菌的来源丰富,可以从韩国泡菜、酒糟、乳酪发酵剂、发酵黄浆水中分离获得[14,20-21]。Noriko Komatsuzaki等人在2005年对Lb.paracasei NFRI 7415进行研究,最终能积累产生30g/L的GABA[22]。吴非等人改良以保加利亚乳杆菌L2为菌种生产GABA的方法,比之前产量分别提高了25.63%和30.77%[23]。许建军等人通过研究生物发酵生产,以乳酸菌和酵母菌混合物作为菌种,以L-谷氨酸钠为转化底物制备GABA,浓度高达300~500mg/100mL[24]。黄俊等人从未灭菌的生牛奶中筛选出高产GABA的乳酸菌Lactobacillus brevis CGMCC-1306,所得GABA的含量高达76.36g/L[14]。
1.3 植物富集法
植物富集法是用现有的提取技术,对含有GABA的植物进行分离纯化,成本低,产品纯度较高,相对于微生物发酵方法,它对生产环境要求较低,又比化学合成法安全。目前从植物中制备GABA常用的方法主要可以分为溶剂萃取法、柱分离制备法等。
1.3.1 溶剂萃取法 一种是选取水/醇为提取剂,利用GABA在植物和水/醇中溶解度或分配系数的不同能使GABA从植物内转移到水/醇中的原理,经过反复萃取,可将绝大部分的GABA提取出来。在提取过程中可分为静置提取和超声提取,通常超声提取的产率比静置提取产率高。其中固液比一般在1∶1~1∶30,提取温度为40~70℃,提取时间为静置2~5h或者超声20~90min,提取1~3次,过滤留滤液,分离纯化,经茚三酮溶液定性检测或经其他仪器定量检测,浓缩干燥即得[25-28]。沈强等人采用水提法,超声提取茶叶中GABA[25]。黄美娥等人以南瓜为原料,选取20%乙醇为溶剂,料液比为1∶17(w/v),提取1h,得到的产率为209mg/100g[28]。水/醇提取法为最常用的溶剂提取方法,所得GABA纯度较高,但操作过程较为繁琐。其中醇提法提取GABA含量低于水提法,提取成本高于水提法,不过因醇溶剂具有易挥发等优点,也被人们广泛使用。
另一种是选取盐溶液等溶剂提取GABA,如磺基水杨酸、柠檬酸缓冲盐、碳酸钠-碳酸氢钠等。钱爱萍等人选取5%磺基水杨酸,在适宜的条件下提取过滤,所得GABA含量高达98.48%,比盐酸水解法提高13.54%~13.77%,比醇提法提高7.42%~8.06%,且方法稳定简单[29]。而廖周华等人使用的柠檬酸缓冲盐为介质,从麦麸中提取GABA[30]。李炳坤等人从桑叶中提取GABA,则选用2.4mmol/L碳酸钠-2.4mmol/L碳酸氢钠作为介质[31]。此法处理简单、快速,且在使用离子色谱检测时,能消除水提法中水所带来影响实验精准度的负峰。但是使用碳酸钠-碳酸氢钠溶液时,温度不宜过高,因为碳酸氢钠受热易分解。
1.3.2 柱分离制备法 柱分离制备法也称为柱色谱法,根据样品混合物中各组分在固定相和流动相中分配系数不同,进行梯度洗脱,从而分离的一种层析法,一般选用树脂、硅胶、活性炭等柱填充材料进行分离。嵇豪等人用D101树脂柱对红曲发酵液进行分离洗脱,最终GABA的总得率为45.4%[32]。活性炭吸附法是一种特殊柱分离制备方法。活性炭是一种多孔性的含炭非极性分子物质,易于吸附非极性或极性很低的吸附质,具有高度发达的孔隙构造,增大了与物质充分接触的表面积,产生极强的吸附作用。在甘蔗梢中提取氨基酸时就采用活性炭吸附法,在50~90℃的情况下动态吸附,然后用0.5~2.0mol/L氨水和30%~90%乙醇动态洗脱[33]。该方法能让原材料体现物尽其用的含义,节约了操作时间,而且降低有害物质的产生,对操作环境也有所降低。
1.3.3 盐酸水解法 盐酸水解法[34-35]是检测氨基酸的常规方法即国标法,在GB/T5009.124-2003、GB/T 18246-2000等国标中均有涉及,具有广泛认可性。其基本原理是植物中的蛋白质经盐酸水解为游离的氨基酸,经离子交换柱分离,茚三酮溶液定性检测,再通过分光光度计比色确定其GABA含量,其最低检出限为10pmol,但是存在局限性,不适用于检测蛋白质含量低的植物。
1.3.4 膜分离技术 膜分离技术是利用选择性透过膜,借助于外界能量或化学位差的推动,由于膜两侧推动力不同,液体中物质选择性的透过,以达到进行分离纯化的目的。冯骉等人在早前建立了间歇稀释过滤和连续稀释过滤两种的数学模型,回收率高达95%[36]。分离GABA通常采用超滤与纳滤相结合的方法获得浓度和纯度都较高的GABA,但是该方法具有分离膜易受污染、膜种类少、易产生浓度极化现象等缺点[37]。
2 含量测定方法
GABA在常温下为小叶状或针状白色结晶,微臭,易潮解,在干燥条件下稳定性强。但是GABA无紫外吸收,在建立检测方法时,存在一定局限性,诸多方法均需经过衍生过程才能检测。目前,测定GABA含量的方法有比色法、电泳法、色谱法、氨基酸分析仪等。
2.1 比色法
此法利用紫外可见分光光度计法测定待测物含量,其原理是根据各物质对不同波长处的辐射吸收程度不同而测量。最通用的方法当属茚三酮反应,即在加热条件及弱酸环境下,加入适量2%茚三酮溶液,氨基酸可与2,2-二羟基-1,3-茚三酮反应生成有色化合物,是一种可定量的显色反应。所呈现的颜色一般为紫蓝色,但是随反应的条件不同而不同(酸度、温度、离子等)[38]。而陈恩成等人基于Berthelot显色反应,研究出使用紫外可见分光光度计快速测定GABA含量的比色法,以重蒸苯酚和次氯酸钠溶液作为显色剂显色反应,在645nm处测定其含量[39]。该方法操作简单、检测速度快、重现性好,适合于测定多种植物中GABA的含量,但对操作过程要求高,且不能存在氨及铵盐,避免干扰。
2.2 放射性免疫法
1959年,Yalow和Berson创建了放射性免疫法,它是一种超微量测定的体外放射分析技术。之后被用于GABA的含量检测中,综合了放射性元素的灵敏性和免疫反应的特异性,利用同位素标记的与未标记的抗原,与GABA偶联结合,经放射确定其含量[40]。此法具有灵敏度高、特异性强、操作简便,但是受药盒时间限制,存在局限性。
2.3 纸上电泳法
纸上电泳法是以纸为基板,在外加电场的作用下,待测物从一侧定向移动到另一侧,由于物质大小差异导致移动速度存在差异,从而达到分离的作用。汤茶琴等人利用此法对茶叶中GABA含量进行检测,能较好分离且斑点清晰,与氨基酸自动分析仪法的测试结果相比较,两者间无明显差异。它有高效、可回收、灵敏度高、低成本等优点,但是耗电、操作繁琐、需控制温度pH等多因素影响[41]。
2.4 酶联荧光法
此法又称ELISA法,用于GABA定量测定,根据抗原与抗体的特异反应,与酶连接的待测物与底物产生颜色反应。胡红焱与杨树德利用GABA酶偶联细菌荧光酶生物发光系统建立GABA的定量检测法,具有灵敏度高、特异性强的特点,线性范围大,精密度低[41-42]。
2.5 色谱法
2.5.1 纸层析法 纸层析法,是一种以纸为载体的色谱法,依据极性相似相溶的原理,以纸纤维上吸附的水分或其他缓冲盐等作为固定相,以不与水相溶的有机溶剂作为流动相。用一定比例的展开剂从点样的一段进行展开,由于待测样中各物质分配系数不同,扩散速度不同,从而达到分离的目的。Wang Q X等人对天然产物进行检测,最终确定展开剂最佳比例为正丁醇∶冰醋酸∶水=5∶3∶2,显色剂为0.4%茚三酮溶液,以GABA标准溶液作为对照品[43]。此法操作简便、成本较小,但是精准度不高,只能用于定性检测,不如高效液相色谱法应用普遍。
2.5.2 薄层色谱法 薄层色谱法是一种氨基酸定性快速检测的方法,能够辨别氨基酸种类,其原理与纸层析法相同,均是依据相似相容的原理。对于薄层色谱测定方法,杨四润等人建立了薄层色谱检测方法对茶叶中GABA含量进行检测,认为正丁醇∶冰醋酸∶水比例为4∶2∶1的展开剂分离效果较好,能达到最低检测限为0.03mg/mL[44]。此法易于操作、快速、低成本,但是无法准确计算待测物含量,故只能用于定性分析。
随着科技发展,在薄层色谱法的基础上结合薄层扫描仪建立了一种定量方法——薄层扫描法(简称TLCS),又名原位定量薄层色谱。黄美娥等人就采用反射双波长(λs=515nm;λr=680nm)线式扫描对南瓜中GABA含量进行定量分析[28]。该方法快速、简便、准确,精密度高,重复性好,在0.125~2.0mg/mL间线性关系良好,可用于GABA的痕量检测。
2.5.3 高效液相色谱法(HPLC) 高效液相色谱法是以不同极性(甲醇、乙腈、水、醋酸钠缓冲盐等)且按一定比例混合的溶液为流动相,高压输送流经装有固定相的色谱柱,进行梯度洗脱,各成分极性不同,因而洗脱时间不同,从而被分离开,在254~360nm紫外检测波长下进行检测分析。进样量为μL数量级,具有高速、高效、高灵敏度、准确性好等特点,应用广泛。因GABA无紫外吸收且酸性极强,需经过柱前衍生过程才能检测,所用的衍生化试剂主要有邻苯二甲醛(OPA)、异硫氰酸苯酯(PITC)、2,4-二硝基氟苯(FDNB)、6-氨基喹啉基-N-羟基琥珀酰亚氨基甲酸酯(AQC)。其中OPA衍生法步骤简单、反应快速、过量试剂不干扰结果,但是衍生物不稳定,不易放置太久;PITC衍生法所得衍生物稳定,但需在无水条件下进行,容易影响分析柱使用寿命;FDNB衍生法能得到较为稳定的衍生物,但是反应副产物会干扰检测结果;AQC衍生法制取稳定的衍生物且副产物不影响结果。Clark G等人选用OPA作为衍生化试剂,在338nm下检测含量[45]。孙莲等人则选用的衍生化试剂为PITC,在254nm下检测桑叶中GABA含量[46]。而且PITC衍生法早在1996年就已得到国内业界认可,被列入氨基酸分析方法通则[47]。
2.5.4 GC-MS法 GC-MS法又称气相-质谱联用检测法,当待测物进入气相,被气化吸附在固定相上,因为吸附能力不同,所以出峰时间不同,样品在进入质谱之后在离子源中电离,生成不同荷质比的带正电荷的离子,经加速电场的作用,形成离子束,进入质量分析器。此法分离效果好,灵敏度高,检测限宽,适合于挥发性物质痕量分析,但是检测仪器价格昂贵,操作较为复杂。因为GABA挥发性小,所以需要衍生化才能进行检测,衍生化试剂较常见的有硅烷化试剂、烷基氯甲酸酯类试剂等,衍生化反应时间短,但衍生过程复杂,不易操作。其中硅烷化试剂在GC-MS分析中应用最广,反应性强,衍生物挥发性好,但遇水或酸不稳定,易污染FID检测器,最常见的是MTBSTFA(N-(特丁基二甲基硅烷)-N-甲基三氟乙酰胺)、MSTFA(N-甲基-N-(三甲基硅烷)三氟乙酰胺)、BSTFA(双(三甲基硅烷)三氟乙酰胺)等;而烷基氯甲酸酯类试剂的衍生反应产率高,速度极快,但其过量试剂及副产物可干扰结果,必须除去。Paul L Wood和Damien Richard等人均选取了MTBSTFA作为衍生化试剂[48-49]。
2.6 氨基酸分析仪法
氨基酸自动分析仪测定氨基酸是国标采用的方法之一[34],得到业界广泛认可。其测定原理是因待测样品中含有的各种氨基酸的结构、酸碱性、极性及分子大小均有差异,利用阳离子交换柱将它们分离,经缓冲液梯度洗脱,茚三酮进行显色反应,测定其含量。任红波使用日立835-30型氨基酸分析仪,仅用20min就测定糙米中的GABA[50]。分析仪灵敏度高,最小检出限可达1pmol,重现性好且高效,被广泛普及到氨基酸的检测中,无需前期处理,可用于大批量检测。
2.7 毛细管电泳-电化学检测法
孔令瑶等人采用毛细管电泳-电化学检测(CE-ED)的方法对发芽黑米胚芽中GABA含量进行检测,选取邻苯二甲醛(OPA)为柱前衍生化试剂[51]。该方法检测时间短、灵敏度高、重现性好,但是操作过程复杂,就目前而言CE-ED法在检测GABA含量中使用较少。
综上所述,虽然已有很多制备与检测方法,但对于药食同源的GABA来说,又要区分开药品与食品的定义,在食品中添加GABA,不能像药品一样进行简单添加,更多地考虑其安全、环保等因素,从源头开始控制,从天然物质中获取,生产出食品级GABA,目前,其制备方法渐渐由化学合成法转向从自然界中获取,其中微生物发酵法较为成熟,得率较高,已经形成产业化[14]。就中国而言,植物资源非常丰富,而已开发的资源较为局限,现今植物原料中GABA含量低,提取成本较高且纯化难度高,多数原料不适宜产业化发展,可见植物富集法具有很大的潜在发展前景。日本和台湾均已将GABA列为食品级,而我国也于2009年将GABA列为新资源食品,这对GABA的检测方法抛出了又一崭新的问题。产品的标准化、市场的规范化都需要快速、准确、简便的检测方法作为支撑。现今这些检测手段仍需优化,大量检测方法操作过程复杂且耗时长,检测仪器昂贵无法普及。
3 展望
随着人们步入属于生命科学时代的21世纪,越来越多的人开始关注自己的健康,越来越多的目光开始投向天然绿色食品这一方向。因GABA具有降低血压、解除抑郁、增强脑功能、强肝健肾等诸多药理活性[1,6-11],关于GABA的保健功能、来源与提取等方面的研究引起国内外高度重视,对GABA的开发利用成为新的研究热点。在日本,特别是在成功开发出富含GABA的发芽糙米后,富含GABA的相关产品就被大力开发,并且深受广大消费者青睐,现已形成产业化生产,而且如今的GABA已经广泛地应用于饮品、食品、调味料、保健品、药品等制品中,开发出适用于不同人群的食品,具有广阔的市场前景。
面临GABA的食品化,上述这些问题已经引起了业界的广泛关注,随着科学技术的进步,分离提取和检测方法不断丰富,但其制备工艺有待于进一步向提取出安全食品级GABA方面完善,从更广阔的大自然中摄取天然的GABA。拓展GABA的来源渠道,寻找高含量的物种,降低提取成本已成为有待解决的关键问题。随着绿色时代的到来,大量的提取检测方法将会继续优化,但GABA的检测工作仍是科研工作者要攻克的技术问题。寻求快速准确检测GABA含量的方法会推动我国这一新资源的快速发展,同时也可以避免造假、低质的产品流入市场,使市场规范化。高纯度的GABA提取工艺技术还不够成熟,且成本较高,不适合产业发展,食品级GABA提取技术在国内仍有待完善。
[1]叶惟泠.γ-氨基丁酸的发现史[J].生理科学进展,1986,17(2):187-189.
[2]Stewated F C,Thompson J F.γ-butyric acid a constituent of potato tubers[J].Science,1949,l10:439-440.
[3]Erdo S L,Rosdy B,Szporny L.Higher GABA concentrations in fallopain tube than in brain of rat[J].J Neurochem,1982,38:1174-1176.
[4]S A Segal,T Jacob,R A Gillis.Blockade of central nervous system GABAergic tone causes sympathetic mediated increases in coronary vasculas resistance in cats[J].Circulation Res,1984,55:404-415.
[5]Kalia V,Hole D R,Willson C A.Effect of gonadal steroids and gamma-aminobntyric acid on LH Release and dopmine expression and activity in the zona incerta in rat[J].Reproduction and Fertility,1999,117:189-197.
[6]Billingsley ML,Suria A.Effect of peripherally adiministered GABA and other amino acids on cardiopulmonary responses in anesthetize rats and dogs[J].Arch Int Pharmacodyn,1982,2:55-131.
[7]林亲录,王婧,陈海军.γ-氨基丁酸的研究进展[J].现代食品科技,2008,24(5):496-500.
[8]Leventhal AG,Wang Y,Pu M,etal.GABA and its agonists improved visual cortical function in senescent monkeys[J]. Science,2003,300:812-815.
[9]孙百申.红曲霉发酵及某些生理活性物质的研究[D].杭州:浙江工业大学,2004.
[10]Sarter M,Bruno JP.Cognitive functions of cortical Ach:lessins from studies on transsynaptic modulation of activated efflux[J].TINS,1994,17(6):217.
[11]Ki-Bum Park,Suk-Heung Oh.Production of yogurt with enhanced levels of gamma-aminobutyric acid and valuable nutrients using lactic acid bacteria and germinated soybean extract[J].Bioresource Technology,2007,98:1675-1679.
[12]Park K B,H S H.Production and characterization of GABA rice yogurt[J].J Food Sci Biotechnol,2005,14:518-522.
[13]王姣姣,白卫东,梁彬霞.γ-氨基丁酸的生理功能及富集的研究进展[J].农产品加工·学刊,2012(1):40-45.
[14]黄俊.利用短乳杆菌制备γ-氨基丁酸相关过程研究[D].杭州:浙江大学,2006.
[15]王金玲,袁军,刘登才.γ-氨基丁酸的合成[J].化学与生物工程,2010(3):40-42.
[16]杨东元,陈开勋,王亚红.γ-氨基丁酸的合成研究[J].中国饲料,2010(1):27-28,41.
[17]郭勇.一种新的制备单一构型的2-氨基丁酸或其衍生物的方法[P].中国,1510025,2004-07-07.
[18]尹先清,孙芳,葛胜祥.α-氨基丁酸化学合成研究进展[J].精细化工中间体,2010,40(1):12-14.
[19]何伟彪,张逸伟,陈海权.L-4-溴-2-氨基丁酸的“两锅法”合成[J].化学试剂,2008,30(2):117-119.
[20]堀江典子,菅美奈子,金武祚.GABA(γ-氨基丁酸)的功能性[J].中国食品添加剂,2010(6):161-173.
[21]渠言,王夫杰,李平兰,等.γ-氨基丁酸及其在大豆发酵食品中的研究进展[J].中国酿造,2010(3):l-4.
[22]Komatsuzaki N,Shima J,Kawamoto S,etal.Production of γ-amionbutyric acid by Lactobacillus paracasei isolated from traditional fermented foods[J].Food Microbiology,2005,22:497-504.
[23]吴非,边鑫,李良,等.高产γ-氨基丁酸乳酸菌菌株的筛选及诱变育种研究[J].东北农业大学学报,2012,43(5):6-10.
[24]许建军,江波,许时婴.Lactococcuslactis谷氨酸脱羧酶的分离纯化及部分酶学性质[J].无锡轻工大学学报,2004,(3):79-84.
[25]沈强,张建,罗显扬,等.氮气厌氧处理对茶叶γ-氨基丁酸及主要化学成分含量的影响[J].贵州农业科学,2012,40(4):45-47.
[26]李楠,彭倩,宋振玉,等.富含γ-氨基丁酸(GABA)玉米胚芽的应用及其GABA提取的研究[J].食品研究与开发,2008,29(4):63-67.
[27]曹磊,李珂昕,汪晓鸣,等.发芽糙米中γ-氨基丁酸提取条件对快速检测法测定结果的影响[J].江苏农业科学,2012,40(4):294-295.
[28]黄美娥,彭胜,陈阳波,等.南瓜叶中γ-氨基丁酸的提取及薄层扫描测定[J].天然产物研究与开发,2012,24:1284-1287.
[29]钱爱萍,颜孙安,林香信,等.提取植物产品中γ-氨基丁酸的方法研究[J].中国卫生检验杂志,2010,20(7):1639-1641.
[30]廖周华,陈铭志,李彩娟,等.麦麸提取γ-氨基丁酸工艺的优选[J].亚热带农业研究,2010,6(4):267-270.
[31]李炳坤,衷明华.离子色谱法测定桑叶中γ-氨基丁酸[J].韩山师范学院学报,2009,30(6):62-65.
[32]嵇豪,蒋冬花,周琴,等.D001阳离子交换树脂分离红曲霉发酵液中γ-氨基丁酸的研究[J].中国粮油学报,2011,26(8):95-99.
[33]广西大学.从甘蔗梢中提取氨基酸的方法[P].中国,CN102260181A,2011-11-30.
[34]GB/T5009.124-2003,食品中氨基酸的测定方法[S].
[35]GB/T 18246-2000,饲料中氨基酸的测定[S].
[36]冯骉,王文.膜分离提纯发酵液中GABA的过程模型和优化[J].食品工业科技,2006,27(10):53-57.
[37]陈瑜,范志勇,闫景彩.膜分离技术在γ-氨基丁酸分离提取中的应用[J].牧草与饲料,2009,3(2):7-9,12.
[38]GB/T 8314-2002,茶游离氨基酸总量测定[S].
[39]陈恩成,张名位,彭超英,等.比色法快速测定糙米中γ-氨基丁酸含量研究[J].中国粮油学报,2006,21(6):125-128.
[40]周成贵,孙玮,黎海蒂,等.γ-氨基丁酸测定方法的改进[J].色谱,1991,4:274-275.
[41]汤茶琴,张定,陈暄,等.茶叶中γ-氨基丁酸及谷氨酸的纸电泳测定[J].江苏农业学报,2007,23(2):135-138.
[42]胡红焱,杨树德.细菌荧光酶生物发光分析法测定血清γ-氨基丁酸[J].临床检验杂志,1998,16(2):67-70.
[43]Wang Q X,Jia M Y,Tang R P.The chemical constltuents review of decreasing blood glucose in natural products[J].Chin J Ethnom ed Ethno pharmacy,2005,75:190-193.
[44]杨四润,张冬莲,方乔慧,等.γ-氨基丁酸茶薄层检测方法的建立[J].食品安全质量检测学报,2012,3(1):33-39.
[45]Clark G,Mahony S O,Malone G,etal.An isocratic high performance liquid chromatography method for the determination of GABA and glutamate in discrete regions[J].Journal of Neuroscience Methods,2007,106(12):190-193.
[46]孙莲,张煊,孟磊,等.柱前衍生RP-HPLC法测定桑叶中16种游离氨基酸的含量[J].中国药房,2008,36(19):2830-2832.
[47]JY/T 019-1996,氨基酸分析方法通则[S].
[48]Paul L Wood,M Amin Khan,Joseph R Moskal.Neurochemical analysis of amino acids,polyamines and carboxylic acids:GC-MS quantitation of tBDMS derivatives using ammonia positive chemical ionization[J].Journal of Chromatography B,2006,831:313-319.
[49]Damien Richard,Bing Ling,Nicolas Authier,etal.GC/MS Profiling of γ-Hydroxybutyrate and Precursors in Various Animal Tissues Using Automatic Solid-Phase Extraction. Preliminary Investigations of Its Potential Interest in Postmortem Interval Determination[J].Analytical Chemistry,2005,77:1354-1360.
[50]任红波.氨基酸分析仪快速测定糙米中的γ-氨基丁酸[J].杂粮作物,2003,23(4):246-247.
[51]孔令瑶,汪云,曹玉华.毛细管电泳-电化学法对发芽黑米胚芽中γ-氨基丁酸含量的检测[J].分析测试学报,2008,27(5):527-530.
