副干酪乳杆菌对发酵香肠风味的作用研究
2014-03-22莉力
,莉力,
(辽宁医学院食品科学与工程学院,辽宁锦州 121000)
我国传统发酵香肠因其独特的风味倍受消费者青睐[1],但传统发酵(自然发酵)主要靠原料肉自身微生物菌群中的乳酸菌与杂菌的竞争作用[2]。所以,发酵周期长,产品质量难以控制。近年来,在发酵过程中人工添加发酵剂可获得较好的产品风味和质量。乳酸菌在发酵香肠风味形成的过程中占据主导地位[3]。Frederic等[4]人研究认为,乳酸杆菌可分解蛋白质和脂肪产生风味前体物质,再经过氧化、分解等一系列反应生成具有可溶性及挥发性的风味物质,从而赋予发酵香肠独特的味道。而副干酪乳杆菌作为发酵菌种的益生菌同时具有益生菌和发酵菌种的双重功效,并且其“定植”作用可以粘附在物质表面有效的发挥作用[5]。电子鼻是对挥发性化合物的测量有广泛部分重叠选择性的化学气体传感器阵列,它与传统方法相比,具有技术客观、评价快速、准确等特点,并且样品无需做前处理[6]。
因此本实验用副干酪乳酸杆菌作为发酵剂发酵香肠,利用电子鼻采集样品1#和2#的香气,对发酵香肠风味进行测定,并运用主成分分析法(the Principal Component Analysis,PCA)进行数据分析,再经GC-MS、氨基酸分析仪分析风味成分,为改善发酵香肠风味进一步扩大市场提供依据。
1 材料与方法
1.1 材料与仪器
副干酪乳杆菌 由辽宁医学院微生物实验室提供;发酵香肠 自制;改良TJA培养基。瘦猪肉与肥膘比例7∶3,蔗糖800g,食盐1000g,葱150g,姜150g,白胡椒粉 80g,异VC40g,亚硝酸钠10g,番茄汁50mL,酵母浸出物10g,牛肉膏5g,乳糖20g,K2HPO42g,TWeen-80 1g,醋酸钠5g。
电子鼻FOX4000 法国AlphaMos公司;装填日立离子交换树脂型号:NO.2622(日本公司生产的氨基酸分析专用树脂)6890N-5973N GC-MS Agilent 公司;日立L-8900型氨基酸分析仪 日本日立公司;WDP-9062电热恒温培养箱 上海安亭科学仪器有限公司;YXQ-LS-50G立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司。
1.2 样品处理
改良TJA培养基121℃灭菌20min,将副干酪乳杆菌接种于5mL改良TJA培养基中放入30℃恒温培养箱活化24h,然后接种于50mL改良TJA培养基中扩大培养。接种量1.5%副干酪乳杆菌接种于绞碎的原料肉中,斩拌均匀,灌肠,在温度42℃、相对湿度95%的条件下发酵24h后作为样品(1#)。样品(2#)不添加菌种,其他过程同上。
分别取5g样品1#、2#于水解管中,加入6mol/L盐酸充氮后封管。水解22h后过滤到50mL容量瓶中,用超纯水反复冲洗滤纸和水解管,再用0.02mol/L盐酸定容,备用上机[7]。
1.3 实验条件
1.3.1 电子鼻条件 顶空产生参数:产生时间:900s,产生温度:60℃,搅动速度500r/min;顶空注射参数:注射体积1000μL,注射速度500μL/s,注射针总体积2.5mL,注射针温度65℃;获取参数:获取时间120s,延滞时间600s。每个样品均在上述条件下重复分析3次。
1.3.2 顶空-固相微萃取 取5.0g切碎样品置于样品瓶中,在60℃水浴10min,将萃取头通过聚四氟乙烯隔垫插入样品瓶中,顶空吸附30min后,缩回纤维头插入GC-MS进样口脱附5min,同时启动仪器采集数据[8]。
1.3.3 色谱条件 色谱柱(GC-MS):J/W DB—5 石英毛细柱(60m×0.25mm×0.25μm);进样口温度270℃;升温程序:起始温度57℃,保持3min,以4℃/min升温至260℃,保持10min;载气(N2)流速1mL/min;分流比5∶1;进样量1μL。
质谱条件:电子能量70eV;离子源温度230℃;质量扫描范围29~500amu;传输线温度200℃;自动进样。
1.3.4 色谱柱(氨基酸) 4.6mm×60mm;色谱柱温度45℃;洗脱液流速0.280mL/min;输送压力95kgf/cm2;样品分析周期30min;进样量50μL。
2 结果与分析
2.1 雷达图比较
当气-液两相平衡后,样品中的挥发性化合物通过干燥空气传入传感器中与18根金属氧化物传感器相互作用从而改变活性材料的导电性,通过测量电阻的变化得出雷达图。
如图1所示,内框线为未添加发酵剂的香肠,外框线为添加发酵剂的香肠。两样品在P30/1和PA/2传感器响应值(P30/1对有机化合物灵敏,参考物质为羰基化合物。PA/2对有机化合物,挥发性气体灵敏,参考物质为醇、酯)有不同,说明副干酪乳杆菌利用肉中的脂类等物质产生了酯类、醇类等挥发性化合物。与Eric Hüfner[9]研究结果基本一致,乳酸菌胞内酯酶可通过脂肪水解、脂肪氧化等一系列化学反应来改善肉制品风味。
2.2 主成分分析(PCA)
通过图2可知,两样品分布在图中不同位置,说明添加及未添加发酵剂的发酵香肠在香气上存在着差别,电子鼻可以很好的将两者区分。第一主成分贡献率为92.726%,第二主成分贡献率为1.042%,总贡献率为93.768%。表明,依据前两个主成分可以对不同样品的差异进行判别。

图1 添加发酵剂和未添加发酵剂发酵香肠的雷达图比较 Fig.1 Radar chart comparison of adding starter culture and not adding starter culture fermented sausage
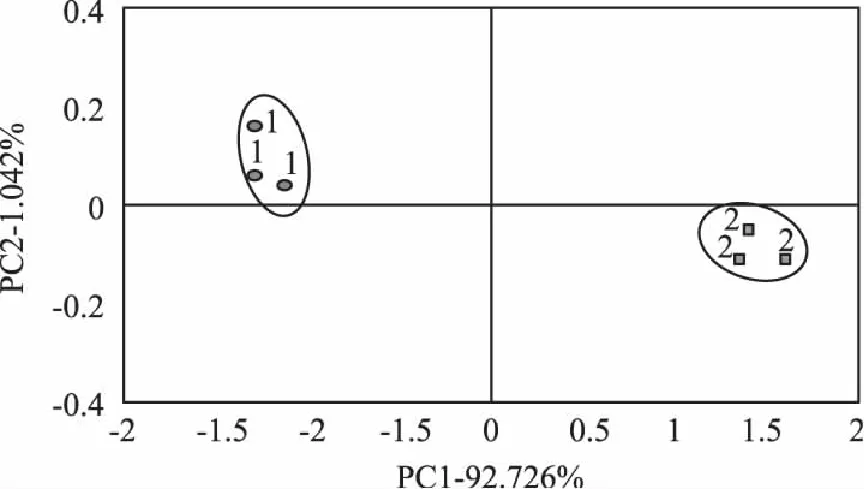
图2 添加和未添加发酵剂的香肠的PCA分析结果图 Fig.2 PCA analysis results of adding starter culture and not adding starter culture fermented sausage
2.3 氨基酸分析仪测定两样品中氨基酸的变化
使用氨基酸测定仪,根据峰面积及出峰时间,经计算机程序处理得到的结果,见表2。

表2 两样品中氨基酸的含量(g/100g)Table 2 The content of amino acid in the two samples(g/100g)
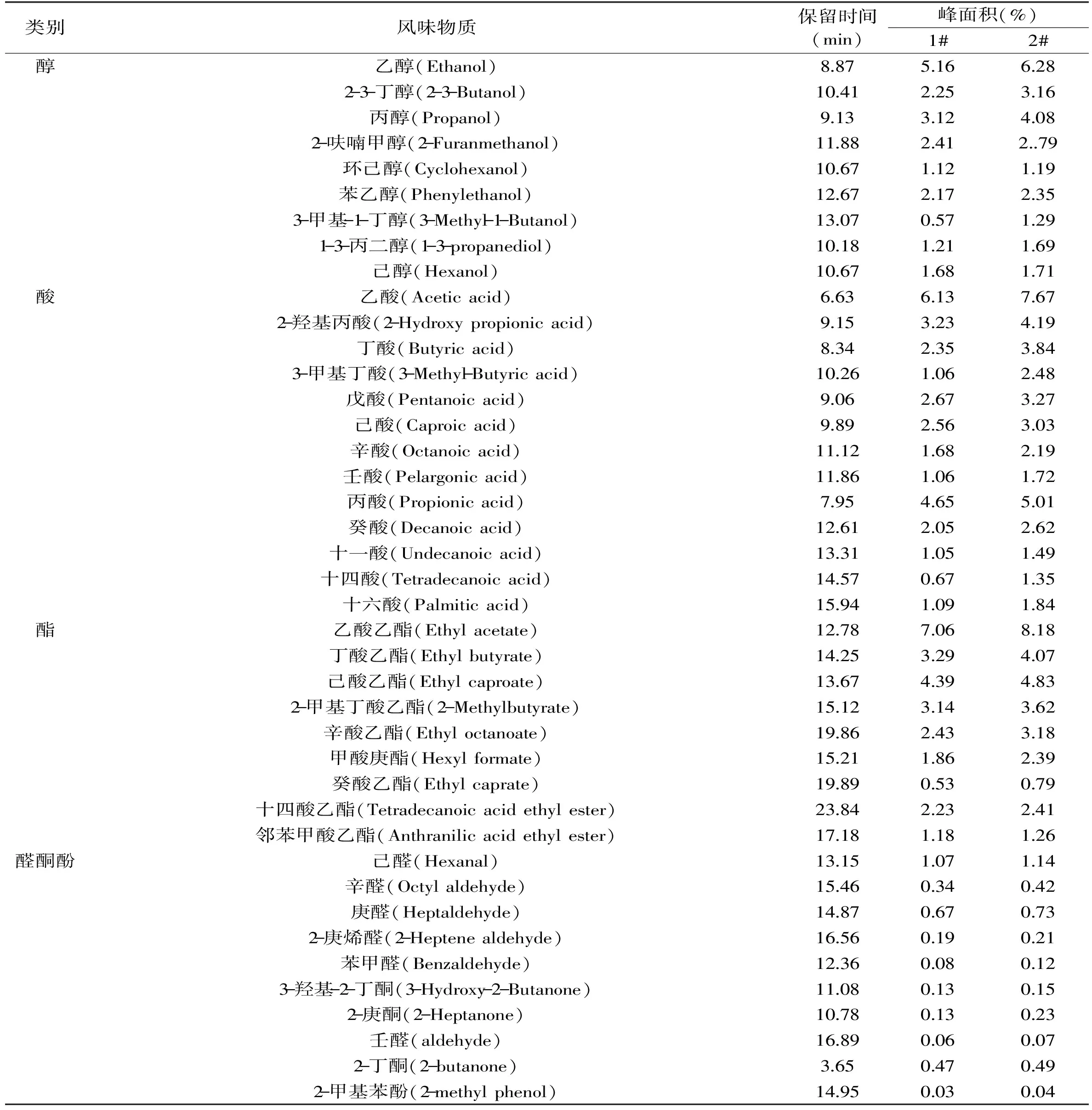
表3 添加发酵剂前后发酵香肠的风味成分Table 3 Flavor component of not adding starter culture and adding starter culture fermented sausage
由表2可知,香肠经副干酪乳杆菌发酵后,氨基酸含量有所提高,呈鲜味的谷氨酸、天门冬氨酸和呈甜味的丝氨酸、甘氨酸、丙氨酸等[10]含量有明显增加。乳酸杆菌可通过水解蛋白质,降解氨基酸产生游离氨基酸[11],对发酵香肠滋味的形成起到一定作用。Herranz等[12]报道乳酸菌的添加可产生大量的游离氨基酸。Nicoletta P等[13]从生物化学及微生物角度研究不同菌种对发酵香肠的影响中指出乳酸菌代谢的蛋白酶可作用于蛋白质产生游离氨基酸。表明,副干酪乳杆菌可以很好的改善发酵香肠的风味,赋予其独特的滋味。
2.4 GC-MS分析发酵香肠中的风味成分
GC-MS方法常被用于挥发性成分的定性和定量测定,用GC-MS检测,利用NIST谱库对质谱图进行检索,并对鉴定出相似度在80%以上的各物质进行峰面积归一化法定量分析。GC-MS分析发酵香肠中的风味成分见表3。
发酵肉制品中的风味物质主要来自肉内组织酶及微生物代谢的酶系作用蛋白质、碳水化合物、脂肪等产生风味物质,包括酸、酯、醇、醛、酮、酚等[3,14]。表3中列出了添加发酵剂前后发酵香肠的挥发性成分的组成及各成分的相对百分含量。由表3可知,添加以副干酪乳杆菌作为发酵剂的香肠中,酸、酯、醇,醛、酮类等物质成分含量有所增加,这些物质是重要的挥发性风味香气组成部分。说明副干酪乳杆菌可以水解脂肪酸释放出大量特征脂肪酸,对增强发酵香肠风味具有一定作用。与Larrouture等[15]的结论相似,乳酸菌具备一定的脂肪分解能力,而脂肪的氧化与分解正是发酵香肠挥发性风味物质产生的一个主要途径。Montel等[16]研究发现乳酸菌利用碳水化合物生成乙酸、甲酸等物质可以赋予香肠独特香气。
3 结论
通过电子鼻、氨基酸分析仪及GC-MS对添加副干酪乳杆菌的发酵香肠从滋味和气味两方面进行总体风味分析得出:添加副干酪乳杆菌的发酵香肠的风味有所改善,氨基酸含量增加,主要是可溶性呈鲜味的谷氨酸、天门冬氨酸和呈甜味的丝氨酸、甘氨酸、丙氨酸等增加较为明显。酯、酸、醇、醛等挥发性风味物质增多。说明副干酪乳杆菌可以很好的改善发酵香肠的风味。
[1]刘晓丽,朱晓阳,翟海港,等. 利用GC-MS-SPME分析发酵香肠的风味[J]. 肉类工业,2008(1):23-24.
[2]刘贯勇.发酵西式火腿的研究[D].苏州:江苏大学,2005.
[3]王恺,慕妮,李亮,等.不同发酵剂对发酵香肠挥发性风味物质的影响[J]. 食品工业科技,2013,15(2):135-137.
[4]Frederic L,Jurgen V,Luc D V. Functional meat starter cultures for improved sausage fermentation[J].International Journal of Food Microbiology,2006,106:270-285.
[5]Fu-Mei Lin,Chiu-Hsia Chiu,Tzu-Ming Pan. Fermentation of a milk -soymilk and Lycium Chinense Miller mixture using a new isolate ofLactobacillusparacaseisubsp. paracasei NTU101 and Bifidobacterium longum[J]. Journal of Industrial Microbiology and Biotechnology,2004,31(12):559-564.
[6]贾洪锋,卢一. 电子鼻在耗牛肉和牛肉猪肉识别中的应用[J]. 农业工程学报,2011,27(5):67-69.
[7]中华人民共和国国家标准.食品卫生检验方法:理化部分(二)GB/T 5009.124-2003,食品中氨基酸的测定
[8]李达,王知松,丁筑红,等.固相微萃取-气-质联用法对干椒烘焙前后风味化合物的分析评价[J]. 食品科学,2009,16(2):269-271.
[9]Eric Hüfner,Christian Hertel.Improvement of Raw Sausage Fermentation by Stress-Conditioning of the Starter Organism Lactobacillus sakei[J].Current Microbiology,2008,57(5):490-496.
[10]武彦文,欧阳杰. 氨基酸和肽在食品中的呈味作用[J].中国调味品,2001(1):21-24.
[11]Møller J K S,Jensen J S.Microbial formation of nitrite-cured pigment,nitrosylmyoglobin,from metmyoglobin in model systems and smoked fermented sausages by Lactobacillus fermentum strains and a commercial starter culture[J]. European Food Research and Technology,2003,216(6):463-469.
[12]Herranz B,Ferna’ndez M,Hierro E,etal. Use of Lactobacillus subspecies NCDO 763 and α-ketoglutarate to improve these quality of dry fermented sausages[J].Meat Science,2004,115(6):151-163.
[13]Nicoletta P,Mangia,Antonio Trani,etal. Effect of the use of autochthonousLactobacilluscurvatus,LactobacillusplantarumandStaphylococcusxylosusstrains on microbiological and biochemical properties of the Sardinian fermented sausage[J].European Food Research and Technology,2013,236(3):557-566.
[14]陈美春,四川腊肉加工贮藏中理化、微生物特性及产香葡萄球菌筛选的研究[D].成都:四川农业大学,2008.
[15]Larrouture C,Ardaillon V,Pepin M,etal. Ability of meat starter cultures to catabolize leucine and evaluation of the degradation products by using an HPLC method[J]. Food Microbiology,2000,17:563-570.
[16]Montel M C,Reitz J,Talon R,etal. Biochemical activities of Micrococcaceae and their effects on the aromatic profiles and odours of a dry sausage model[J]. Food Microbiology,1996,13:489-499.
