实时荧光PCR技术快速检测奶制品中 掺入的大米源性成分
2014-03-22,,*,,,
,,*, ,,
(1.苏州大学医学部公共卫生学院,江苏苏州 215123;2.苏州市产品质量监督检验所,江苏苏州 215128)
奶制品是以生鲜牛(羊)乳及其制品为主要原料,经加工制成的各种食品。因其蛋白质含量高,营养丰富而被人们喜爱,被认为是广大消费者的最佳营养补品。随着人们生活水平的不断提高,奶制品已成为人们生活中重要的组成部分。然而为牟取暴利,部分不法商贩常以低成本的米粉(汤)、淀粉、糊精或植物蛋白掺入奶制品中冒充高价奶成分[1]。这种掺假行为不仅严重影响了奶产业的健康发展,而且降低了奶及奶制品中正常的营养价值,危害了消费者尤其是婴幼儿群体的身心健康。因此,加强对奶制品掺杂掺假的监督管理和检验,以确保消费者的合法权益及安全具有重要的意义。
目前检测奶制品中的米粉(汤)、淀粉、糊精等掺假成分常采用感观检测和化学分析方法,但是该类方法具有人为判断误差大、灵敏度低、特异性差等缺点,已经满足不了市场监督的需要[1-3]。实时荧光PCR技术是在普通PCR技术基础上发展起来的一种核酸技术。它不仅保留了普通PCR技术的特异性好、灵敏度高、准确、快速等优点,而且还避免了普通PCR的需电泳、易污染、低通量的缺点,是分析食品成分及其来源的较好方法。鉴于大米是掺假成分淀粉、糊精及植物蛋白常见的原料之一[4],本研究拟建立实时荧光PCR技术检测奶制品中掺入的大米源性成分。
1 材料与方法
1.1 材料与仪器
香蕉、红枣、菠萝、草莓、西红柿、核桃、大豆、花生、小麦、大麦、玉米、高粱、鲜牛奶、鲜羊奶、大米用于特异性检测 市购;13份生鲜乳、2份婴儿奶米粉、1份婴儿配方羊奶粉、4份婴儿配方牛奶粉、1份固体乳饮料 苏州市产品质量监督检验所提供;动物基因组DNA提取试剂盒、植物基因组DNA提取试剂盒 天根生化科技有限公司;无水乙醇 分析纯;TaqMan Universal PCR master mix 美国ABI公司;10×PCR buffer、Taq酶、dNTP Mixture、DNA Marker 宝生物工程(大连)有限公司。
5810 型台式高速冷冻离心机 德国Eppendorf公司;BioPhotometer plus 核酸蛋白含量测定仪 德国Eppendorf公司;7500 fast real time PCR仪 美国ABI公司;DKB-1915型恒温水浴槽 BIO-RAD公司;ER-200A凝胶成像系统 上海复日科技有限公司;JFSD-100型粉碎机 上海日晖微电机厂等。
1.2 实验方法
1.2.1 样品制备 使用粉碎机将大豆、大米、玉米、高粱、大麦、小麦等样品磨成粉状,并过80目筛备用;采用组织研磨器处理香蕉等水果样品。不同样品分开处理,以防止交叉污染。
1.2.2 DNA提取 鲜牛奶、鲜羊奶等液体样品[5]:取10mL样品,1500×g离心15min,去上清;将沉淀重新悬浮于2mL PBS中,12000×g离心5min,如此重复3次,最终将沉淀悬浮于200μL PBS中。然后按照细胞组织基因组DNA提取试剂盒进行。
水果样品:按照植物基因组DNA提取试剂盒说明书操作步骤进行。
奶粉及其与大米粉的混合样品、市售奶制品等其它样品:按照细胞组织基因组DNA提取试剂盒进行,其步骤略作修改,使蛋白酶K消化过夜。
最终提取出OD260/OD280比值均在1.5~2.0之间的动植物组织DNA备用。
1.2.3 引物和探针 查阅文献[6-10],兼顾方法的特异性及灵敏度,终选择水稻的内源性保守基因根部表达基因(gos9)作为靶基因(GenBank:D10956.1)。利用Primer express 3.0 软件设计引物及探针,扩增目的片段长度为113bp。引物探针由上海生工生物工程技术公司合成,具体序列信息见表1。
PCR反应体系:10×PCR Buffer 5μL,10μmol/L上、下游引物各5μL,2.5μmol/L dNTP 5μL,2U/μL Taq酶lμL,模板DNA 1μL,灭菌去离子水28μL。反应条件:94℃预变性5min;94℃变性50s,65℃退火40s,72℃延伸40s,30个循环;72℃延伸5min。PCR反应结束后进行2%浓度的琼脂糖凝胶电泳。

表1 引物探针序列Table 1 Sequences of primers and probe
1.2.4 实时荧光PCR反应 实时荧光PCR采用25μL反应体系:ABI Taqman Gene Expression Master Mix,12.5μL;上、下游引物,荧光标记探针,各1μL,终浓度皆为 10μmol/L;模板 DNA 2μL;其余不足用灭菌双蒸水补齐。反应循环参数为:50℃,2min;95℃,10min;95℃,15s;60℃,1min,40个循环。使用7500 software V2.0.6进行数据分析。
1.2.5 特异性实验 阴性对照组选择市场上奶制品中最常添加的动植物源性成分:香蕉、红枣、菠萝、草莓、西红柿、核桃、大豆、花生、小麦、大麦、玉米、高粱、牛奶、羊奶,阳性组选择大米。提取其DNA模板,用灭菌双蒸水稀释至25ng/μL。各取2μL,各做3个平行,分别进行实时荧光 PCR 反应,以进行特异性实验。
1.2.6 灵敏度实验 取纯大米DNA提取原液浓度约为 50ng/μL,按十倍倍比稀释法进行稀释,共7个稀释度稀释至0.0005ng/μL。各取2μL作为模板进行实时荧光PCR 反应以检测该方法的灵敏度。每个浓度检测重复3次。
1.2.7 模拟样品中大米成分检测 为进一步评估该方法的灵敏度及可行性,将大米粉用全脂牛奶粉稀释至质量百分含量分别为5%、1%、0.5%、0.1% 制成4个浓度的模拟样品。对每个混合样品提取DNA模板,各3个平行进行实时荧光PCR反应,以检验该方法用于模拟样品的灵敏度。
2 结果与分析
2.1 引物有效性验证
利用所设计的引物,对大米模板DNA 进行PCR扩增后电泳分析。由图1可以看出,4个大米样品皆扩增出约113bp的DNA片段,与预期所设计目的片段长度相符。该结果表明本研究设计的引物对目标DNA的扩增是特异有效的。
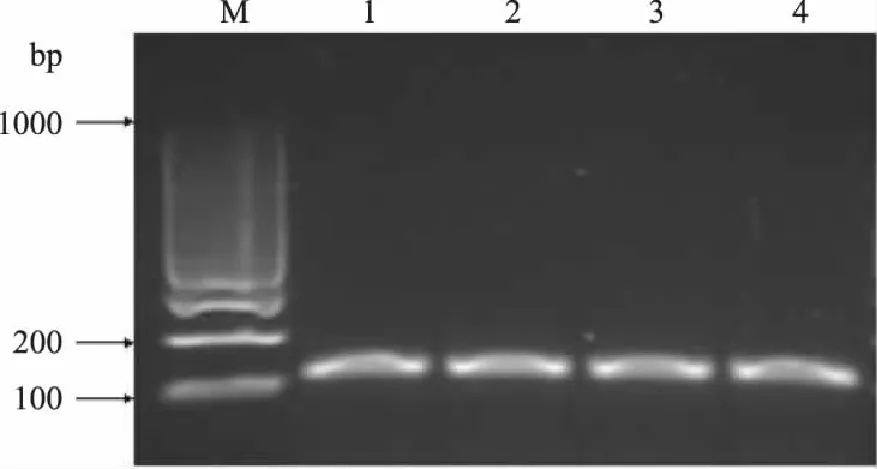
图1 PCR产物电泳图 Fig.1 Gel electrophoresis of PCR products
2.2 特异性实验结果
对香蕉、红枣、菠萝、草莓、西红柿、核桃、大豆、花生、小麦、大麦、玉米、高粱、牛奶、羊奶、大米的样本分别提取DNA,选取OD260/OD280比值在1.5~2.0的DNA模板进行实时荧光PCR反应,以避免因模板质量不好而出现假阴性结果。同时以水代替模板DNA作为空白对照以控制污染。荧光PCR结果如图2所示,在40个循环之内,只有大米DNA获得了正常扩增曲线,对奶类主成分牛奶、羊奶、其它谷类和植物性食物对照样品均无交叉扩增曲线,说明该引物探针体系特异性好。
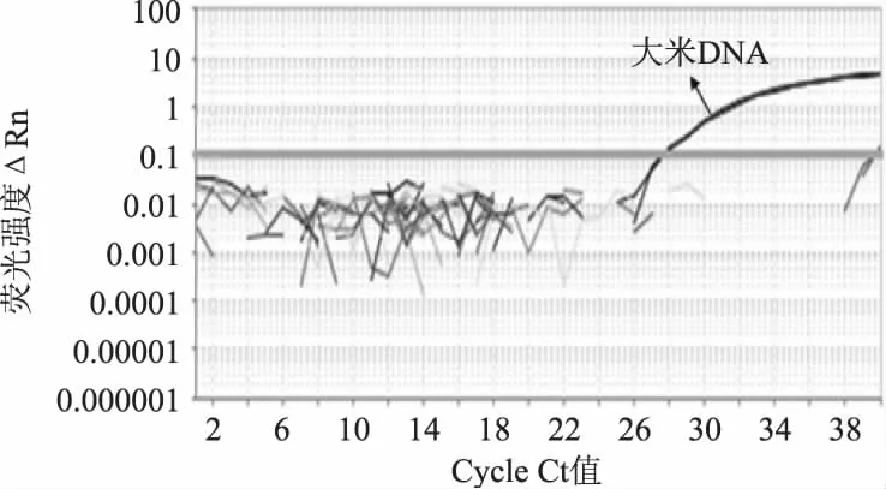
图2 大米特异性实验扩增结果 Fig.2 Specific amplification results of rice DNA fragments
2.3 灵敏度实验结果
利用建立的该引物探针体系分别对100~0.001ng的纯大米DNA进行实时荧光PCR扩增。由表2可知,含量为0.1~100ng的纯大米DNA的Ct值在 26~38 之间,且重复性好。而0.01、0.001ng的纯大米DNA 未检测到Ct值,说明0.01、0.001ng的大米DNA无法正常扩增出来。故该方法的检测灵敏度为0.1ng的纯大米DNA。

表2 灵敏度实验结果Table 2 Results of the sensitivity test
2.4 模拟样品中大米成分检测结果
对含大米粉的质量分数为5%、1%、0.5%、0.1%的奶粉样品的DNA 进行实时荧光PCR检测。每个质量分数各做3个平行,结果显示,5%、1%、0.5%、0.1%质量分数的样品均出现扩增曲线,Ct值在27~35之间(见图3)。由此可判断,该方法可检测到奶制品中大米粉含量在0.1%(W/W)的样品。

图3 奶粉样品检出限结果 Fig.3 Results of the detection threshold analysis for milk powder samples
2.5 市售奶制品的检测结果
为进一步验证该方法的实用性和准确性,对苏州市产品质量监督检验所提供的13份生鲜乳、2份婴儿奶米粉、1份婴儿配方羊奶粉、4份婴儿配方牛奶粉、1份固体乳饮料共计21份市场抽检奶类样品进行检测。
结果显示,只有食品标签标识的原料成分中含有大米成分的婴儿奶米粉和标识含有大米淀粉成分的婴儿配方羊奶粉出现正常扩增曲线,Ct值在26~33左右(见图4),其它均未有扩增曲线。结果表明该方法能正确的检测出市售的加工奶制品中的大米成分。说明该方法的检测灵敏度和特异性可以满足市售奶类样品的实用性检测需要,结果可靠,可用于奶类食品掺加大米成分的检测和鉴定。

图4 市售样品检测结果 Fig. 4 Test results of commercial samples
3 讨论
目前国内外用于食品掺假掺伪检测的新兴方法主要有光谱分析法(近红外、中红外、拉曼光谱、核磁共振光谱、稳定同位素和荧光光谱)、色谱分析(气相和高效液相)、电子鼻、生物技术(DNA 技术和酶联免疫)等[11-12]。其中利用新兴技术对奶制品掺加米粉(汤)、淀粉、糊精或植物蛋白等植物成分进行检测的研究也有报道,如利用近红外光谱分析法检测奶粉中掺加大豆、豌豆或小麦来源的植物蛋白成分或对掺有植物奶油,植物蛋白,淀粉等植物填充物的牛奶进行检测鉴别[13-14];利用高效液相色谱分析法对掺伪脱脂奶粉中的植物蛋白成分进行检测的研究[15]。但上述检测方法有的需要预先构建掺假模型,且主要检测对象是蛋白质,受食品加工方式影响较大,方法的稳定性和特异性较差,因此均未纳入国家标准。基于DNA的实时荧光PCR方法是一种新兴检测技术,不受加工方式的影响,从掺假成分的来源进行分析,可以弥补上述检测方法的不足。
根部表达的水稻基因(rice root-specific,gos9)和蔗糖磷酸合成酶(Sucrose Phosphate Synthase,SPS)基因是目前用于大米成分检测常选用的内源性基因,其适用性已被国内外不少研究者所认可[6-9]。其中前者是低拷贝基因,后者是单拷贝基因,兼顾方法的特异性和灵敏度,本研究选用根部表达的水稻基因(gos9)作为靶基因设计引物探针,扩增目的片段长度仅为113bp,受食品加工影响较少。经实验验证:本方法特异性强,在扩增的40个循环之内,只有大米DNA出现特异性扩增,阴性对照组的14种奶类主成分及可能出现在奶类产品中的植物源性成分均无交叉扩增(见图2);同时也获得了较高的灵敏度,对大米DNA的检出限为0.1ng,对奶粉模拟样品中大米成分的检测限为0.1%(W/W)。远高于Lopez[16]等以甜菜碱醛脱氢酶2(Betaine aldehyde dehydrogenase 2,BAD2)基因为靶基因建立的TaqMan 实时荧光PCR方法的灵敏度,后者对纯米DNA检出限为1ng,对印度香米中掺加的非印度香米的检出限1%。与Hernández等[10]同样以gos9基因为靶基因建立的检测大米成分的实时荧光PCR方法的检出限0.1ng相同。经市售奶制品样品的应用性检测验证,该方法准确性好,只对含有大米成分的婴儿奶米粉和含大米淀粉成分的婴儿配方羊奶粉呈现阳性扩增,而对不含大米源性成分的其他奶样品均无扩增(见图4)。实验结果与食品标签标识完全一致,说明该方法能够满足奶制品中掺加大米源性成分检测的需求。
研究结果表明本研究建立的方法具有快速、简便、特异、灵敏、准确等优点,可用于市场监督奶制品中大米源性成分掺杂掺假的检测。
[1]赵光华,胡京枝,金明奎. 乳品中常见掺假手段及其鉴别[J].质量监督与检验,2007(4):30-31.
[2]孙鹏,王俊,王加启. 牛乳掺假物质及其快速检测方法研究[J]. 中国奶牛,2009(9):48-49.
[3]许家喜. 蛋白质的检测方法与乳制品中蛋白含量测定[J].大学化学,2009,24(1):66-69.
[4]张晶,刘亚伟,刘洁,等.化学改性麦芽糊精在食品工业中的应用[J].粮食与饲料工业,2010(4):27-29.
[5]Dalmasso A,Sacchi P,Bottero MT. Development of a real-time PCR assay for the detection of cow and donkey milk[J].European Food Research and Technology,2012,235(1):47-52.
[6]Ding J,Jia J,Yang L,etal. Validation of a Rice Specific Gene,Sucrose Phosphate Synthase,Used as the Endogenous Reference Gene for Qualitative and Real-Time Quantitative PCR Detection of Transgenes[J].Journal Agriculture and Food Chemistry,2004,52(11):3372-3377.
[7]Jiang LX,Yang LT,Zhang HB,etal. International Collaborative Study of the Endogenous Reference Gene,Sucrose Phosphate Synthase(SPS),Used for Qualitative and Quantitative Analysis of Genetically Modified Rice[J].Journal Agriculture and Food Chemistry,2009,57(9):3525-3532.
[8]Wang C,Jiang LX,Rao J,etal. Evaluation of Four Genes in Rice for Their Suitability As Endogenous Reference Standards in Quantitative PCR[J].Journal Agriculture and Food Chemistry,2010,58(22):11543-11547.
[9]Zhang Li,Cao Yinglong,Liu Xin,etal. In-depth analysis of the endogenous reference genes used in the quantitative PCR detection systems for rice[J].European Food Research and Technology,2012,234(6):981-993.
[10]Hernández M,Esteve T,Pla M . Real-time polymerase chain reaction based assays for quantitative detection of barley,rice,sunflower,and wheat[J]. Journal Agriculture and Food Chemistry,2005,53(18):7003-7009.
[11]赵燕,李建科.现代技术在食品真伪和产地鉴别中的应用[J].食品研究与开发,2007,28(9):157-161.
[12]Reid LM,O'donnell CP,Downey G. Recent technological advances for the determination of food authenticity[J]. Trends in Food Science & Technology,2006,17(7):344-353.
[13]Maraboli A,Cattaneo TMP,Giangiacomo R. Detection of vegetable proteins from soy,pea and wheat isolates in milk powder by near infrared spectroscopy[J]. Journal of Near Infrared Spectroscopy,2002,10(1):63-69.
[14]李亮,丁武.掺有植物性填充物牛奶的近红外光谱判别分析[J].光谱学与光谱分析,2010,30(5):1238-1242.
[15]Luykx DMAM,Cordewener JHG,Ferranti P,etal. Identification of plant proteins in adulterated skimmed milk powder by high-performance liquid chromatography-mass spectrometry[J].Journal of Chromatography A,2007,1164:189-197.
[16]Lopez SJ. TaqMan based real time PCR method for quantitative detection of basmati rice adulteration with non-basmati rice[J]. European Food Research and Technology,2008,227(2):619-622.
